首页 > 医疗资讯/ 正文
摘 要
目的:全球领导人营养不良倡议(GLIM)标准已逐渐成为评估营养状况的主要方法之一。本研究旨在基于GLIM标准建立列线图(nomogram),结合其他预后因素预测肝硬化失代偿期患者的长期死亡率并对其预测性能进行外部验证。
方法:推导队列包括301例因肝硬化相关急性损伤入院的患者,验证队列则包含来自另一家三级医院的101名受试者。通过整合GLIM标准,构建了两个列线图以预测1年全因死亡率。根据上述模型,将研究人群分为低、中和高风险死亡率组。
结果:在多变量Cox回归分析中,分别校正Child-Turcotte-Pugh(CTP)分级(Nomo#1)或终末期肝病模型(MELD-Na)评分(Nomo#2)后,GLIM标准与1年死亡率独立相关(Nomo#1 HR = 3.139, P <0.001;Nomo#2 HR = 3.456, P <0.001)。Nomo#1和Nomo#2的C-index和时间依赖AUC显著优于单独的GLIM标准或传统评分系统。低风险组的生存率显著高于中风险和高风险组(Nomo#1:95% vs 65.8% vs 33.3%, P <0.001;Nomo#2:94.3% vs 64.5% vs 25%, P <0.001)。此外,在外部验证队列中,本研究提出的模型展现出中等预测准确性,能够识别出合并营养不良且生存状况较差的患者。
结论:GLIM标准定义的营养不良对失代偿期肝硬化患者的长期死亡率有负面影响。本研究建立的列线图具有足够的区分能力,且具有一致性和临床获益,支持其在日常临床实践中的广泛应用。
关键词:GLIM;肝硬化;列线图;营养不良;死亡率;预后
众所周知,营养不良可能导致诸多不良健康后果和不利结局,如残疾、衰弱、生活质量下降、发病率和死亡率增加。肝脏是主要负责处理和代谢各种营养物质的器官,与营养状态密切相关。失代偿期肝硬化患者常伴有显著的肝功能障碍、各种并发症以及治疗相关问题(例如反复的套扎或腹腔穿刺放液治疗),这些都可能是营养不良发展和恶化的诱因。尽管越来越多的研究关注到在肝硬化急性失代偿期患者中,营养不良对结局的关键作用,但目前用于肝硬化患者的主要评估工具或广泛使用的评分系统,如Child-Turcotte-Pugh(CTP)分级和终末期肝病模型(MELD)评分系统,并未将反映营养状态的指标纳入其中。
最近,全球领导人营养不良倡议(GLIM)专家组启动并推荐了一种标准化流程用来协调不同人群、不同临床场景下诊断营养不良的方案[1]。
该工具自推出以来,在医学领域的关注度迅速上升,并得到了广泛的应用。相应地,越来越多的证据表明GLIM定义的营养不良在肝硬化背景下具有预测价值,能够评估预后。然而,目前已发表的研究尚存不足之处,例如缺乏独立外部验证的确切数据,或者没有提供便于在日常临床实践中使用的工具。而列线图,作为临床医学决策领域中广泛认可的一种图形化工具和视觉图表,可以将临床特征和生物标志物整合到一个图形中,以便进行复杂的计算并提供更精细的风险分层。鉴于其能通过结合临床、影像学和分子生物学指标,为特定患者临床事件的发生提供估算概率,并且预测临床结局/诊断终点,列线图在不同场景中已得到迅速普及和广泛应用。值得注意的是,GLIM定义的营养不良已被纳入部分针对不同恶性肿瘤患者或接受介入治疗患者的预测列线图中[2]。
因此,本研究旨在探讨GLIM定义的营养不良,对因肝硬化急性失代偿住院患者1年全因死亡率的影响,并进一步构建和验证结合GLIM及其他独立预后预测因素的列线图。
一、方法
1. 研究人群
本研究为回顾性研究,分析了2020年至2022年期间在天津医科大学总医院消化内科因急性失代偿事件入院的肝硬化患者。纳入标准为年龄≥18岁,且临床表现、实验室结果、影像学检查、病理检查等符合肝硬化诊断的患者。肝硬化相关急性失代偿定义包括:国际腹水俱乐部标准定义的腹水(通过体格检查或超声检查确定:1级/2级/3级分别提示轻度/中度/大量腹水)、根据West Haven标准定义的肝性脑病(HE)分级(I~IV级)以及内镜检查评估的食管胃底静脉曲张。
排除标准包括:初次评估时合并慢加急性肝衰竭(ACLF),疑似或确诊的肝细胞癌/肝外肿瘤,缺少全面营养状态数据,拒绝定期出院后随访。ACLF的诊断依据为亚太肝脏研究协会指南,即在肝硬化或慢性肝病患者中,4周以内出现黄疸(TBIL ≥85μmol/L)、凝血功能异常(PT-INR ≥1.5),以及体格检查确诊的腹水和/或HE。在排除33例肝衰竭患者、28例疑似或确诊癌症患者以及38例数据不完整或拒绝随访的患者后,最终纳入301例肝硬化患者用于开发预测模型(列线图)并进行内部验证。此外,来自成都市第三人民医院消化内科2021年至2022年期间的101例患者组成的独立队列作为外部验证队列。所有用于外部验证的受试者均应用与推导队列相同的纳排标准。
2. 数据获取与随访
从电子病历中获取了患者的以下信息:人口学特征(年龄、性别)、临床特征(BMI、腰围、病因、肝硬化相关并发症)以及实验室检查结果。实验室检查项目包括白细胞计数(WBC)、红细胞计数、血小板计数、血红蛋白、中性粒细胞/淋巴细胞比率(NLR)、血小板/淋巴细胞比率(PLR)、白蛋白、TBIL、丙氨酸氨基转移酶、碱性磷酸酶(ALP)、钠、肌酐以及PT-INR。基于相关指标,计算了两种用于评价肝病严重程度的评分系统: CTP分级和终末期肝病模型(MELD-Na)评分。鉴于失代偿期肝硬化患者常伴有体液潴留,本研究全程使用了患者的干体重。具体计算方法如下:对于轻度腹水患者,从其体重中扣除5%;中度腹水患者扣除10%;大量腹水患者扣除15%,若同时伴有外周水肿则再额外扣除5%。相应地,BMI也基于干体重进行计算。本研究的主要终点为1年全因死亡率。所有患者在出院后均接受了定期随访,随访时间点分别为出院后1个月、3个月、半年和1年。
3. 营养状况评估
GLIM标准的评估流程已有详细描述。简而言之,GLIM工作组推荐采用两步法,暨结合营养风险筛查和诊断评估。在本研究中,初步筛查采用经验证的英国皇家自由医院营养优先工具(RFH-NPT)。RFH-NPT评分≥1的患者被归类为存在营养不良风险。随后,满足至少一项表现型(即非自主体重减轻、低BMI和肌肉含量减少)以及至少一项病因型标准(即食物摄入或吸收减少和炎症或疾病负担)的受试者被判定为营养不良。
关于表现型标准:非自主体重减轻是通过比较过去6个月内记录的体重与入院时测量的体重来评估 (× 100%)。低BMI是基于干体重进行判断,采用亚洲人群推荐的参考值(年龄小于70岁时<18.5 kg/m²,年龄大于70岁时<20 kg/m²)。肌肉含量减少是通过CT测量的肌肉量来评估的,这也是终末期慢性肝病背景下肌肉含量评估的金标准。本研究中肌肉含量减少的截断值指基于性别调整的骨骼肌指数,我们前期的研究已证明其在失代偿期肝硬化患者能够用于预后评估(男性<46.96 cm²/m²,女性<32.46 cm²/m²)。需要强调的是,失代偿期肝硬化作为终末期肝病的典型病生理改变,其发生进展与严重的疾病负担和广泛的炎症密切相关。
二、研究结果
1. GLIM标准下的临床特征
共纳入301例失代偿期肝硬化患者作为推导队列,101例作为外部验证队列。应用GLIM标准,推导队列中有121例(40.2%)患者被判定为营养不良,验证队列中有57例(56.4%)患者被判定为营养不良。在所有队列中,低BMI是最常见的表现型标准。非自主体重减轻、低BMI和肌肉含量减少所定义的营养不良分别出现在59例、84例和35例患者中。值得注意的是,营养不良的患者年龄较大且以男性为主,其BMI、白蛋白、血钠水平较低,CTP-A级的占比较低,而WBC、NLR、PLR、TBIL、ALP、肌酐、PT-INR、MELD-Na评分较高,酒精性肝病的比例更高,且腹水的发生率也更高。
2. 生存分析
在Kaplan-Meier生存曲线分析中,营养状况正常的患者生存状况明显优于营养不良的患者(log-rank检验,P < 0.0001,图1)。在随访期间,正常营养组和营养不良组分别记录了14例和43例死亡,生存率分别为92.2%和64.5%。总体而言,死亡归因于器官衰竭26例、败血症10例、严重静脉曲张出血9例、HE恶化6例,以及6例不明原因。
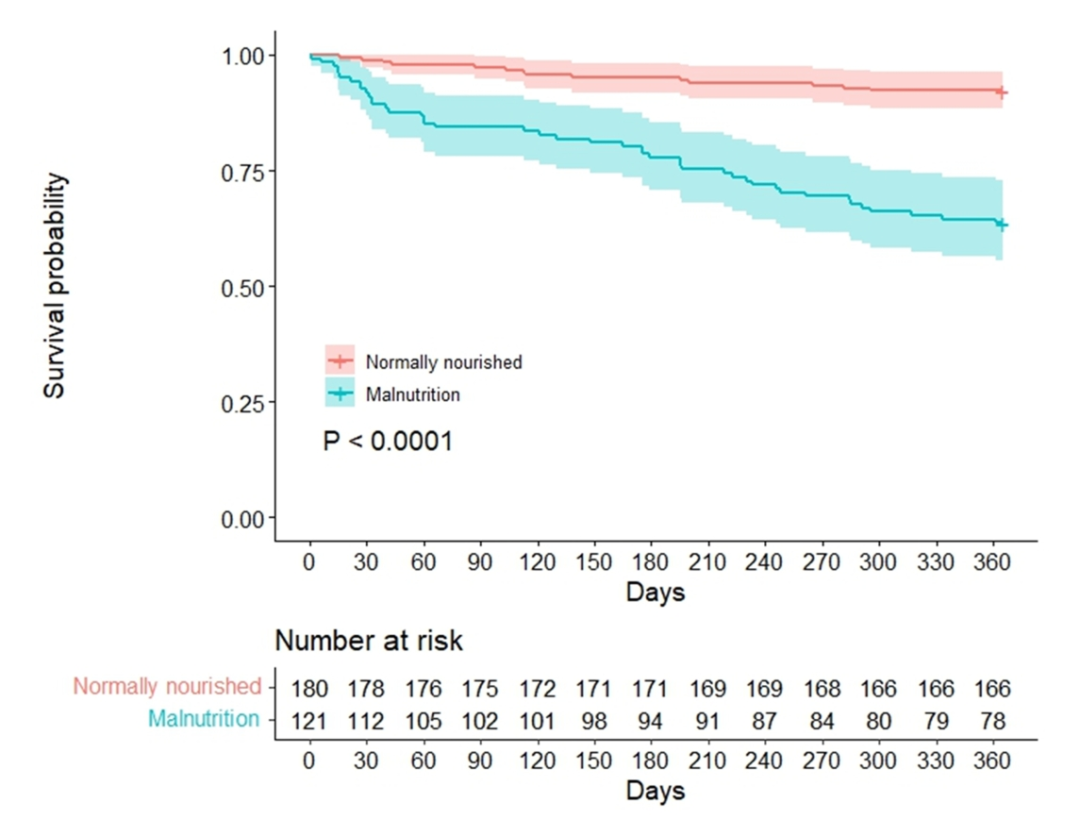
图1 根据GLIM标准分类的1年全因死亡率Kaplan-Meier生存曲线
3. 与死亡相关的预测因素
图2A展示了基于CTP分级的模型结果森林图。在调整NLR、PLR、ALP、肌酐和酒精病因后,多变量Cox回归分析显示,GLIM定义的营养不良(HR = 3.139, 95% CI: 1.670-5.901, P <0.001)、低钠血症和较高的CTP分级是全因死亡率的独立预后预测因素。另一方面,图2B展示了MELD-Na评分模型结果的森林图。在调整NLR、PLR、腹水和HE后,GLIM定义的营养不良(HR = 3.456, 95% CI: 1.809-6.602, P <0.001)、低蛋白血症、酒精病因和MELD-Na评分仍然是全因死亡率的独立预后预测因素。
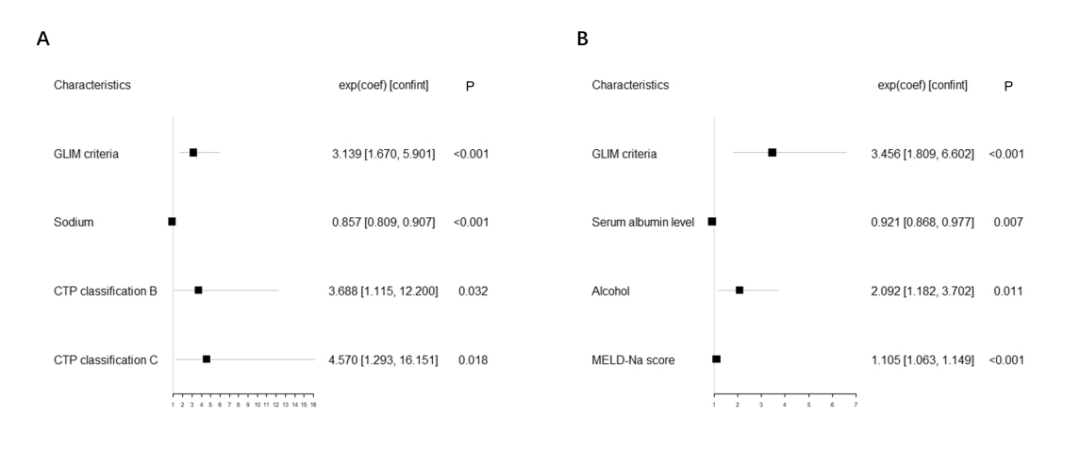
图2 在CTP模型(A)和MELD-Na模型(B)中,多变量Cox回归分析GLIM定义的营养不良与1年全因死亡率之间的关联
4. 列线图及其性能
基于上述独立变量,分别整合CTP分级(Nomo#1)和MELD-Na评分(Nomo#2)构建了两个列线图(图3A/F)。每个变量对应的评分相加得到总评分,随后映射到底部的1年生存率概率刻度上。Nomo#1在推导队列中的C-index为0.808(95% CI: 0.769-0.847),在验证队列中为0.741(95% CI: 0.702-0.780)。此外,Nomo#1在推导队列和验证队列中的AUC分别为0.847和0.786,时间依赖 AUC在1年全因死亡率的预测中显示出持续良好的区分能力(图3C/D,图4B/C)。Nomo#1的校准曲线揭示了两个队列中预测生存率与实际观察生存率之间存在良好相关性(图3B,图4A)。
同样地,Nomo#2的C-index在推导队列中为0.837(95% CI: 0.798-0.876),在验证队列中为0.719(95% CI: 0.680-0.758)。在推导队列和验证队列中,Nomo#2的AUC分别为0.873和0.749(图3H,图4F)。Nomo#2的时间依赖ROC曲线下面积和校准曲线显示了预测的1年生存率与实际生存率之间的一致性和相关性(图3G/I, 图4E/G)。

图3 在推导队列中,分别整合了CTP分级(Nomo#1)或MELD-Na评分(Nomo#2)的列线图模型
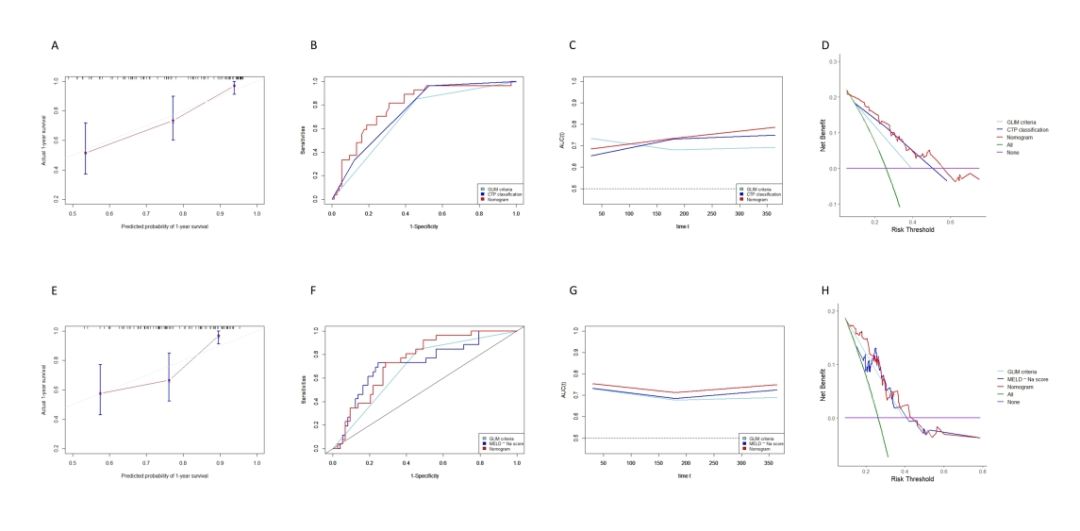
图4 在验证队列中列线图的性能和临床应用
5. 列线图的临床应用
图3E/J和图4D/H分别展示了推导队列和验证队列中Nomo#1和Nomo#2的决策曲线。决策曲线清晰地显示,与单独使用GLIM标准或传统评分(即CTP分级或MELD-Na评分)相比,本研究提出的模型具有更好的临床获益。基于Nomo#1,我们从每位患者中获得了总预后评分,并根据X-tile确定的阈值进一步将推导队列分为三个死亡风险组:低风险(<7.6分)、中风险(7.6-10分)和高风险(>10分)。生存曲线提示Nomo#1在两个队列中对失代偿期肝硬化患者的1年全因死亡率具有良好的预测价值(图5 A/C)。
基于Nomo#2,推导队列中的患者也被分为低风险(<10.7分)、中风险(10.7-14.2分)和高死亡风险(>14.2分)组。相应地,生存曲线也证明该模型适用于预测两个队列中患者的1年生存率(图5B/D)。
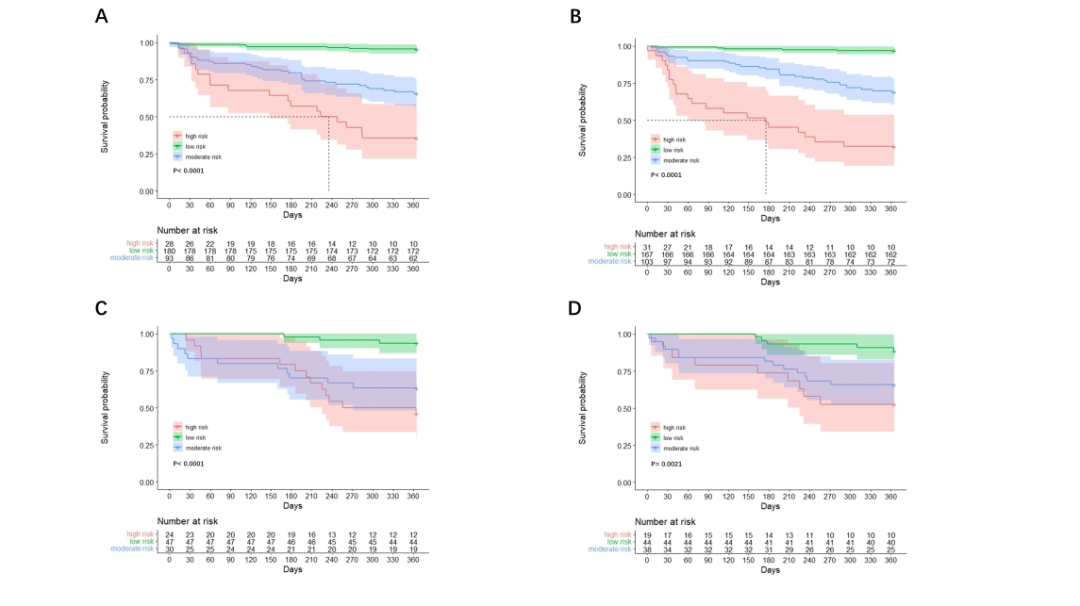
图5 在推导队列(A, B)和验证队列(C, D)中,两个列线图的Kaplan-Meier生存曲线
三、讨论
本研究首次将GLIM标准与其他显著预后因素相结合,构建并验证了用于预测肝硬化患者发生急性失代偿事件后1年全因死亡率的列线图。即便在调整潜在疾病严重程度后,根据GLIM定义的营养不良仍与死亡风险增加3倍有关。
基于C-index、校准曲线和决策曲线分析的结果,我们所提出的模型展现出良好的区分能力、较高的一致性以及不俗的临床获益。此外,生成的列线图中也能够对死亡风险进行有效分层。值得注意的是,这些预测模型的临床有效性和实用价值在独立外部验证队列中也得到了进一步的确认。
在肝硬化背景下,营养不良的发病机制因复杂且涉及多种影响因素而备受关注。总体而言,这些诱因包括由于厌食或早饱导致的摄入减少、吸收不良、静息能量消耗增加、宏量营养素代谢失调、肠道菌群失调以及久坐不动的生活方式。此外,失代偿事件的发生以及反复采取治疗措施也会进一步加重衰弱状态。在这方面,大量文献已经阐明了营养不良与多种结局之间的密切联系,包括死亡率、非计划再入院、医疗成本增加以及生活质量下降。采取及时有效营养治疗的关键在于准确识别处于营养不良风险或正罹患营养不良的患者。多个学术团体也反复强调了在肝硬化背景下进行营养筛查和评估的临床意义。
然而,对这部分人群进行营养不良的评估仍颇具挑战性甚至存在困难,这归咎于肝硬化多伴随液体潴留和病生理剧变。为了克服上述问题并细化营养不良诊断,目前已经开发并提出了一些特定的方法,例如利用RFH-NPT工具和通过CT测定的骨骼肌含量。新近推出的GLIM标准,作为一个通用工具包,涵盖了大多数主要的营养指标[3]。因此,本研究集中于应用GLIM标准来识别具有较高死亡风险的患者,并通过构建相应的列线图验证GLIM定义的营养不良对预后影响。为了确认我们提出模型的有效性和普适性,同时使用独立队列进行了外部验证。
既往部分研究已经详细阐述了根据GLIM定义的营养不良对肝硬化患者产生的负面影响,包括住院时间延长、短期/长期整体死亡率上升等。例如,一项包含1002名成年中国肝硬化患者的大型队列研究发现,根据GLIM标准定义的营养不良患病率为34.3%,且营养不良的存在与腹水、自发性细菌性腹膜炎和院内死亡等不良结果密切相关。上述研究中估算的营养不良患病率与本研究之间的差异可能归因于使用不同的营养筛查工具、关于低肌肉含量采用不同的截断值,以及病因型标准的不一致。
在当前研究中,营养不良组的患者死亡风险显著更高。多变量Cox分析表明,GLIM定义的营养不良、血清白蛋白、钠、酒精病因,以及两个反映肝病严重程度的传统指标CTP分级和MELD-Na评分,仍然是1年全因死亡率的独立预测因子。有鉴于此,我们分别开发了两个独立的列线图,一个结合CTP分级,另一个结合MELD-Na评分,并将这些与其他所有预后因素整合在一起。
MELD评分(例如MELD-Na)和CTP分级是评估终末期肝病预后的重要指标。然而,这些工具的临床效果和实际应用价值依赖于特定的临床情境和目标人群,且结果异质性较大[4]。
此外,原始终末期肝病模型(MELD)评分的预测能力逐年逐渐减弱,并且在预测并发症未来发展的表现方面仍存在争议。在此方面,为了提高预后价值,已经对上述评分做出了相应改进,但在预测失代偿期肝硬化患者的死亡风险方面仍显不足,且在住院患者中更为明显。最近,MELD评分的一个迭代版本即MELD 3.0,通过增加女性性别和血清白蛋白两个因子而显著提高了预测能力,并逐渐被临床认可采纳[5]。
但需要提请注意的是,低蛋白血症其实意味着肝脏储备功能严重受损。这种变化难以通过外部用药实现根本性改善,相应治疗措施仅能起到短暂调节作用,这就使白蛋白输注成为临床不可或缺的手段。因此,全面了解肝硬化阶段的病生理功能紊乱对于早期干预和有效管理不无裨益。在本研究中,依据GLIM确定的两种模型,通过 C-index/ 时间依赖AUC、校准曲线和决策曲线分析等一系列评估,均展现出出色的鉴别能力、密切的相关性以及显著的临床获益。此外,这些结果在独立的验证队列中得到进一步证实。以上两种列线图不仅在临床实践中便捷易用,还为临床医生和患者提供了友好直观的交流平台,彰显出一定的实用优势。
四、结论
总之,根据GLIM标准定义的营养不良对失代偿期肝硬化患者的长期死亡率具有显著负面影响。
【参考文献】
[1] Jensen GL, Cederholm T, Correia M, et al. GLIM Criteria for the Diagnosis of Malnutrition: A Consensus Report From the Global Clinical Nutrition Community. JPEN J Parenter Enteral Nutr 2019; 43: 32-40. DOI: 10.1002/jpen.1440.
[2] Liu Z, Shen Z, Zang W, et al. Development and Validation of Global Leadership Initiative on Malnutrition for Prognostic Prediction in Patients Who Underwent Cardiac Surgery. Nutrients 2022; 14. DOI: 10.3390/nu14122409.
[3] Correia M, Tappenden KA, Malone A, et al. Utilization and validation of the Global Leadership Initiative on Malnutrition (GLIM): A scoping review. Clin Nutr 2022; 41: 687-697. DOI: 10.1016/j.clnu.2022.01.018.
[4] Peng Y, Qi X and Guo X. Child-Pugh Versus MELD Score for the Assessment of Prognosis in Liver Cirrhosis: A Systematic Review and Meta-Analysis of Observational Studies. Medicine (Baltimore) 2016; 95: e2877. DOI: 10.1097/MD.0000000000002877.
[5] Guo G, Yang W, Li J, et al. The Development and Appraisal of MELD 3.0 in Liver Diseases: Good Things Never Come Easy. Journal of Clinical and Translational Hepatology 2024; 000: 000-000. DOI: 10.14218/jcth.2024.00303.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)