首页 > 医疗资讯/ 正文
天然免疫是机体抵御病原体入侵的第一道防线,其中OAS-RNase L通路是一种经典的抗病毒天然免疫通路。当细胞内的OAS感应到双链RNA(dsRNA)时,会合成2-5A作为第二信使,激活RNase L,进而降解病毒和宿主的RNA,触发I型干扰素(IFN-I)信号通路和细胞死亡。然而,以往研究多聚焦于该通路的细胞内功能,而2-5A是否能够在细胞间传递以扩展天然免疫信号尚不清楚。
近日,美国德克萨斯大学西南医学中心、克利夫兰诊所等机构的研究团队在国际权威期刊Immunity上在线发表了提问“OAS cross-activates RNase L intercellularly through cell-to-cell transfer of 2-5A to spread innate immunity”的最新研究成果。该研究揭示了OAS-RNase L通路中2-5A的细胞间传递机制,并证实其在抗病毒和抗肿瘤免疫中的重要作用。

1. 2-5A通过细胞间连接传递
研究者利用RNASELKO(不能响应2-5A)和OAS1/2/3KO(不能产生2-5A)的A549细胞作为供体和受体细胞,通过共培养实验检测2-5A是否能够在细胞间传递。结果显示,OAS产生的2-5A能够激活受体细胞中的RNase L,且缝隙连接抑制剂CBX能够阻断这一现象,表明2-5A通过缝隙连接(如CX43/CX45)在细胞间传递。
2. 2-5A的细胞间传递促进抗病毒免疫
研究者通过病毒感染实验和细胞共培养实验,发现能够产生2-5A的细胞(如RNASELKO细胞)在与野生型细胞共培养时,能够显著抑制病毒的复制,而无法产生2-5A的细胞(如OAS1/2/3KO细胞)则不能有效抑制病毒。这表明2-5A的细胞间传递能够增强邻近细胞的抗病毒免疫反应。
3. ABCC10作为2-5A的导出子
研究者通过siRNA沉默和CRISPR-Cas9基因敲除技术,筛选能够介导2-5A导出的ABCC家族蛋白。结果显示,ABCC10是2-5A的主要导出子,ABCC10基因敲除的细胞在2-5A的导出能力上显著降低,导致邻近细胞的保护作用减弱。
4. OAS高表达肿瘤中的2-5A产生与抗肿瘤免疫
研究者利用OAS高表达的MC38肿瘤细胞模型,检测其在体内的2-5A产生情况,并评估2-5A对宿主抗肿瘤免疫的影响。结果显示,OAS高表达的MC38肿瘤细胞能够自然产生并分泌2-5A,通过ABCC10激活宿主的RNase L介导的抗肿瘤免疫反应。OAS1/2/3KO和ABCC10KO的MC38肿瘤在小鼠体内的生长速度显著加快,表明2-5A的产生和导出对于抗肿瘤免疫至关重要。
5. 2-5A在人类癌症中的潜在作用
研究者分析了人类癌症数据库中的OAS基因表达情况,发现OAS基因在某些人类癌症(如结直肠癌和皮肤黑色素瘤)中的表达与肿瘤内CD8+ T细胞的浸润水平呈正相关,而与免疫抑制细胞(如MDSC)的浸润水平呈负相关。此外,OAS高表达的肿瘤患者在抗PD-1免疫治疗中表现出更好的治疗反应。
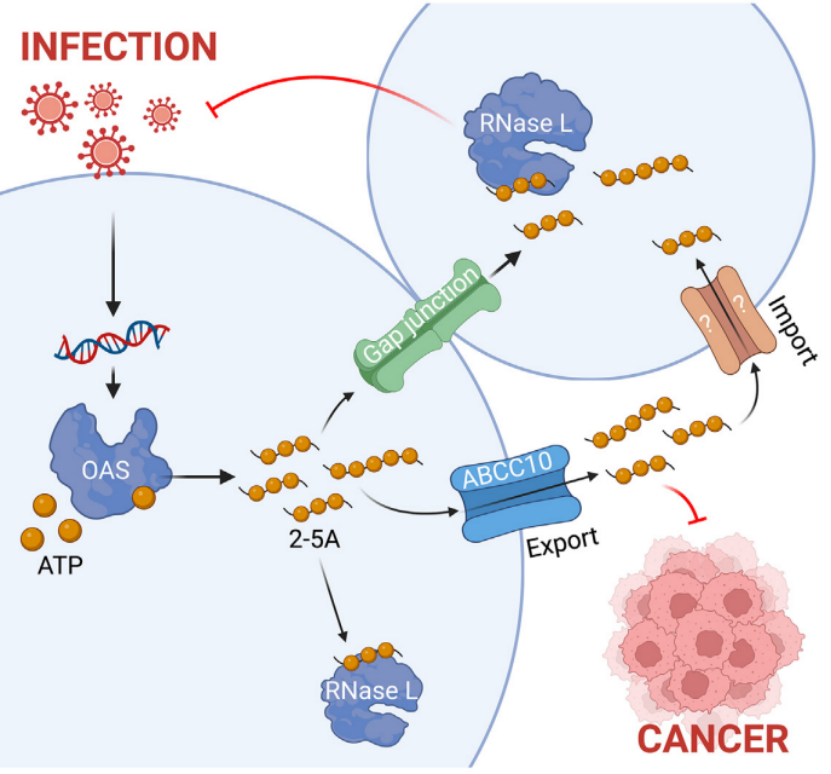
图 本研究模式图
综上所述,本研究揭示了OAS-RNase L通路中2-5A的细胞间传递机制,并证实其在抗病毒和抗肿瘤免疫中的重要作用。2-5A作为一种免疫传递分子,能够通过缝隙连接和ABCC10在细胞间传递,从而激活邻近细胞的RNase L,增强天然免疫反应。此外,OAS高表达的肿瘤细胞能够自然产生并分泌2-5A,激活宿主的抗肿瘤免疫反应。这些发现不仅为理解天然免疫的细胞间通讯机制提供了新的视角,还为开发基于2-5A的抗病毒和抗肿瘤治疗策略提供了理论基础。
原始出处:
OAS cross-activates RNase L intercellularly through cell-to-cell transfer of 2-5A to spread innate immunity. Immunity. 2025 Feb 19:S1074-7613(25)00065-2. doi: 10.1016/j.immuni.2025.01.016. Epub ahead of print. PMID: 40010341.
猜你喜欢
- 热点话题讨论:STEMI多支病变,非罪犯病变处理时机与策略选择?丨CIT2023
- 3岁幼童多次肺炎竟是“心病”导致!
- 【Blood Cancer J】498例冒烟型骨髓瘤基于风险分层的临床特征和预后
- 春季带娃出游,警惕这8种易发疾病
- 上海市药品监督管理局关于2023年第2期药品质量抽检通告
- 冬季防贫血应如何补充营养
- 抢先看!会议日程预告(3.15) | 2023年第18届圣加伦国际乳腺癌双年会(SG-BCC)(3.15-18)
- Genome Biology:Wing Hung Wong/江瑞/刘桥团队合作提出表观基因组学预训练语言模型EpiGePT
- 【综述】| 肿瘤类器官研究现状与展望
- 天气丹精华怎么用 天气丹精华使用步骤
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)