首页 > 医疗资讯/ 正文
提到减肥路上的“公敌”、体检报告里的“超标常客”——脂肪细胞,大多数人首先想到的恐怕是“游泳圈”“啤酒肚”,甚至是暗搓搓拖垮代谢。然而,似乎早就注定了被“嫌弃一生”的脂肪细胞,此刻正上演着一场惊天逆袭。
发表于Nature Biotechnology的最新研究就带来了突破性发现:Hai P. Nguyen 及其团队给这群“反派角色”偷偷加载了“黑科技”:通过基因编辑工程,脂肪细胞竟化身“营养掠夺者”,在体内掀起一场针对癌细胞的“饥饿游戏”,从而抑制肿瘤生长。这种策略被称为脂肪操纵移植(AMT),不仅让脂肪“逆袭”,还为癌症治疗开辟了全新道路。

癌细胞的“饥饿游戏”,
脂肪细胞的“绝地反击”
我们知道,癌细胞之所以可怕,不仅因为它疯狂增殖,更因为它是个“能量饕餮”。为了生存,癌细胞会“劫持”大量葡萄糖和脂肪酸,甚至让周围组织陷入“营养荒漠”。传统治疗药物试图切断癌细胞的能量供应链,但往往“杀敌一千自损八百”。
这项研究另辟蹊径:既然癌细胞靠掠夺营养壮大,何不培养一群比它“更能吃的对手”?于是,研究者将目光投向了脂肪细胞——一种本就能高效储存能量的细胞。所以,要怎么才能让原本只知道囤积脂肪的细胞“勤快”起来,变成一个会自己燃烧脂肪的“能量工厂”?
研究者们瞄准了UCP1、PPARGC1A和PRDM16这三个基因,它们就像褐色脂肪细胞的“开关”,只要打开这些开关,脂肪细胞就能从“能量储存模式”切换到“燃烧模式”。但要精准地打开这些基因,靠普通的方法可不行,于是研究团队采用了CRISPRa基因编辑技术。

这些改造后的脂肪细胞不仅在基因层面发生了变化,能量代谢水平更是迎来了全面升级!

不仅如此,这些细胞的“饭量”也大大增加,吃糖更积极、燃脂更高效。无论是在正常环境还是胰岛素刺激下,它们的葡萄糖摄取能力都显著增强,简直就是“糖分收割机”。并且,在富含脂肪酸的环境中,它们也能更高效地燃烧脂肪。
概括来说,癌细胞生长的关键,是依赖周围环境中的葡萄糖和脂肪酸。但现在,CRISPRa处理的脂肪细胞变得“食量惊人”,疯狂消耗这些营养物质,导致肿瘤微环境中的“食物”大幅减少。癌细胞一旦“断粮”,就会陷入能量危机,最终生长受限,甚至走向死亡。
这种策略,恰好对应AMT的核心概念——通过操控脂肪细胞的代谢,让它们在肿瘤微环境中和癌细胞展开“生存竞赛”,最终让癌细胞“饿死”。
“饿死”癌细胞的“代谢双杀”战术
随后,研究人员将改造后的脂肪细胞和五种“凶名在外”的癌细胞——乳腺癌、结直肠癌、胰腺癌、前列腺癌细胞共培养。

不过,癌细胞可不是坐以待毙的“傻白甜”。它们最擅长两招“保命”技能:快速糖酵解和脂肪酸氧化。要想彻底击溃它们,必须双管齐下——而“棕色化”脂肪细胞,居然就是“代谢战”的高手。
研究者还发现,与改造脂肪细胞共处的癌细胞,“吃糖”能力明显下降。它们不仅葡萄糖摄取量减少,连糖酵解核心基因(GCK、GLUT4)也集体“罢工”,表明其葡萄糖代谢能力受到了抑制,相当于切断了癌细胞的“快充电源”。

换言之,CRISPRa处理的脂肪细胞通过削弱癌细胞的糖代谢和脂肪酸代谢,从多个层面“饿死”癌细胞。
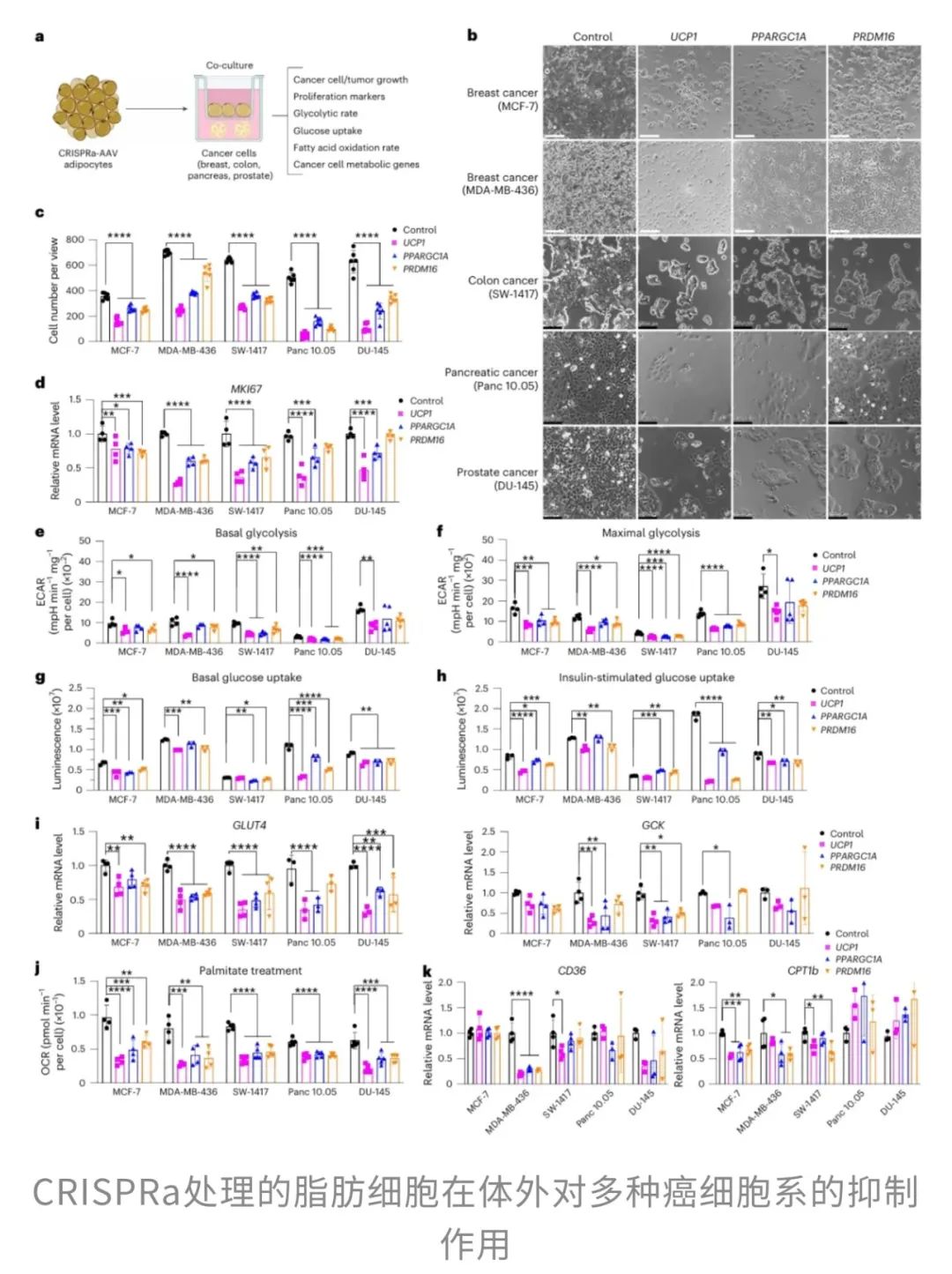
和癌细胞“同居”后,
脂肪类器官成功“反杀”
不难发现,改造后的脂肪组织更接近“褐色脂肪”的状态,而褐色脂肪的特点就是——能量消耗高、代谢活跃、能量利用效率强。研究者推测,这些“被强化”的脂肪组织类器官有可能改变肿瘤的生存环境,从而抑制其生长。
那么,这些CRISPRa修饰的脂肪组织类器官究竟是怎么打击肿瘤细胞的呢?研究团队对肿瘤组织进行了更深入的分子分析。

也就是说,经过CRISPRa修饰的脂肪组织类器官不仅能有效抑制肿瘤生长,还能改善肿瘤微环境。
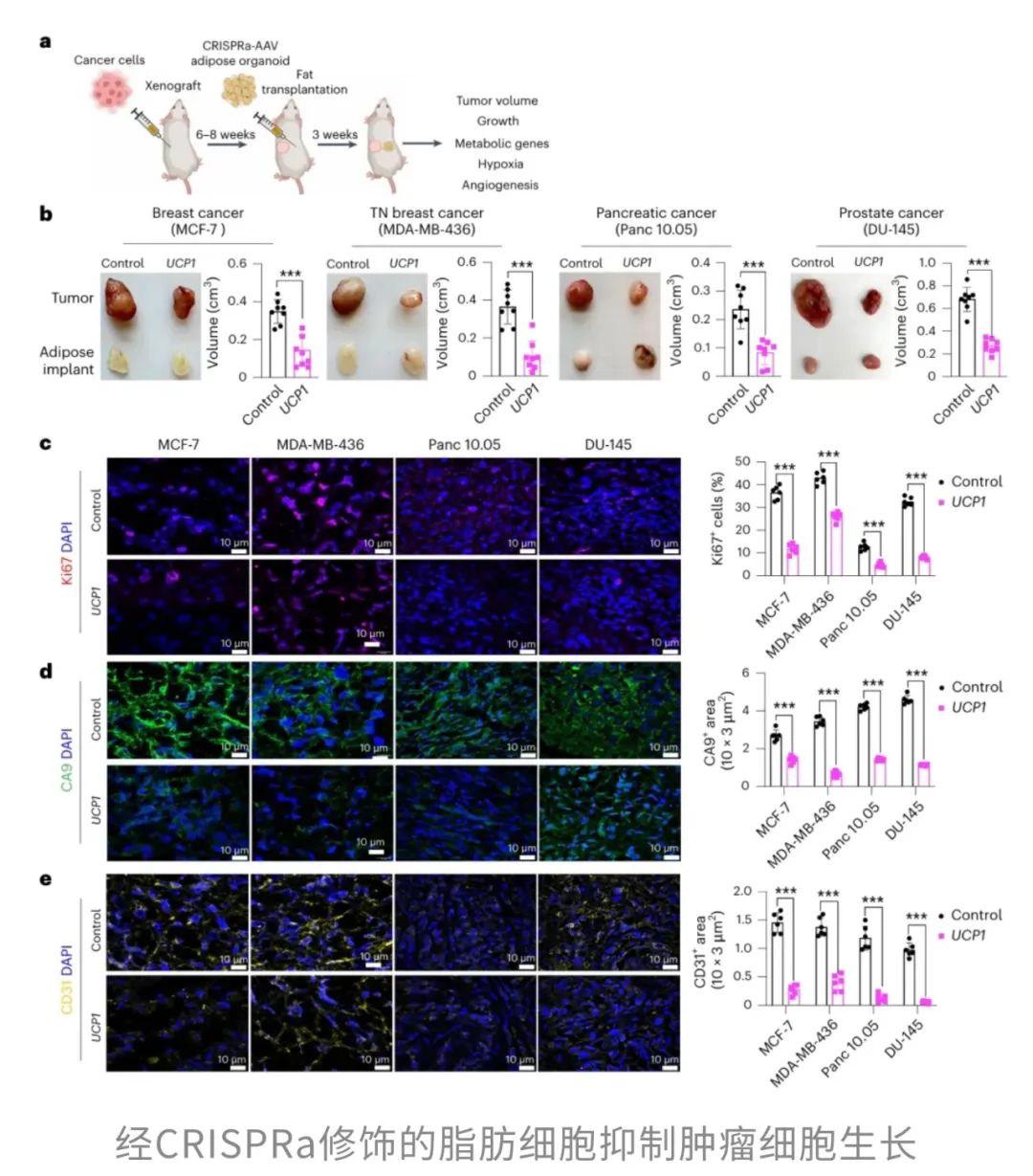
“超级脂肪”让肿瘤“吃不饱,长不大”
由此看来,脂肪不仅是“囤积热量的小仓库”,还是影响全身代谢的“幕后boss”。于是,研究者突发奇想:如果能改造脂肪,让它变得更有活力,是否能反过来“饿死”肿瘤呢?为了验证这个思路,研究团队用CRISPRa激活了Ucp1基因,让脂肪组织“燃烧得更旺”,看看能不能对抗癌症。结果让人眼前一亮——不管是胰腺癌还是乳腺癌,这种“超级脂肪”都展现出了强大的抗癌能力。

另外,肿瘤的血管数量变少、低氧环境减轻、细胞凋亡增多,也显示出一个明显的趋势:肿瘤“吃不饱”,活力大减。
更有意思的是,这些小鼠的血清胰岛素水平显著降低。这可不是个小细节——癌细胞就像“糖瘾患者”,特别依赖血糖和胰岛素提供能量。当胰岛素减少,肿瘤的“口粮”也被断了,进一步限制了它的生长。
既然“超级脂肪”能对付胰腺癌,那乳腺癌呢?研究团队换了个小鼠模型——MMTV-PyMT乳腺癌小鼠,并把“超级脂肪”植入乳腺旁边(近距离攻击)和背部(远距离干扰)两处。

类似地,和胰腺癌一样,乳腺癌小鼠的血清胰岛素水平也下降了,再次印证了一个可能的机制——通过改变脂肪组织的代谢方式,影响全身能量分配,让肿瘤难以“抢食”。
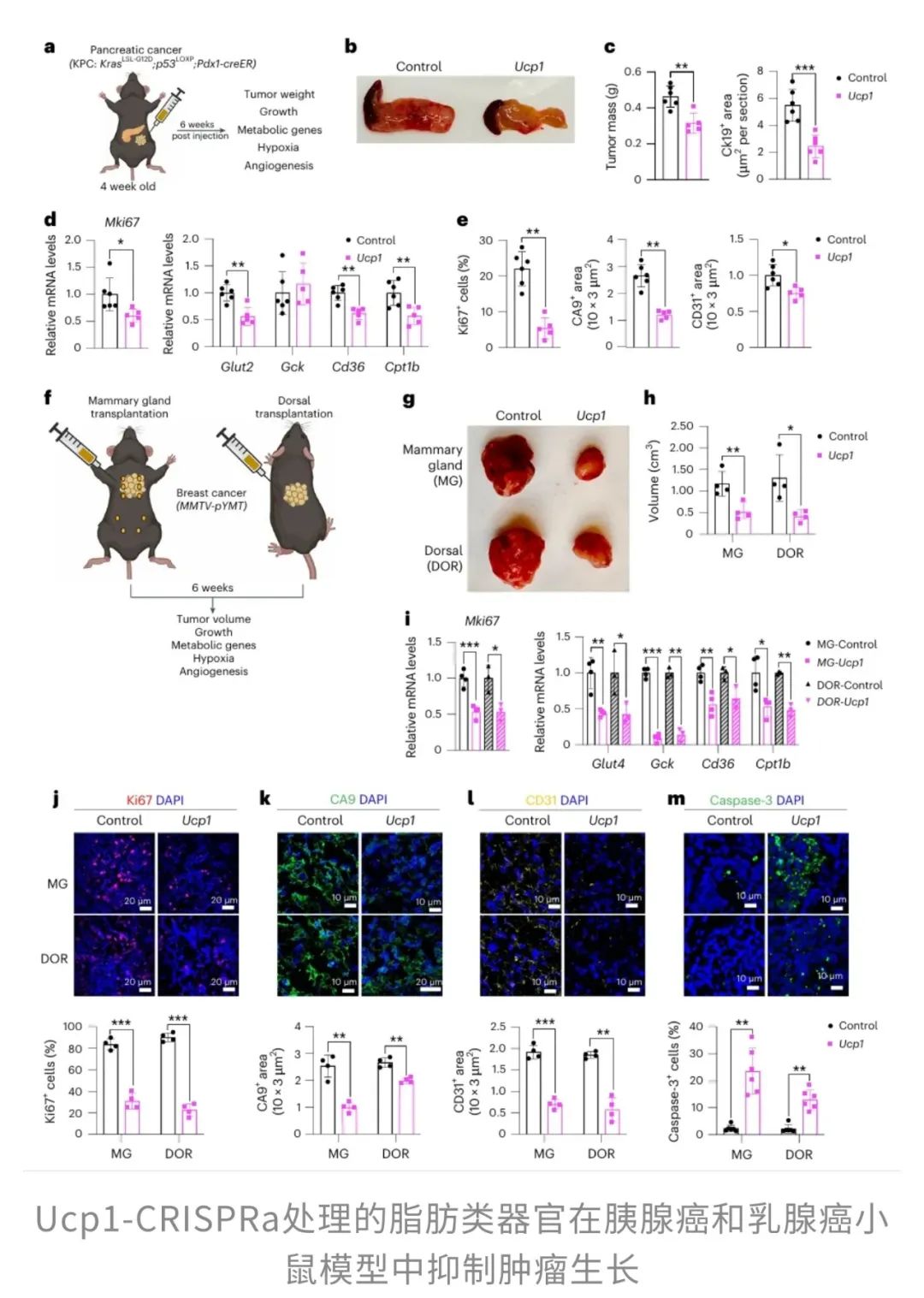
简单来说,通过基因编辑增强脂肪组织的“燃烧”能力,可以间接“饿死”肿瘤。不管是胰腺癌还是乳腺癌,甚至不管脂肪组织离肿瘤远近,“超级脂肪”都能产生显著的抗癌效果。
这背后的“奥秘”也很有意思:肿瘤细胞是能量“掠夺者”,但如果身体里的脂肪“消耗战力”提升了,肿瘤就难以抢到所需的“口粮”。而且,胰岛素水平的下降,也让肿瘤细胞的生存环境更加恶劣,最终导致它“吃不饱、长不大”。
最后,研究人员还展示了AMT技术的“自由发挥”空间,证明它不仅能精准打击特定目标,还能像“私人订制”一样,根据不同的需求调整策略。
举个例子,他们选取了一种特别“挑食”的癌细胞——胰腺导管腺癌。这种癌细胞对尿苷依赖度极高,简直到了“离了尿苷活不了”的程度。而AMT技术通过上调脂肪细胞中的UPP1基因,成功切断了癌细胞的尿苷供应,让它们陷入“断粮危机”,生长被大大抑制。
这个发现释放出一个重要信号:AMT技术不仅是单打独斗的“武器”,还可以针对不同的代谢弱点“量身定制”治疗方案,对抗各种类型的癌症。换句话说,未来或许可以通过“精准饿死”不同的癌细胞,让它们在不知不觉中失去生存能力。好比在战场上,不是正面硬刚,而是悄悄切断敌军的粮道,让它们不战自败。
总的来说,这项研究首次提出利用“代谢竞争”作为抗癌策略,并展示了在多种癌症模型中的有效性。研究表明,工程化脂肪细胞不仅能与癌细胞竞争营养,还能减少肿瘤微环境中的血管生成和低氧水平,从而进一步抑制癌细胞生长。此外,通过特定基因改造(如上调UPP1),可以针对不同肿瘤类型进行“定制化”治疗。
想不到,曾经让人头疼的“赘肉”,现在成了抗癌“黑科技”的主角——脂肪细胞,真的翻身了!这些曾被视为能量储存“仓库”的脂肪细胞,如今在基因编辑技术的助力下,成功实现了“改邪归正”。摇身一变,成为了能够与癌细胞一较高下的“营养掠夺者”。在抗癌的战场上,脂肪细胞正书写着一部全新的“剧本”。
仍需指出的是,这项研究主要在小鼠模型中进行,虽然这些模型在癌症研究中被广泛使用,但它们并不能完全模拟人类癌症的复杂性和异质性。因此,研究结果在人类患者中的适用性和有效性仍需进一步验证。 参考资料:[1]Nguyen HP, An K, Ito Y, Kharbikar BN, Sheng R, Paredes B, Murray E, Pham K, Bruck M, Zhou X, Biellak C, Ushiki A, Nobuhara M, Fong SL, Bernards DA, Lynce F, Dillon DA, Magbanua MJM, Huppert LA, Hammerlindl H, Klein JA, Valdiviez L, Fiehn O, Esserman L, Desai TA, Yee SW, Rosenbluth JM, Ahituv N. Implantation of engineered adipocytes suppresses tumor progression in cancer models. Nat Biotechnol. 2025 Feb 4. doi: 10.1038/s41587-024-02551-2. Epub ahead of print. PMID: 39905264.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)