首页 > 医疗资讯/ 正文
病毒性肝炎是由多种肝炎病毒引起的具有传染性强、传播途径复杂、流行面广等特点的传染病,严重威胁着人类的健康与生命安全,已经成为世界上最为严重的公众健康问题之一。全世界有大量的HBV携带者,我国是HBV感染的高发区,HBV携带者约为1.2亿。HBV感染人体后可造成急性或慢性感染,未经治疗的患者可发展为肝硬化、肝癌而死亡,即使接受治疗的患者也不能实现病毒的彻底清除,疾病仍然有进展成为肝硬化、肝癌的风险,HBV慢性感染者具有极大的肝癌发生风险。线粒体对能量产生、细胞信号转导等生物学过程至关重要,其稳态影响着细胞行使正常的生物学功能。线粒体对病毒十分敏感,病毒的感染会影响线粒体的稳态,导致细胞的损伤进而影响病毒的复制。线粒体损伤是HBV感染的一个标志,也是HBV难以治疗的主要原因之一。近些年来,线粒体稳态与HBV感染、复制等生物学过程相互调控的研究正得到越来越多的关注。本文从线粒体动力学、线粒体自噬、线粒体氧化磷酸化及线粒体损伤4个方面总结线粒体稳态与HBV感染的研究进展(图1)。
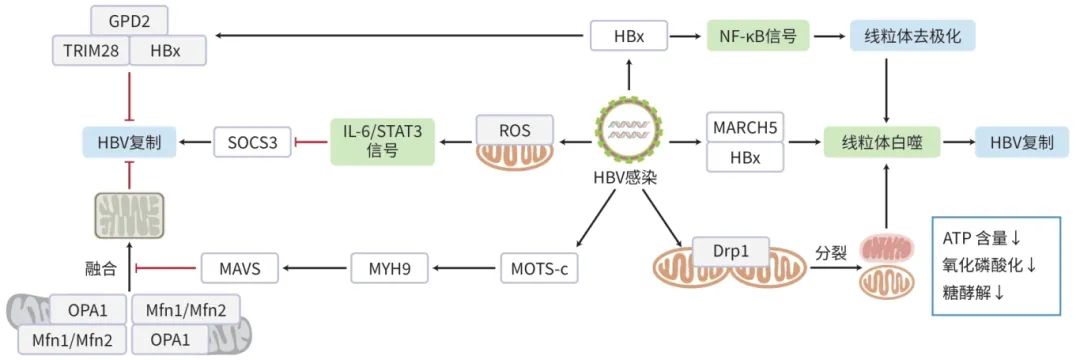
注:ATP,三磷酸腺苷;Drp1,GTP酶动力蛋白相关蛋白1;HBx,HBV X蛋白;GDP,鸟嘌呤二核苷酸磷酸;MAVS,线粒体抗病毒信号蛋白;Mfn,线粒体融合蛋白;MOTS-c,线粒体12S rRNA开放阅读框;MYH9,肌球蛋白-9;OPA1,视神经萎缩1蛋白;ROS,活性氧;SOCS3,细胞因子信号传导3抑制因子;STAT3,信号转导及转录激活因子3;TRIM28,E3泛素连接酶三基序蛋白28。
图1 HBV感染与线粒体稳态相互作用的分子机制
1HBV及其感染现状
HBV感染是全球严重的公共健康问题,影响约3亿人,每年导致82万人死亡。2020年,我国新发肝癌病例41.13万,占全球45.3%,死亡人数39万,仅次于肺癌。50%~80%的肝细胞癌(HCC)由HBV引起。在高发地区,80%以上的肝癌与HBV有关。我国10%的人口感染HBV,80%以上的肝癌患者有乙型肝炎病史。HBV感染是导致肝炎、肝硬化和肝癌的主要原因之一。
HBV是一种嗜肝DNA病毒,通过与细胞表面的受体牛磺酸胆酸钠共转运多肽相互作用进入肝细胞,随后核心颗粒将松弛的环状基因组DNA(rcDNA)送入细胞核,在细胞核中将其转化为共价闭合的环状DNA并以此作为所有病毒mRNA的转录模板。核心蛋白被合成后包装pgRNA形成核心颗粒,其中pgRNA被逆转录并被同样被包装的病毒DNA聚合酶转化为rcDNA,含有rcDNA的核心颗粒形成成熟的病毒颗粒后,从被感染的肝细胞中释放出来。
2线粒体动力学与HBV感染
2.1 线粒体动力学
线粒体动力学(mitochondrial dynamics)指的是线粒体形态和功能的动态变化,主要包括:融合(fusion)、分裂(fission)和线粒体运输(mitochondrial transport)等。细胞通过这些动态变化维持线粒体的数量、形态及功能的稳定以便细胞发挥正常的生物学功能。
2.1.1 线粒体融合及调控
线粒体融合是两个或多个线粒体合并成一个更大的线粒体的过程。Mfn1和Mfn2相互作用发生顺式二聚化(cisdimerization),形成Mfn1/Mfn2同源二聚体或Mfn1-Mfn2异源二聚体,进而促进相邻线粒体外膜发生反式栓连,Mfn蛋白GTP酶结构域水解GTP,引起膜构象改变,线粒体外膜融合,而后线粒体内膜融合蛋白OPA1通过依赖Mfn1,而非Mfn2的方式诱导线粒体内膜融合。然而,OPA1介导线粒体内膜融合的机制尚未完全被揭示,仍需深入研究。线粒体融合可以促进线粒体DNA (mtDNA)的稳定性、增强能量代谢的效率,并协调线粒体内的氧化还原状态。
2.1.2 线粒体分裂及调控
线粒体分裂指一个线粒体分裂成两个或多个更小的线粒体的过程。线粒体分裂主要由Drp1介导,在各种线粒体分裂因子刺激作用下,Drp1在线粒体分裂因子(Mff)、线粒体分裂蛋白1 (Fis1)、线粒体动力蛋白(MiD)49和MiD51等受体的辅助作用下,被募集至线粒体,并发生寡聚化,多个Drp1分子紧密环绕线粒体形成指环结构,并依赖其GTP酶活性水解GTP,使线粒体内外膜断裂,导致线粒体分裂。线粒体分裂能够增加线粒体的数量,并将受损的线粒体分离出来进行自噬降解。
2.1.3 线粒体运输及调控
线粒体可以通过微管和肌动蛋白网络在细胞内移动,以适应不同的生理需求。线粒体运输主要有微管依赖的移动以及肌动蛋白依赖的移动。微管依赖的移动中线粒体通过结合微管上的动力蛋白和驱动蛋白等马达蛋白,沿着微管进行移动;肌动蛋白的移动则依赖的是线粒体通过结合肌动蛋白上的马达蛋白,沿着肌动蛋白丝进行移动。线粒体的移动可以将线粒体运输到能量需求较高的区域,或者将受损的线粒体转移到自噬体降解的区域。线粒体运输能够影响分裂和融合的发生,运输过程能够将线粒体带到不同的细胞区域,从而接触到不同的信号分子,这些信号分子也可以影响分裂和融合的发生。
2.2 线粒体动力学与HBV感染的相互调控机制
线粒体动力学与HBV感染之间存在着复杂的相互调控机制,HBV通过直接或间接的方式调控线粒体分裂、融合等过程,进而影响HBV感染的进程;同时,线粒体动力学发生改变会反过来影响HBV感染,线粒体分裂会导致线粒体数量增加,为病毒复制提供更多能量和物质基础,线粒体功能障碍会影响抗病毒免疫反应,有利于病毒的生存和复制。研究发现血清中来源于MOTS-c的线粒体因子作为一种线粒体衍生肽(MDPs),其与HBV DNA水平呈显著负相关,外源性MOTS-c可抑制HBV感染小鼠和HBV感染细胞模型中HBV的复制,重复使用MOTS-c治疗HBV感染的C3H/He小鼠可显著抑制HBV的复制;MOTS-c的这种治疗效果与MOTS-c引发的MAVS信号通路激活增加有关,而MAVS信号通路活化是由MOTS-c依赖的线粒体动力学介导的,这种动力学由MYH9-肌动蛋白分子复合物调节,从而导致线粒体生物合成增加。HBV诱导线粒体的核周聚集,并通过刺激其在Ser616处的磷酸化触发Drp1的线粒体易位,导致线粒体裂变。HBV感染会抑制线粒体融合蛋白(Mfn1和Mfn2)的表达,并促进Drp1的表达,导致线粒体融合和分裂失衡,从而引起线粒体形态从正常的长条形变为碎片状,甚至出现空泡化现象。HBV感染还会影响线粒体动力学,导致线粒体融合和分裂的平衡被打破,最终导致线粒体数量减少,结构异常,功能下降。研究还发现,HBV感染细胞后HBx蛋白与Mfn1和Drp1相互作用,促进线粒体分裂,抑制线粒体融合,并导致线粒体呼吸功能下降,HBx蛋白可以通过影响线粒体动力学,扰乱线粒体功能,从而促进HBV复制。
3线粒体自噬与HBV感染
3.1 线粒体自噬及调控
线粒体自噬作为细胞自噬的一部分,能够选择性去除线粒体,对控制细胞内功能性线粒体的数量至关重要,目前研究发现的机制主要分为泛素依赖途径和非泛素依赖途径。泛素依赖途径依靠线粒体表面蛋白的泛素化来促进线粒体自噬,在线粒体损伤后,E3泛素连接酶与同源性磷酸酶-张力蛋白(PTEN)诱导的假定激酶1(PINK1)相互作用,共同调节线粒体自噬过程,维持线粒体质量,其中Parkin/PINK1通路研究最为清楚;非泛素依赖途径中,在线粒体外膜上有许多具有与LC3相互作用区域的蛋白质,这些区域是自噬的受体,它们可以不经泛素化而直接与LC3结合,从而启动线粒体自噬。
3.1.1 泛素依赖途径的自噬
3.1.1.1 PINK1/Parkin途径依赖的线粒体自噬
在细胞正常生理环境下,PINK1在线粒体外膜转位酶(TOM) 和线粒体内膜转位酶(TIM)的作用下被转入线粒体膜,其MTS序列在线粒体基质金属蛋白酶( MMP)的作用下被切除,并在早老素相关菱形样蛋白(PARL)的作用下被裂解进而转位至胞浆被快速降解。当线粒体损伤后,细胞膜电位去极化,PINK1在TOM的作用下积聚于线粒体外膜,不能被降解。PINK1通过自身磷酸化而被激活,而后磷酸化附近泛素分子的第65位丝氨酸残基。磷酸化的泛素分子能结合并募集Parkin分子,进而PINK1磷酸化胞浆中的E3泛素连接酶Parkin并将其激活,被激活的Parkin对多种线粒体蛋白底物进行多聚泛素化修饰。在LC3接头蛋白泛素结合蛋白P62 (SQSTM1/P62)、视神经蛋白(OPTN)、核点蛋白52(NDP52)、TAX1结合蛋白1和BRCA1旁基因1蛋白等的作用下,将自噬体靶向至线粒体,诱导线粒体自噬的发生。
3.1.1.2 PINK1依赖Parkin非依赖的线粒体自噬
PINK1也可通过Parkin非依赖的方式诱导线粒体自噬。研究发现,PINK1可募集LC3接头蛋白OPTN和NDP52至线粒体,进而募集自噬始动因子UNC-51样激酶1(ULK1)、双FYVE结构域蛋白1和WD重复域磷酸肌醇结合蛋白1,诱导线粒体自噬。PINK1能够磷酸化泛素1(UBQLN1),磷酸化的UBQLN1能够促进与Parkin蛋白的相互作用,增强线粒体自噬。此外,synphilin-1通过募集PINK1形成复合物并与E3泛素连接酶SIAH-1结合,促进线粒体蛋白的泛素化,诱导线粒体自噬。
3.1.2 非泛素依赖途径的自噬
3.1.2.1 LC3接头蛋白通过泛素非依赖机制诱导的线粒体自噬
LC3接头蛋白是自噬体形成的关键蛋白,它能够结合到自噬受体上,将目标蛋白或细胞器包裹进自噬体。研究发现,当线粒体损伤时,胆碱脱氢酶聚积于线粒体外膜,并与P62相互作用后结合LC3形成复合物,诱导线粒体自噬。含Tre2-Bub2-Cdc16结构域的三磷酸鸟苷酶激活因子1(TBC1)结构域家族成员15(TBC1D15)可与TBC1结构域家族成员17(TBC1D17)结合形成复合物,并通过与线粒体分裂蛋白Fis1的相互作用移动至线粒体外膜,与LC3蛋白相互作用而诱导线粒体自噬发生。
3.1.2.2 LC3直接识别线粒体膜上的受体蛋白诱导的线粒体自噬
LC3接头蛋白也可识别受损线粒体膜上的受体蛋白并与之结合从而启动线粒体自噬。研究表明,Bcl-2样蛋白13 (BCL2L13)、FK506结合蛋白8受体、Bcl-2/腺病毒E1B-19 kDa蛋白互作蛋白3(Bcl-2/adenovirus E1B 19 kDa interacting protein 3, BNIP3)受体、Nip3样蛋白X、含核苷酸结合结构域和富亮氨酸重复序列的蛋白家族成员X1受体和FUN14结构相关蛋白1受体都能够直接与LC3结合而启动线粒体自噬。此外,线粒体内膜蛋白抑制素2蛋白在线粒体外膜损伤暴露后也能够与LC3结合,进而启动线粒体自噬的发生。
3.2 线粒体自噬与感染的相互调控机制
HBV可通过诱导线粒体自噬影响线粒体稳态。研究表明,HBx蛋白可通过刺激其丝氨酸的磷酸化诱导线粒体核周聚集和Drp1的线粒体定位并触发线粒体裂变,导致去极化线粒体分离,通过线粒体自噬去除。HBx蛋白除了诱导线粒体断裂外,还可以诱导线粒体自噬关键蛋白因子PINK1、Parkin和LC3B的表达。PINK1稳定在去极化线粒体上招募并激活E3泛素连接酶Parkin,促进线粒体外膜蛋白泛素化,引发线粒体自噬。HBV激活的Parkin也可引起线粒体融合介质Mitofusin 2的降解,并引发线粒体自噬;HBx诱导线粒体自噬可以减弱线粒体相关的凋亡,并引发代谢向糖酵解的转变。线粒体E3泛素连接酶的表达水平与肝癌患者生存率密切相关,HBV感染后MARCp(membrane associated ring-CH-type finger 5)的N端结构域被激活并与积聚在线粒体中的HBx蛋白相互作用,最终以线粒体自噬的方式被降解;MARCH可拮抗HBx诱导线粒体自噬的活性,与线粒体膜上的HBx结合,诱导其降解。HBx也可诱导BNIP3L(BCL2 interacting protein 3 like)依赖性的线粒体自噬,从而上调糖酵解代谢,增加体内和体外HCC细胞的肿瘤干细胞。此外,最近有研究表明HBsAg通过WNT7B/CTNNB1信号通路抑制索拉非尼诱导的线粒体自噬。
4线粒体氧化磷酸化(OXPHOS)与HBV感染
OXPHOS系统是细胞代谢的中心,是真核细胞能量产生的关键,细胞在体内氧化时释放的能量通过呼吸链供给ADP与无机磷酸合成ATP,从而为细胞生命活动提供能量。肝细胞是HBV复制的场所,也是一个天然的缺氧器官,哺乳动物细胞通过受缺氧诱导因子调控的转录反应来适应低氧环境,缺氧诱导因子通过激活基础核心启动子调控HBV复制。
OXPHOS系统作为细胞能量工厂,在HBV的感染和复制中发挥重要作用。既往研究发现,在OXPHOS系统中发挥重要作用的线粒体FAD依赖性G3P脱氢酶通过募集TRIM28与HBV的调节蛋白HBx形成复合物,从而抑制HBV复制,导致HBx的蛋白酶体降解。研究表明,抑制乙酰辅酶A:胆固醇酰基转移酶酰可以增强OXHPOS和ATP的产生,从而在体外拯救功能失调的HBV特异性CD8+T淋巴细胞。在HBV感染中,巨噬细胞在病毒清除和病毒持续中起着至关重要的作用。M1巨噬细胞能够产生ROS和促炎细胞因子,经常表现出高糖酵解活性和低OXPHOS活性;相比之下,M2巨噬细胞则表现出低糖酵解活性和高OXPHOS活性。小鼠肝脏巨噬细胞Kupffer细胞在未暴露于母体HBV抗原的情况下发生M1样极化,而在暴露于母体HBV抗原的情况下发生M2样极化,此外HBV诱导了OXPHOS相关线粒体酶的表达,进一步测量氧气消耗率和细胞外酸化率证实HBV可以诱导THP-1巨噬细胞的OXPHOS并抑制糖酵解。
5线粒体损伤与HBV感染
线粒体正常的形态和功能是保证细胞进行各种生理活动的重要基础,各种应激因素可影响线粒体,造成线粒体损伤,引起线粒体功能障碍,进而影响细胞行使其生物学功能。线粒体的损伤与多种疾病发生关系密切,研究表明线粒体损伤与代谢性疾病、神经退行性疾病、心血管系统疾病及感染性疾病相关。
HBV感染可引起线粒体损伤,改变细胞微环境,造成细胞ROS和膜电位的改变。HBV诱导线粒体产生ROS并上调转录因子Nrf2的表达,刺激IL-6的表达,SOCS3作为IL-6/STAT3信号通路负反馈调节因子可被ROS阻断,而SOCS3的沉默导致IL-6/STAT3通路的持续激活,促进HBV诱导的肝癌发生。耗竭的HBV特异性CD8+T淋巴细胞具有广泛的线粒体改变,并且靶向线粒体的抗氧化剂可以改善这些CD8+ T淋巴细胞的抗病毒功能。也有研究发现,HBx可激活NF-κB,阻止线粒体膜去极化,抑制NF-κB时,HBx会诱导线粒体膜去极化;HBx可通过诱导ROS来诱导环氧合酶-2的表达,促进细胞生长。最近的研究也表明,ROS诱导的自噬体形成和自噬降解在5-氟尿嘧啶诱导的HBV再激活中起关键作用,过氧化氢通过siah-1介导的人肝癌细胞蛋白酶体降解下调HBx水平抑制HBV复制,HBx诱导的磷脂酶A2受体(PLA2R)过表达通过ROS-NLRP3信号通路介导细胞焦亡,HBV介导的S100A9-TLR4/晚期糖基化终产物(RAGE)-ROS级联提高中性粒细胞胞外陷阱促进HCC的生长和转移。
6展望
线粒体作为重要的细胞器之一,其正常形态和功能的维持是保证细胞进行各种生理活动的主要基础。线粒体稳态的维持与各种疾病的关系也正受到越来越多研究者的关注。线粒体稳态是一个动态调节的过程,线粒体融合、分裂、移动、线粒体自噬、损伤、氧化磷酸化等生理活动均可影响线粒体稳态的维持。针对线粒体稳态与HBV感染的研究必将为HBV的治疗提供新的视角,然而,要实现靶向线粒体的抗HBV治疗仍然任重道远,主要面临以下的困难和挑战。第一,线粒体稳态的调控机制极其复杂,很多机制仍未完全阐明,可用于药物开发的靶点更是非常有限;第二,如何靶向线粒体稳态调节HBV复制;第三,如何通过改善线粒体功能,增强抗病毒治疗效果;第四,需要开发新的抗病毒药物,靶向线粒体稳态。未来,使用Mfn1和Mfn2的激动剂,促进线粒体融合,恢复线粒体功能,抑制HBV复制;使用抗氧化剂减轻线粒体氧化应激,提高抗病毒药物的疗效;开发抑制Drp1的活性等能够抑制HBV诱导的线粒体分裂或自噬的药物都将对HBV感染的治疗具有重要意义。
综上所述,线粒体稳态的维持与HBV感染之间关系密切,虽然在已有的研究中已经取得了一些进展,但仍然需要更深入的研究来阐明其机制。未来研究方向包括:进一步阐明HBV感染对线粒体稳态影响的机制,例如HBV蛋白与线粒体蛋白的相互作用,HBV感染诱导的线粒体ROS生成,以及线粒体自噬的调控机制等;研究线粒体稳态改变对HBV感染致病性的具体影响,例如线粒体功能障碍如何影响HBV的复制、肝细胞凋亡和炎症反应等;开发基于线粒体稳态的新型抗病毒治疗策略,例如开发针对线粒体融合、分裂、自噬或ROS生成的药物,以改善HBV感染的治疗效果。不可否认的是,深入探讨线粒体稳态的维持与HBV感染的关系可为理解HBV感染的分子机制,甚至寻找HBV潜在治疗靶点提供一定的理论依据。随着研究的不断深入,必将能够更好地理解线粒体稳态在HBV感染中的作用,并开发新的靶向线粒体的抗HBV药物。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50222

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)