首页 > 医疗资讯/ 正文
[摘要] 核医学分子影像具有无创、高灵敏度、时空动态可视化、可定性及定量分析等特点,借助融合影像技术的优势,兼备了反映功能代谢和解剖结构的特点。核医学分子影像评估贯穿于放射性碘难治性分化型甲状腺癌(radioactive iodine-refractory differentiated thyroid cancer,RAIR-DTC)诊治管理的全流程,包括界定、探查病灶、指导治疗决策、评价疗效及评估预后等。131I全身显像(131I-whole body scan,131I-WBS)是判断RAIR-DTC的重要依据。其中诊断性131I-WBS可在131I治疗前探查术后残留甲状腺及可疑摄碘性转移灶,有助于后续131I治疗决策。治疗后131I-WBS可进一步明确病灶摄碘特征,以及探查诊断性WBS未能显示的病灶,为明确患者临床分期、制订随访管理方案提供参考依据。治疗后131I-WBS显示的病灶摄碘能力还可预判131I治疗效果。131I-WBS结合血清学及其他影像学检查还可用于评价131I治疗效果。18F-FDG正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)主要用于血清甲状腺球蛋白(thyroglobulin,Tg)或Tg抗体(Tg antibody,TgAb)水平持续增高而131I-WBS阴性的高危DTC患者,可辅助寻找和定位病灶。18F-FDG PET/CT与131I-WBS结合有助于全面评估全身肿瘤负荷。DTC转移灶摄取18F-FDG预示着131I治疗效果不佳,患者生存预后较差,是疾病快速进展及肿瘤特异性死亡风险增高的预测因素。RAIR-DTC病灶接受局部或系统治疗后,可通过治疗前后的早期代谢反应预测患者的临床获益,以便及时调整治疗方案。此外,靶向反映新生血管生成的RGD肽及前列腺特异性膜抗原、靶向成纤维细胞激活蛋白、靶向生长抑素受体等的多种新型核素显像可作为18F-FDG PET/CT阴性时的补充手段,探查RAIR-DTC病灶,还可根据对显像剂的摄取能力筛选适合行靶向性核素治疗的患者,为多线治疗后疾病仍进展的RAIR-DTC患者提供有效的核素诊疗一体化新选择。
[关键词] 分子影像;分化型甲状腺癌;放射性碘难治;诊断;治疗前评估;疗效评价
[Abstract] Nuclear medicine molecular imaging has the characteristics of non-invasiveness, high sensitivity, spatiotemporal dynamic visualization, qualitative and quantitative analysis, and by virtue of the advantages of fusion imaging technology, it combines the features of functional metabolism and anatomical structure. Nuclear medicine molecular imaging evaluation is integrated throughout the management of radioactive iodine-refractory differentiated thyroid cancer (RAIR-DTC), including defining RAIR, exploring the lesions, guiding treatment decisions, evaluating efficacy, and assessing prognosis. 131I-whole body scan (131I-WBS) is critical for determining RAIR-DTC. Diagnostic 131I-WBS can be used to explore postoperative residual thyroid and suspected iodine-avid metastases before 131I treatment, which is helpful for subsequent 131I treatment decisions. Post-treatment 131I-WBS can further clarify the iodine uptake characteristics of lesions and explore lesions not shown by diagnostic WBS, providing a reference for clarifying the clinical stage of patients and formulating follow-up management plans. The iodine uptake ability of lesions shown by post-treatment 131I-WBS can also predict the therapeutic efficacy of 131I treatment. 131I-WBS combined with biochemical changes and other imaging examinations can also be used to evaluate the therapeutic efficacy of 131I treatment. 18F-FDG positron emission tomography and computed tomography (PET/CT) is mainly used for high-risk DTC patients with persistently elevated serum thyroglobulin (Tg) or Tg antibody (TgAb) levels and negative 131I-WBS, and can explore and locate lesions. Combining 18F-FDG PET/CT with 131I-WBS provides a thorough evaluation of the overall tumor burden. The uptake of 18F-FDG by DTC metastases indicates poor 131I treatment response and poor prognosis for patients, and is a predictor of rapid disease progression and an increased risk of tumor-specific death. After local or systemic treatment of RAIR-DTC lesions, the early metabolic response to treatment can predict the clinical benefit of patients, allowing for timely adjustment of treatment strategies. In addition, various new radionuclide imaging techniques targeting angiogenesis (such as RGD peptides and prostate specific membrane antigen), fibroblast activation protein and somatostatin receptor can be used as supplementary means when 18F-FDG PET/CT is negative to detect RAIR-DTC lesions. They can also screen patients who qualify for targeted radionuclide therapy based on the uptake ability of imaging agents. These novel theranostics provide new options for progressive RAIR-DTC patients after multiline treatment.
[Key words] Molecular imaging; Differentiated thyroid cancer; Radioactive iodine-refractory; Diagnosis; Pre-treatment evaluation; Efficacy assessment
放射性碘(radioactive iodine,RAI)治疗是分化型甲状腺癌(differentiated thyroid cancer,DTC)术后重要的综合治疗措施之一,其针对摄碘性病灶的清灶治疗可改善患者的疾病特异性生存期和无病生存期,提高患者生活质量[1]。然而在局部晚期及转移性DTC的自然病程或治疗过程中,1/3~2/3的病灶最终发展为RAI难治性DTC(RAI-refractory DTC,RAIR-DTC)。
RAIR-DTC的界定一直存在诸多争议。《放射性碘难治性分化型甲状腺癌诊治管理指南(2024版)》[2]对其进行了进一步优化,在排除残留甲状腺、促甲状腺激素(thyroid-stimulating hormone,TSH)刺激不充分、体内稳定性碘水平超标等可能降低131I全身显像(131I-whole body scan,131I-WBS)反映病灶摄碘能力的前提下,出现下列临床情形之一即可界定为RAIR-DTC:① 所有已知DTC病灶均不摄碘;② 尽管部分或全部病灶摄碘,但131I治疗后(1年内)疾病进展。界定RAIR-DTC的主要目的是对患者进行分层,预判其从后续131I治疗中获益的可能性,而不应简单作为是否需要继续接受或终止131I治疗的标准。RAIR-DTC的临床情形(尤其是治疗剂量131I-WBS病灶未见摄碘)意味着直接从后续131I治疗中获益的可能性极低,通常不建议131I重复治疗,应结合患者个体化疾病情况进行多学科讨论和作出决策[3]。随着RAI显像流程的标准化及技术的优化,对DTC病灶摄碘能力的评估更加精准。另外,RAIR-DTC经靶向药物诱导再分化后使继续采取131I治疗成为可能。可见,RAIR-DTC的界定及诊治体系也在持续完善和改进中。
核医学分子影像具有在体、无创、高灵敏度、时空动态可视化、可定性及定量分析等特点,且随着融合影像技术的发展,核医学分子影像兼备了反映功能代谢和解剖结构的特点。核医学分子影像评估贯穿于RAIR-DTC诊治管理的全流程,包括界定、寻找和定位病灶、治疗策略指导、疗效评价及判断预后等。随着新型分子探针的不断研发及转化,可以预期核医学分子影像在RAIR-DTC的诊治管理中将以其独特的优势发挥更大的临床价值。
1 131I-WBS及单光子发射计算机体层成像(single photon emission computed tomography,SPECT)/CT
131I-WBS是评估DTC术后甲状腺组织残留量、探查DTC摄碘性复发或转移灶、指导131I治疗决策、辅助评价131I治疗效果的重要手段。鉴于平面显像缺乏解剖定位标志的局限性,SPECT/CT可进一步提高对DTC复发或转移灶定性和定位诊断的准确性,同机CT图像还可能同时发现不摄碘病灶的存在,进而改变治疗决策[4]。
1.1 明确DTC病灶的摄碘特征
1.1.1 诊断性131I-WBS
诊断性131I-WBS可在131I治疗前探查术后残留甲状腺及可疑摄碘性转移灶,有助于后续131I治疗决策。诊断性131I-WBS的应用目前尚存在争议,有学者认为因口服的131I剂量较低,可能会低估病灶的摄碘能力,尤其是首次131I治疗前行诊断性WBS可能因残留甲状腺组织的存在而掩盖病灶的碘摄取;另外,诊断性131I-WBS还可能造成后续治疗剂量的131I摄取减少的“顿抑”现象,因此不主张在131I治疗前行WBS。然后多项研究[5-6]证实,131I治疗前行诊断性WBS并未影响后续131I清甲成功率及复发率,即使是伴有转移的患者也未影响其治疗反应率。因此认为所谓的“顿抑”现象可能是诊断剂量的131I对部分病灶的破坏作用所致。降低诊断性131I-WBS潜在影响的策略包括:使用更小剂量的131I(如1~2 mCi),用物理特性更优的123I进行显像,延迟进行治疗后的WBS,以及用18F-BF4-显像代替等[7]。
关于诊断性131I-WBS显示DTC病灶不摄碘能否界定为RAIR-DTC也存在一定的争议。诊断性131I-WBS阴性预示着对后续131I治疗反应率较低,然而仍有部分患者在131I治疗后的WBS显示为阳性,提示其仍然可能从131I治疗中得到一定的临床获益。也有学者认为,诊断性131I-WBS阴性的患者即使后续131I治疗后WBS阳性,由于病灶的摄碘能力相对较低,因此服用131I后的肿瘤组织吸收剂量难以达到控制疾病所需,很难给患者带来病灶缓解或稳定的获益。而对于疾病持续稳定的患者,继续重复131I治疗可能是利弊失衡的,并不能给患者带来病情缓解的获益,甚至可能因131I治疗前反复升高的TSH水平激发疾病进展,且随着累积剂量的增加,不良反应的发生率也随之增加[8]。
1.1.2 治疗后131I-WBS
患者在接受131I治疗后的2~10 d通常会利用口服的治疗剂量的131I进行WBS,有助于进一步明确病灶摄碘特征,以及探查诊断性WBS未能显示的病灶,为明确患者临床分期、决策后续管理方案提供参考依据[9](图1)。相较于诊断性131I-WBS,治疗后的WBS因使用的131I活度更大而可能发现更多的摄碘灶。Fatourechi等[10]研究结果显示,117例次的治疗后WBS中有13%发现了诊断性WBS未显示的异常碘摄取,9%的患者因此改变了诊治管理决策。
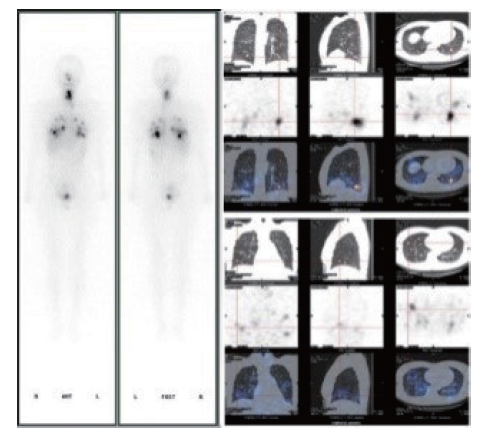
图1 131I-WBS及SPECT/CT
Fig. 1 131I-WBS and SPECT/CT
治疗后131I-WBS显示的病灶摄碘能力还可预判131I治疗效果。有研究[11]发现,131I-WBS所见的DTC病灶靶/本比低于6.2时,预示131I清灶治疗无效的概率较高。另有研究[12]发现,对于伴有远处转移的DTC患者,治疗后131I-WBS见病灶靶/本比低于8.1和(或)抑制性甲状腺球蛋白(thyroglobulin,Tg)较治疗前下降小于25.3%,预示着很难从下一次131I治疗中得到生化获益,应谨慎决策重复131I治疗。
1.2 辅助评价131I治疗效果,评估疾病进展
131I-WBS+SPECT/CT是评价131I治疗DTC复发或转移灶疗效的重要手段之一,可作为筛选复次治疗指征的重要依据。131I治疗6个月以上,可进行疗效评估。目前对131I清灶疗效评价尚无统一标准,比较公认的客观标准应包括病灶结构学体积(超声、CT等所见的病灶变化)、功能性体积[摄碘和(或)糖代谢增高病灶的变化]及血清学改变等[13]。其中131I-WBS可通过摄碘病灶的数量、范围及靶/本比的变化等来评价疗效,结合SPECT/CT还可观察其结构学体积的变化。尤其对于其他结构影像学尚未显示的微转移灶,131I-WBS的动态变化对诊治管理决策至关重要。如131I-WBS显示病灶浓集范围缩小或浓集程度减淡、病灶减少,同时血清Tg或Tg抗体(Tg antibody,TgAb)水平持续下降,结构影像提示病灶缓解或维持稳定,则判断治疗有效,可重复进行131I治疗,直至病灶消失或对治疗无应答。相反,如131I-WBS虽显示病灶摄碘,但血清Tg或TgAb水平持续上升,结构影像提示病灶增大、增多或即使处于稳定状态,则提示患者从本次及后续131I治疗中获益有限,应纳入RAIR-DTC的诊治管理[14-15]。
2 18F-FDG正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)
2.1 探查不摄碘病灶,结合131I-WBS全面评估DTC患者的肿瘤负荷
18F-FDG PET/CT主要用于血清Tg/TgAb水平持续增高(如刺激性Tg>10 ng/mL,或TgAb阳性且呈持续上升趋势)而131I-WBS阴性的高危DTC患者,可辅助寻找和定位病灶(图2)。一项包含17项研究1 195例患者的meta分析[16]显示,18F-FDG PET/CT探测病灶的灵敏度和特异度分别可达86%和84%。影响其探测灵敏度的因素包括病灶分化程度、肿瘤负荷及Tg倍增时间等,而TSH刺激状态并无明显增益价值[16-18]。
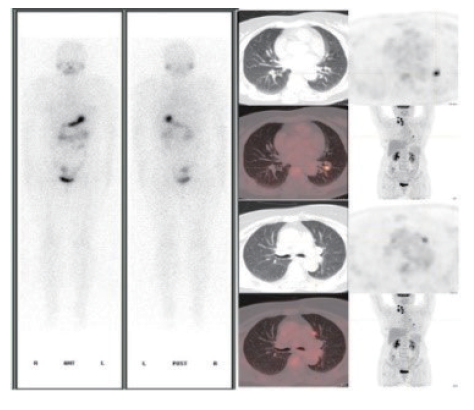
图2 131I-WBS阴性、18F-FDG PET/CT阳性
Fig. 2 Negative 131I-WBS and positive 18F-FDG PET/CT
对于刺激性Tg水平≤10 ng/mL的DTC患者,18F-FDG PET/CT检测病灶的灵敏度相对较低,仅为10%~30%。伴有侵袭性病理学亚型患者的Tg水平可能较低,Tg倍增时间短者提示疾病进展,18F-FDG PET/CT的阳性率更高[18]。TgAb的存在会干扰Tg检测的准确率,因此无法可靠地评估患者真实的Tg水平,而18F-FDG PET/CT可能会在这部分患者中检测到病灶的存在。
DTC病灶分化程度越低,侵袭性越强,摄碘能力降低,而无氧糖酵解增加,常呈现摄碘能力和18F-FDG亲和力反转现象。因此18F-FDG PET/CT与131I-WBS+SPECT/CT相结合可更加全面地评估全身肿瘤负荷,展示糖代谢及碘代谢特征异质性的病灶,可以早期明确RAIR-DTC病灶的存在,优化后续的诊治管理。
2.2 可作为疾病快速进展及肿瘤特异性死亡风险增加的预测工具
DTC患者的转移灶摄取18F-FDG是131I治疗效果不佳的主要预测因素,也是患者生存率下降的独立预后因素[19-20]。18F-FDG PET/CT可以检测出葡糖糖代谢升高的病灶,这些病变往往更具侵袭性,无论病灶是否摄碘,18F-FDG摄取增加均提示患者从131I治疗中获益的可能性降低[21]。而且18F-FDG阳性的病灶更易因每次131I治疗前停用甲状腺激素后的高水平TSH所激发而导致疾病进展。因此,反复的131I治疗并不能给患者带来明确获益及改善预后,应谨慎进行重复治疗决策。由于18F-FDG阳性摄取的病灶的侵袭性更强,更易发生快速进展,因此应密切随访监测,及时给予局部或系统治疗。
2.3 评估侵袭性进展病灶经局部或系统性治疗后的效果
RAIR-DTC病灶治疗前应对患者进行完善的影像学评估,明确肿瘤病灶部位、数量、大小及邻近重要组织器官侵犯情况,并作为实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)的基线;而18F-FDG PET/CT可通过肿瘤病灶代谢参数的变化进行代谢反应评估,其评价标准主要包括基于瘦体重校正的标准化摄取峰值(standard uptake peak value of lean body mass,SULpeak)变化的PET RECIST (PET RECIST,PERCIST)以及基于标准化摄取峰值(standard uptake peak value,SUVpeak)变化的改良PERCIST(modified PERCIST,mPERCIST)。一项纳入22例接受仑伐替尼治疗的进展期RAIR-DTC患者的研究[22]显示,治疗后3、6个月随访时,RECIST评估为缓解的病灶,mPERCIST评估也均为代谢缓解,但多数RECIST评估为稳定的病灶,经mPERCIST评估为代谢进展,且与代谢缓解者相比,无代谢反应者的无进展生存期(progression-free survival,PFS)和疾病特异性生存期(disease-specific survival,DSS)均明显缩短。上述结果提示通过18F-FDG PET/CT进行代谢反应评估优于传统的结构影像学评估,其评估结果与患者的临床预后相关。
对于无法局部治疗和(或)全身多脏器受累的有症状或肿瘤快速进展的RAIR-DTC患者,多靶点酪氨酸激酶抑制剂(Tyrosine kinase inhibitors,TKIs)已成为一线治疗的标准选择[2]。由于TKIs的不良反应影响患者的生活质量,所以早期识别对TKIs治疗反应不佳的患者对及时调整治疗策略至关重要。基于18F-FDG PET/CT代谢参数的肿瘤代谢反应评估可以帮助我们识别能从靶向治疗中获益的患者。Rendl等[23]的研究比较了几种不同的代谢反应评价标准评估代谢进展的效能,结果证实不同方法的评估结果并无明显差异,但由于RAIR-DTC微小病灶占比较高,PERCIST的适用性相对较差。患者在接受TKIs治疗后4个月进行早期代谢反应评估,代谢进展组较疾病控制组的PFS明显缩短。一项纳入33例接受仑伐替尼治疗的18F-FDG阳性RAIR-DTC患者的研究结果显示,治疗后4周约57.6%的患者即可观察到经18F-FDG PET/CT评估的显著代谢反应,15.1%的患者代谢反应有所延迟,而治疗后4~8周代谢无反应的患者其中位OS显著缩短(8.98个月 vs 40.00个月)[24]。由此可见,RAIR-DTC在接受靶向治疗的早期无代谢反应甚至进展者,应密切随访疾病变化情况,及时变更治疗策略。
3 其他核医学分子影像
3.1 作为18F-FDG显像阴性时的补充手段,探查RAIR-DTC病灶
3.1.1 靶向新生血管生成
整联蛋白受体在包括肺癌、甲状腺癌等在内的多种恶性肿瘤中均呈高表达,整联蛋白αvβ3已被认为是核素标记RGD肽的潜在显像靶点和肿瘤血管生成的分子标记物。Zhao等[25]的研究显示,纳入10例患者的全部RAIR-DTC病灶均在99mTc-3PRGD2 SPECT/CT上得以显示,且病灶靶/本比与中位增殖速率显著相关(r=0.878,P=0.009),提示99mTc-3PRGD2显像可用于探查RAIR-DTC病灶并评估其进展速度,辅助抗血管生成治疗决策及监测疗效。一项纳入44例RAIR-DTC患者的研究[26]比较了68Ga-DOTA-RGD2与18F-FDG PET/CT的诊断效能,结果显示,68Ga-DOTA-RGD2 PET/CT诊断的灵敏度、特异度和准确率分别为82.3%、100.0%和86.4%,且82.1%的患者的68Ga-DOTA-RGD2摄取高于肝脏;而18F-FDG PET/CT探查的灵敏度、特异度和准确率分别为82.3%、50.0%和75.0%,提示68Ga-DOTA-RGD2 PET/CT检测RAIR-DTC病灶的特异度和准确率更高,可选择性应用于18F-FDG PET/CT阴性或难以定性的患者。
前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)是一种跨膜糖蛋白,可表达于包括前列腺癌在内的多种恶性肿瘤的新生血管内皮中。Ciappuccini等[27]分析了44例患者颈部持续/复发或转移性DTC病灶的PSMA表达情况,结果显示,年龄≥55岁、原发肿瘤直径>4 cm、低分化、侵袭亚型及18F-FDG阳性患者PSMA的免疫组织化学染色积分更高,预后分析显示,PSMA强阳性者的PFS明显缩短。Verma等[28]的研究纳入9例Tg阳性、131I-WBS阴性而CT可见病灶的DTC患者,68Ga-PSMA PET/CT可探查到64.28%(9/14)的病灶,而18F-FDG PET/CT的阳性率为78.57%(11/14),68Ga-PSMA PET/CT阳性病灶主要位于肺和骨骼,其中2个骨骼的病变18F-FDG PET/CT漏诊而68Ga-PSMA PET/CT呈阳性。一项头对头比较68Ga-PSMA和18F-FDG PET/CT探查甲状腺癌病灶效能的研究[29]发现,无论是DTC还是RAIR-DTC病灶,前者的阳性率均低于后者(60.00% vs 90.00%, 59.38% vs 96.88%),免疫组织化学染色证实RAIR-DTC病灶的PSMA表达明显强于DTC病灶,但与68Ga-PSMA PET/CT上的最大标准化摄取值(standardized uptake value maximum,SUVmax)并没有显著相关性。上述结果提示68Ga-PSMA PET/CT在探查RAIR-DTC病灶方面具有一定的临床价值,尽管其诊断效能并不优于经典的18F-FDG PET/CT,但却具有筛选患者进行后续放射性配体治疗(radioligand therapy,RLT)的独特优势(图3)。
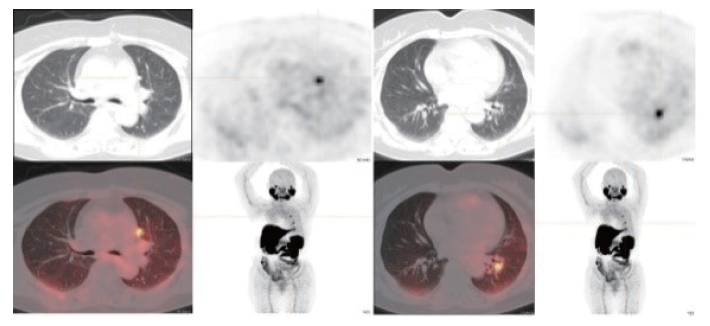
图3 18F-PSMA PET/CT
Fig. 3 18F-PSMA PET/CT
3.1.2 靶向成纤维细胞激活蛋白(fibroblast activation protein,FAP)
FAP是一种Ⅱ型跨膜丝氨酸蛋白酶,在90%以上的上皮源性恶性肿瘤的肿瘤相关成纤维细胞(carcinoma-associated fibroblasts,CAFs)表面呈过表达,可促进CAFs、肿瘤细胞、内皮细胞等的增殖、迁移和侵袭,导致细胞外基质降解、肿瘤血管化和逃避免疫监测[30]。核素标记FAP抑制剂(FAP inhibitor,FAPI)可特异性地识别CAFs,进而实现对肿瘤病灶的定位(图4)。Fu等[31]的研究纳入了35例临床可疑或确诊转移性DTC的患者,均进行了68Ga-FAPI和18F-FDG PET/CT,结果显示,68Ga-FAPI PET/CT探查颈部淋巴结及远处转移的灵敏度明显高于18F-FDG PET/CT(83% vs 65%,79% vs 59%,P<0.001),且不同部位病灶对68Ga-FAPI的SUVmax也均高于18F-FDG,提示68Ga-FAPI PET/CT在探查转移性DTC方面要优于18F-FDG PET/CT。
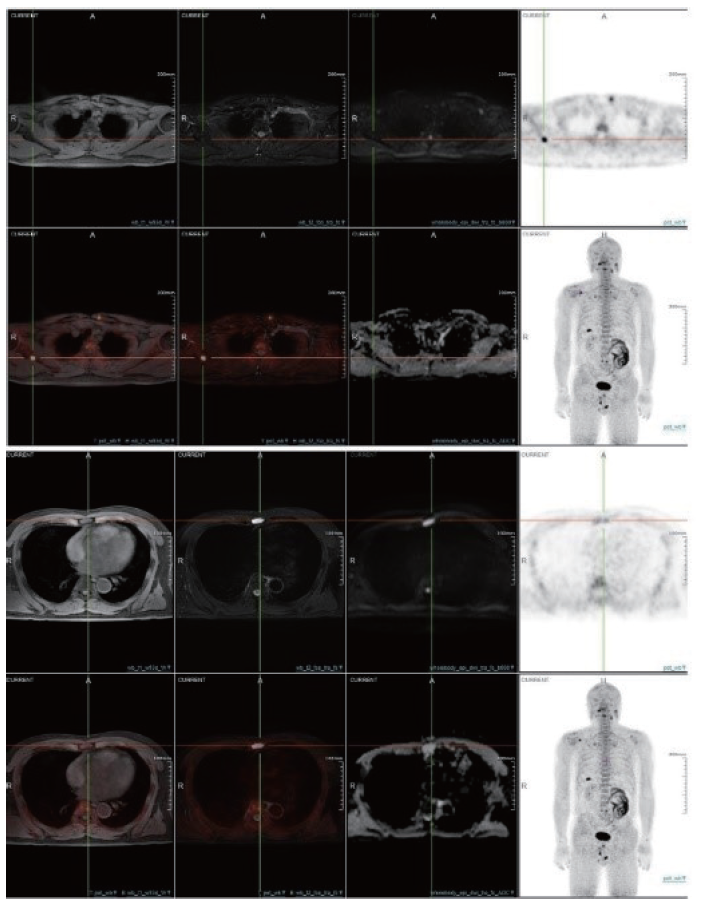
图4 18F-FAPI PET/MRI
Fig. 4 18F-FAPI PET/MRI
3.1.3 靶向生长抑素受体(somatostatin receptor, SSR)
甲状腺滤泡上皮细胞来源的肿瘤可同时表达3种以上的SSR,参与调控肿瘤细胞增殖。核素标记SSR类似物如68Ga-DOTANOC、68Ga-DOTATATE等可用于探测RAIR-DTC病灶。Kundu等[32]的研究对比分析了68Ga-DOTANOC和18F-FDG PET/CT评估Tg阳性而131I-WBS阴性的持续/复发或转移性DTC病灶,基于患者分析两者的阳性率差异无统计学意义(65% vs 72%,P=0.226),但基于病灶分析结果显示,68Ga-DOTANOC PET/CT的阳性率要低于18F-FDG PET/CT(65% vs 90.3%,P<0.000 1),该研究初步展示了68Ga-DOTANOC PET/CT探查不摄碘DTC病灶的可行性。另一项头对头比较TSH刺激及抑制状态下68Ga-DOTATATE和18F-FDG PET/CT探查Tg阳性而131I-WBS阴性DTC患者的研究[33]发现,无论TSH水平如何,两者均有很高的诊断准确率(TSH刺激状态下:86% vs 92%;TSH抑制状态下:92% vs 85%),68Ga-DOTATATE PET/CT探查淋巴结病变的灵敏度比18F-FDG PET/CT更高,但对肺及骨转移病变的探查效能无明显差异。靶向SSR的核素显像可作为18F-FDG PET/CT显像阴性时探查RAIR-DTC病灶的补充手段,并有望筛选患者进行肽受体介导的放射性核素治疗(peptide receptor radionuclide therapy,PRRT)。
3.2 指导精准靶向RAIR-DTC病灶的RLT或PRRT决策
RAIR-DTC病灶在68Ga-PSMA及68Ga-FAPI PET/CT上的高摄取为后续的RLT提供了可能性,靶向PSMA和FAPI的核素诊疗一体化策略为多线治疗失败的进展期RAIR-DTC患者提供了新的选择。Sonavane等[34]的研究采取分子影像PSMA(molecular imaging PSMA,miPSMA)评分来筛选可进行177Lu-PSMA靶向性核素治疗的患者,对于缺乏有效治疗手段的进展期RAIR-DTC患者,当68Ga-PSMA PET/CT所示的miPSMA评分≥2分(呈中等或高摄取),即视觉分析病灶对PSMA的摄取等于或高于肝脏,则可考虑尝试后续采取RLT。一项针对TKIs治疗后进展的RAIR-DTC患者进行177Lu-DOTAGA.(SA.FAPI)2挽救治疗的探索性研究[35]中,入组标准要求68Ga-DOTA SA.FAPI PET/CT显示病灶明显高摄取且病灶数量≥18F-FDG PET/CT所见,如仅表现为对FAPI的轻中度摄取或18F-FDG PET/CT显示更多病灶则应排除在外。
同样,68Ga-DOTATATE PET/CT也可用于筛选进行靶向SSR的PRRT的患者。在一项纳入74例Tg阳性而131I-WBS阴性的转移性DTC的研究[34]中,反映视觉分析示踪剂摄取能力的Krenning’s评分≥3分,即68Ga-DOTATATE PET/CT显示病灶摄取高于肝脏甚至高于脾脏,则考虑满足后续PRRT的基本条件,该研究中有7例患者(9.45%)可考虑进行177Lu-DOTATATE治疗。
随着临床研究的开展及循证医学证据的积累,核医学分子影像在RAIR-DTC界定、评估及治疗决策中的价值逐渐达成共识,争议逐渐减少,但仍有一定的探索空间,例如,如何优化RAI显像策略以达到更准确评估DTC病灶的摄碘能力;除血清学及其他影像学检查发现外,是否还有其他特征(如病灶分子生物学特征)支持18F-FDG PET/CT的早期临床应用;18F-FDG PET/CT评价RAIR-DTC局部或系统治疗效果的最佳时机;多种新型核素显像可以指导RLT或PRRT决策,如何通过治疗后显像的动态变化修正治疗方案等。
综上,核医学分子影像在RAIR-DTC的全流程诊治管理中具有不可替代的临床价值。131I-WBS及SPECT/CT可明确DTC病灶的摄碘特征;结合血清学及其他影像学检查还可评价131I治疗效果,因此成为判断RAIR-DTC的重要依据。18F-FDG PET/CT可探查不摄碘病灶,与131I-WBS结合有助于全面评估全身肿瘤负荷;可通过评估病灶的葡萄糖代谢特征来预测疾病进展速度及远期预后;还可通过治疗前后的早期代谢反应预测患者临床获益,以便及时调整治疗方案。此外,靶向RGD肽、PSMA、FAP、SSR等的多种新型核素显像可作为探查RAIR-DTC病灶的有益补充。尽管其探测效能并未显著优于经典的18F-FDG PET/CT,但根据病灶对示踪剂的摄取能力可以筛选适合后续进行靶向性核素治疗的患者,弥补不摄碘病灶不再适用131I治疗的不足,为多线治疗后病情仍进展的RAIR-DTC患者提供了有效的核素诊疗一体化新选择。
通信作者:
王任飞,博士,主任医师,同济大学附属第十人民医院核医学科副主任。
作者贡献声明:
王任飞:文章框架设计,资料收集与分析,文章撰写,知识性内容的审阅等;卢改霞:图像收集与处理。
[参考文献]
[1] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133.
[2] 中国临床肿瘤学会核医学专家委员会, 中国临床肿瘤学会甲状腺癌专家委员会, 中华医学会核医学分会, 等. 放射性碘难治性分化型甲状腺癌诊治管理指南(2024版)[J].中华核医学与分子影像杂志, 2024, 44(6): 359-372.
Nuclear Medicine Expert Committee of Chinese Society of Clinical Oncology, Thyroid Cancer Expert Committee of Chinese Society of Clinical Oncology, Chinese Society of Nuclear Medicine, et al. Management guidelines for radioactive iodinerefractory differentiated thyroid cancer (2024 edition)[J]. Chin J Nucl Med Mol Imag, 2024, 44(6): 359-372.
[3] JIN Y C, VAN NOSTRAND D, CHENG L X, et al. Radioiodine refractory differentiated thyroid cancer[J]. Crit Rev Oncol Hematol, 2018, 125: 111-120.
[4] ZILIOLI V, PELI A, PANAROTTO M B, et al. Differentiated thyroid carcinoma: incremental diagnostic value of 131I SPECT/CT over planar whole body scan after radioiodine therapy[J]. Endocrine, 2017, 56(3): 551-559.
[5] MORRIS L F, WAXMAN A D, BRAUNSTEIN G D. The nonimpact of thyroid stunning: remnant ablation rates in 131I-scanned and nonscanned individuals[J]. J Clin Endocrinol Metab, 2001, 86(8): 3507-3511.
[6] YAP B K, MURBY B. No adverse affect in clinical outcome using low preablation diagnostic (131)I activity in differentiated thyroid cancer: refuting thyroid-stunning effect[J]. J Clin Endocrinol Metab, 2014, 99(7): 2433-2440.
[7] DE LA VIEJA A, RIESCO-EIZAGUIRRE G. Radio-iodide treatment: from molecular aspects to the clinical view[J]. Cancers (Basel), 2021, 13(5): 995.
[8] SABRA M M, GREWAL R K, TALA H, et al. Clinical outcomes following empiric radioiodine therapy in patients with structurally identifiable metastatic follicular cell-derived thyroid carcinoma with negative diagnostic but positive posttherapy 131I whole-body scans[J]. Thyroid, 2012, 22(9): 877-
883.
[9] SOUZA ROSÁRIO P W, BARROSO A L, REZENDE L L, et al. Post I-131 therapy scanning in patients with thyroid carcinoma metastases: an unnecessary cost or a relevant contribution?[J]. Clin Nucl Med, 2004, 29(12): 795-798.
[10] FATOURECHI V, HAY I D, MULLAN B P, et al. Are posttherapy radioiodine scans informative and do they influence subsequent therapy of patients with differentiated thyroid cancer? [J]. Thyroid, 2000, 10(7): 573-577.
[11] 王任飞, 高再荣, 欧阳伟, 等. 分化型甲状腺癌转移灶摄碘能力与131I清灶疗效关系的回顾性多中心研究[J]. 中华核医学与分子影像杂志, 2020, 40(6): 334-338.
WANG R F, GAO Z R, OUYANG W, et al. Correlation between 131I uptake and therapeutic efficacy in metastatic differentiated thyroid carcinoma: a retrospective multicenter study\n[J]. Chin J Nucl Med Mol Imag, 2020, 40(6): 334-338.
[12] SA R, CHENG L, JIN Y C, et al. Distinguishing patients with distant metastatic differentiated thyroid cancer who biochemically benefit from next radioiodine treatment[J]. Front Endocrinol (Lausanne), 2020, 11: 587315.
[13] GULEC S A, AHUJA S, AVRAM A M, et al. A joint statement from the American Thyroid Association, the European Association of Nuclear Medicine, the European Thyroid Association, the Society of Nuclear Medicine and Molecular Imaging on current diagnostic and theranostic approaches in the management of thyroid cancer[J]. Thyroid, 2021, 31(7): 1009-1019.
[14] 中华医学会核医学分会. 131I治疗分化型甲状腺癌指南(2021版)[J]. 中华核医学与分子影像杂志, 2021, 41(4): 218-241.
Chinese Society of Nuclear Medicine. Guidelines for radioiodine therapy of differentiated thyroid cancer (2021 edition)[J]. Chin J Nucl Med Mol Imag, 2021, 41(4): 218-241.
[15] 中国临床肿瘤学会甲状腺癌专业委员会, 中国研究型医院学会分子诊断专业委员会甲状腺癌学组, 医促会甲状腺疾病专业委员会核医学组, 等. 分化型甲状腺癌术后131I治疗前评估专家共识[J]. 中国癌症杂志, 2019, 29(10): 832-840.
Chinese Clinical Oncology Society Thyroid Cancer Professional Committee, Thyroid Cancer Sub-group of the Molecular Diagnosis Professional Committee of the Chinese Research Hospital Association, Nuclear Medicine Group of the Thyroid Disease Professional Committee of the China Association for the Promotion of Medical and Health Care, et al. Expert consensus on pre-treatment assessment of 131I therapy after differentiated thyroid cancer surgery[J]. China Oncol, 2019, 29(10): 832-840.
[16] WAN Q C, BAI L, ZHAO G G, et al. Diagnostic performance of 18F-FDG-PET/CT in DTC patients with thyroglobulin elevation and negative iodine scintigraphy: a meta-analysis[J]. Eur J Endocrinol, 2019, 181(2): 93-102.
[17] ALBANO D, TULCHINSKY M, DONDI F, et al. Thyroglobulin doubling time offers a better threshold than thyroglobulin level for selecting optimal candidates to undergo localizing[18F] FDG PET/CT in non-iodine avid differentiated thyroid carcinoma[J]. Eur J Nucl Med Mol Imaging, 2021, 48(2): 461-468.
[18] GIOVANELLA L, TRIMBOLI P, VERBURG F A, et al. Thyroglobulin levels and thyroglobulin doubling time independently predict a positive 18F-FDG PET/CT scan in patients with biochemical recurrence of differentiated thyroid carcinoma[J]. Eur J Nucl Med Mol Imaging, 2013, 40(6): 874-880.
[19] WANG H X, DAI H Y, LI Q R, et al. Investigating 18F-FDG PET/CT parameters as prognostic markers for differentiated thyroid cancer: a systematic review[J]. Front Oncol, 2021, 11: 648658.
[20] ALBANO D, DONDI F, MAZZOLETTI A, et al. Prognostic role of 2-[18F] FDG PET/CT metabolic volume parameters in patients affected by differentiated thyroid carcinoma with high thyroglobulin level, negative 131I wbs and positive 2-[18F]- FDG PET/CT[J]. Diagnostics, 2021, 11(12): 2189.
[21] ROBBINS R J, WAN Q, GREWAL R K, et al. Real-time prognosis for metastatic thyroid carcinoma based on 2-[18F] fluoro-2-deoxy-D-glucose-positron emission tomography scanning[J]. J Clin Endocrinol Metab, 2006, 91(2): 498-505.
[22] AHMADDY F, BURGARD C, BEYER L, et al. 18F-FDG-PET/CT in patients with advanced, radioiodine refractory thyroid cancer treated with lenvatinib[J]. Cancers (Basel), 2021, 13(2): 317.
[23] RENDL G, SCHWEIGHOFER-ZWINK G, SORKO S, et al. Assessment of treatment response to lenvatinib in thyroid cancer monitored by F-18 FDG PET/CT using PERCIST 1.0, modified PERCIST and EORTC criteria-which one is most suitable?[J]. Cancers (Basel), 2022, 14(8): 1868.
[24] VALERIO L, GUIDOCCIO F, GIANI C, et al. [18F]- FDG-PET/CT correlates with the response of radiorefractory thyroid cancer to lenvatinib and patient survival[J]. J Clin Endocrinol Metab, 2021, 106(8): 2355-2366.
[25] ZHAO D, JIN X N, LI F, et al. Integrin αvβ3 imaging of radioactive iodine-refractory thyroid cancer using 99mTc-3PRGD2[J]. J Nucl Med, 2012, 53(12): 1872-1877.
[26] PARIHAR A S, MITTAL B R, KUMAR R, et al. 68Ga-DOTARGD2 positron emission tomography/computed tomography in radioiodine refractory thyroid cancer: prospective comparison of diagnostic accuracy with 18F-FDG positron emission
tomography/computed tomography and evaluation toward potential theranostics[J]. Thyroid, 2020, 30(4): 557-567.
[27] CIAPPUCCINI R, SAGUET-RYSANEK V, GIFFARD F, et al. PSMA expression in differentiated thyroid cancer: association with radioiodine, 18FDG uptake, and patient outcome[J]. J Clin Endocrinol Metab, 2021, 106(12): 3536-3545.
[28] VERMA P, MALHOTRA G, MESHRAM V, et al. Prostatespecific membrane antigen expression in patients with differentiated thyroid cancer with thyroglobulin elevation and negative iodine scintigraphy using 68Ga-PSMA-HBED-CC PET/CT[J]. Clin Nucl Med, 2021, 46(8): e406-e409.
[29] SHI Y R, FENG Y Y, XU L, et al. The value of Gallium-68 prostate-specific membrane antigen ([68Ga] Ga-PSMA-11) PET/CT and 2-[18F] fluoro-2-deoxy-D-glucose (2-[18F]FDG) PET/CT in the detection of thyroid cancer lesions: a prospective head-to-head comparison[J]. Br J Radiol, 2023: 20230291.
[30] LIU F, QI L, LIU B, et al. Fibroblast activation protein overexpression and clinical implications in solid tumors: a meta-analysis[J]. PLoS One, 2015, 10(3): e0116683.
[31] FU H, WU J, HUANG J X, et al. 68Ga fibroblast activation protein inhibitor PET/CT in the detection of metastatic thyroid cancer: comparison with 18F-FDG PET/CT[J]. Radiology, 2022, 304(2): 397-405.
[32] KUNDU P, LATA S, SHARMA P, et al. Prospective evaluation of 68Ga-dotanoc pet-ct in differentiated thyroid cancer patients with raised thyroglobulin and negative 131I-whole body scan: comparison with 18F-FDG PET-CT[J]. Eur J Nucl Med Mol Imag, 2014, 41(7): 1354-1362.
[33] ALMEIDA L S, SANTOS A, ASSUMPÇÃO L, et al. 68Ga-DOTATATE PET/CT versus 18F-FDG PET/CT in TENIS syndrome: a head-to-head comparison with elevated and suppressed TSH levels in papillary thyroid carcinoma-a pilot study[J]. Clin Nucl Med, 2024, 49(11): 1004-1013.
[34] SONAVANE S, SALVI O, ASOPA R V, et al. Assessing Krenning’s score on 68 Ga-DOTATATE PET-CT and miPSMA score on 68Ga-PSMA-11 PET-CT in TENIS: a comparison with FDG PET/CT and examining the feasibility of targeted radionuclide therapy[J]. Nucl Med Commun, 2024, 45(8): 690-701.
[35] BALLAL S, YADAV M P, MOON E S, et al. Novel fibroblast activation protein inhibitor-based targeted theranostics for radioiodine-refractory differentiated thyroid cancer patients: a pilot study[J]. Thyroid, 2022, 32(1): 65-77.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)