首页 > 医疗资讯/ 正文
[摘要] 背景与目的:甲状腺癌是最常见的内分泌系统恶性肿瘤,在亚洲人群中尤为高发。甲状腺癌患者整体生存率较高,但不同患者的生存差异较大,本研究基于医院登记为基础的5.5万例甲状腺癌患者的随访资料,了解甲状腺癌患者的长期观察总生存(overall survival,OS)率,分析甲状腺癌患者死亡的特征及死因分布,为甲状腺癌患者的生存管理提供真实世界数据支持。方法:纳入2005年1月1日—2021年12月31日在复旦大学附属肿瘤医院接受治疗的甲状腺癌患者共55 343例,通过查阅病史了解患者的临床信息,并通过复诊病史、电话随访和死因数据链接等方式收集患者的生存随访资料和死亡信息,随访统计时间截至2024年10月31日。采用Kaplan-Meier法估计患者的OS率,并在不同性别、年龄组、治疗时期、肿瘤分期及病理学特征等亚组中分别描述。以上海市人口死亡为参照计算标准死亡比(standardized mortality ratio,SMR)和绝对超额风险(absolute excess risk,AER),并在不同性别、诊断时年龄及组织学亚型中分别描述死亡风险。结果:甲状腺癌患者经中位随访63.01个月后,共发生1 256例(2.27%)死亡,1、3、5和10年OS率分别为99.67%(95% CI:99.62%~99.72%)、99.11%(95% CI:99.03%~99.19%)、98.48%(95% CI:98.36%~98.60%)和95.81%(95% CI:95.50%~96.11%);Ⅰ、Ⅱ、Ⅲ和Ⅳ期甲状腺癌患者的10年OS率分别为97.99%(95% CI:97.70%~98.28%)、89.80%(95% CI:87.24%~92.37%)、77.84%(95% CI:70.76%~84.92%)和62.95%(95% CI:55.37%~70.54%)。不同性别、年龄、组织学分型的患者生存存在显著差异。1 256例死亡患者中,234例(18.63%)因甲状腺癌而死亡,最常见的死因为其他肿瘤(n=639,50.88%),另有92例(7.32%)死亡归因于心脑血管疾病(cardiovascular disease,CVD)。甲状腺癌各个亚型患者的全死因死亡率都比一般人群高,并在甲状腺乳头状癌、甲状腺滤泡癌、甲状腺髓样癌和甲状腺未分化癌/低分化型甲状腺癌中死亡风险逐步递增,甲状腺乳头状癌患者的死亡风险是一般人群的2.24倍(95% CI:2.06~2.44),甲状腺滤泡癌和甲状腺髓样癌的死亡风险分别为一般人群的9.94倍(95% CI:6.79~14.09)和12.16倍(95% CI:8.05~17.69),甲状腺未分化癌/低分化型甲状腺癌患者的死亡风险最高[SMR=79.67(95% CI:58.38~106.31),AER=766.01/1 000人年]。结论:报告国内单中心甲状腺癌患者的10年生存结果及不同组织学类型的死因分析,组织学亚型、肿瘤分期是影响甲状腺癌患者生存的重要因素,早期诊断和个体化治疗对改善预后至关重要。
[关键词] 甲状腺癌;总生存率;医院登记;死因分析
[Abstract] Background and purpose: Thyroid cancer is the most common malignant endocrine tumor, particularly prevalent among the Asian population. The overall survival for thyroid cancer patients is relatively high, but there are significant survival differences among patients. Based on long-term hospital-based cancer registry database, this study analyzed the 10-year observed overall survival (OS) rate of thyroid cancer cases and the distribution of causes of death, providing real-world evidences to further survival management of thyroid cancer in China. Methods: A total of 55343 thyroid cancer patients who underwent treatment at Fudan University Shanghai Cancer center from 2005 to 2021 were included in this study. Clinical information and the follow-up endpoint data were collected through medical records review, telephone visits and death registry data linkage. The last follow-up date was October 31, 2024. Kaplan-Meier method was applied in evaluating the OS rate, and survival data were described by different subgroups as age group, gender, treatment period, tumor staging and pathological characteristics. The standardized mortality ratio (SMR) and absolute excess risk (AER) were calculated using general Shanghai population as the reference, and the mortality risk was described by gender, age at diagnosis and histological subtype. Results: With a median follow-up time of 63.01 months, the overall 1-, 3-, 5- and 10-year OS rates of thyroid cancer patients were 99.67% (95% CI: 99.62%-99.72%), 99.11% (95% CI: 99.03%-99.19%), 98.48% (95% CI: 98.36%-98.60%) and 95.81% (95% CI: 95.50%-96.11%), respectively. The 10-year OS rates of stage Ⅰ, Ⅱ, Ⅲ and Ⅳ were 97.99% (95% CI: 97.70%-98.28%), 89.80% (95% CI: 87.24%-92.37%), 77.84% (95% CI: 70.76%-84.92%) and 62.95% (95% CI: 55.37%-70.54%), respectively. The differences in OS among patients with different age, gender and histological classification were significant. 1256 (2.27%) deaths occurred, of which 18.63%, 50.88% and 7.32% were attributable to thyroid cancer, other cancers and cardiovascular disease (CVD), respectively. Compared with the general population, patients with different subtypes of thyroid cancer had higher all-cause mortality rates, progressively increasing with papillary, follicular, medullary and anaplastic thyroid carcinoma/poorly differentiated carcinoma. Compared with general population, the death risk was 2.24 times higher in papillary thyroid cancer patients (95% CI: 2.06-2.44), 9.94 times higher in follicular thyroid cancer patients (95% CI: 6.79-14.09), 12.16 times higher in medullary thyroid cancer patients (95% CI: 8.05-17.69), and the highest risk was observed in patients with anaplastic thyroid carcinoma/poorly differentiated carcinoma [SMR=79.67 (95% CI: 58.38-106.31), AER=766.01/1 000 person-years]. Conclusion: The 10-year long survival data and cause of death for thyroid cancer patients with different histological types were reported in China based on a large single institution hospital-based cancer registry database. Staging and histological characteristics were the most important factors directly affected the survival. Early diagnosis and individualized treatment are crucial for improving prognosis.
[Key words] Thyroid cancer; Overall survival rate; Hospital-based registry; Cause-of-death analysis
甲状腺癌是最常见的内分泌系统恶性肿瘤,在亚洲人群中尤为高发,严重影响中国居民的健康。最新发布的中国恶性肿瘤流行病学数据[1]显示,2022年中国新发甲状腺癌46.61万例,发病率位居所有恶性肿瘤的第3位,2022年因甲状腺癌死亡1.16万例。
相比其他恶性肿瘤,甲状腺癌患者预后较好。中国国家癌症中心收集的全国17个癌症登记处以人群为基础的生存研究报告[2]显示,中国甲状腺癌患者整体生存率较高,且生存率逐年上升,2003—2005年、2006—2008年、2009—2011年和2012—2015年诊断的甲状腺癌患者5年相对生存率分别为67.5%、73.9%、77.2%和84.3%。
虽然甲状腺癌患者整体生存率较高,但不同患者的生存差异较大,部分患者的生存情况较差,导致生存差异的原因较为复杂,涉及多种因素,如不同的组织学类型、临床分期等,目前国内大数据的生存证据尚缺乏,大部分的生存数据来源于美国国家癌症研究所(National Cancer Institute,NCI)的监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results,SEER)数据库;虽然大多数甲状腺癌患者都能获得较好的预后,但不同个体的死亡风险存在较大差异,仍然存在部分预后极差的个体,这部分甲状腺癌患者的风险如何预测,如何识别死亡风险较高的患者,并进行及时、个性化的治疗和干预,鲜有大数据的报道支持。本研究以医院登记为基础,对2005年之后治疗的5.5万例甲状腺癌手术患者的10年观察生存率进行分析,并对不同特征的甲状腺癌的死亡情况进行详细描述,为中国甲状腺癌患者的生存提供来自真实世界的依据,并为死亡高风险甲状腺癌患者的识别、甲状腺癌个性化治疗提供证据支持。
1 资料和方法
1.1 研究对象
研究对象的纳入标准:① 首次治疗日期在2005年1月1日—2021年12月31日,以在复旦大学附属肿瘤医院首次接受甲状腺癌手术或治疗时间为首次治疗时间;② 原发肿瘤部位在甲状腺, ICD-10编码为C73的患者。
研究对象的排除标准:① 未在复旦大学附属肿瘤医院进行住院治疗的甲状腺癌患者;② 仅行局部切除术或淋巴结清扫术而未行根治术等主要治疗的患者;③ 原发灶不为甲状腺的恶性肿瘤患者(如乳腺癌、头颈部恶性肿瘤、肾癌或原发不明恶性肿瘤侵犯甲状腺等转移性甲状腺癌);④ 结节性甲状腺瘤、甲状腺结节等良性病变;⑤ 甲状腺淋巴瘤患者;⑥ 死亡时间未知的患者(3人)。
1.2 随访计划
随访计划详见以医院登记为基础的20万例恶性肿瘤患者生存报告[3],简单而言,患者出院满1年后进行首次随访,5年内每年1次,5年后每2年1次,直至死亡发生时终止随访。
生存结局资料采用被动和主动两种方式收集,主要包括病史查阅、电话随访和死因数据链接3种方式。病史查阅和死因数据链接为被动随访,病史查阅是从患者出院1年后开始,按随访计划规定的周期,查阅门诊及住院病历信息了解患者是否有疾病进展(包括局部复发、远处转移、第二原发恶性肿瘤等)事件,记录疾病进展发生时间和最近1次就诊时间;死因数据链接是指通过与相关省市级疾病预防控制中心肿瘤登记系统或死因登记系统进行数据链接和匹配,获得患者死亡结局资料,包括死亡日期和死因。对于随访计划规定的周期内没有任何来院复诊记录的患者,通过电话进行主动随访,由经过培训的专职随访人员根据病历记录的联系方式联系患者或家属,通过电话问询了解其疾病进展及生存情况,记录疾病进展发生时间、死亡日期和死因。随访信息收集截止时间为2024年10月31日。本研究已通过复旦大学附属肿瘤医院医学伦理委员会审批(伦理编号:2106237-19)。
1.3 资料收集
本研究收集的资料内容如下:① 患者基本信息,如性别、年龄、首次治疗时间;② 临床信息,包括组织学分型、病理学分期等,按照组织来源分为甲状腺乳头状癌(papillary thyroid carcinoma,PTC)、甲状腺滤泡癌(follicular thyroid carcinoma,FTC)、甲状腺髓样癌(medullary thyroid carcinoma,MTC)、甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)和低分化型甲状腺癌(poorly differentiated thyroid carcinoma,PDTC),病理学分期按国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版甲状腺癌TNM分期标准[4]分类,pTNM分期分为Ⅰ、Ⅱ、Ⅲ和Ⅳ期;③ 随访信息和死亡信息,包括疾病进展(复发、转移或第二原发等)事件和发生时间、死因和死亡时间,以及末次随访时间。
上海市人口死亡信息数据(包括上海市平均人口、分年龄、性别死亡人数和死亡率)来自2020年上海市人口普查年鉴[5]。
1.4 统计学处理
统计指标采用观察生存率,即总生存(overall survival,OS)率。生存分析终点事件为全死因死亡。OS时间定义为从患者在本院首次治疗时间至生存终点事件全死因死亡的时间,统计截止时尚未发生终点事件及未知终点事件的患者,在末次随访时间点按删失处理。
采用Kaplan-Meier法估计1、3、5年及10年观察生存率及其95% CI,并根据不同性别、年龄组、治疗时期、肿瘤分期及病理学特征等各亚组,分别描述不同特征患者的OS率。采用反向Kaplan-Meier法估计中位随访时间。
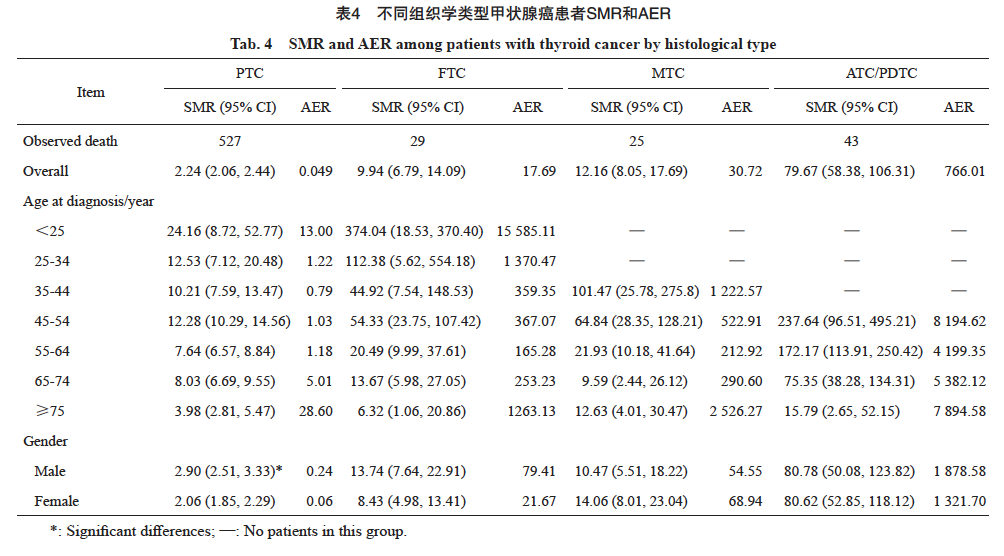
用标准死亡比(standardized mortality ratio,SMR)和绝对超额风险(absolute excess risk,AER)估计死亡风险。SMR的计算采用研究组中观察到的死亡人数除以一般人群中的预期死亡人数。预期死亡人数是通过将研究组的风险人年乘以同一时期一般人群中相同年龄和性别的死亡率来估算。采用Boice-Monson法来计算相应的95% CI。SMR>1表示死亡风险高于一般人群,而<1则表明死亡风险低于一般人群。AER的估算是从观察到的死亡中减去预期死亡,除以研究组的风险人年,并以每1 000人年的风险表示。
研究中计数资料比较采用χ2检验,死亡数据比较采用Fisher精确检验(数据量较小)。检验水准采用双侧α=0.05,P<0.05为差异有统计学意义。
2 结 果
在所有55 343例住院接受治疗的甲状腺癌患者中,72.38%为女性,27.62%为男性,平均年龄为(43.30±12.07)岁。从2010年开始,甲状腺癌患者出现激增,组织学类型中以PTC为主,占81.84%;从病理学分期来看,大部分患者为Ⅰ 期,占76.17%,Ⅱ期占5.58%,Ⅲ期占0.69%,Ⅳ 期占0.55%(表1)。
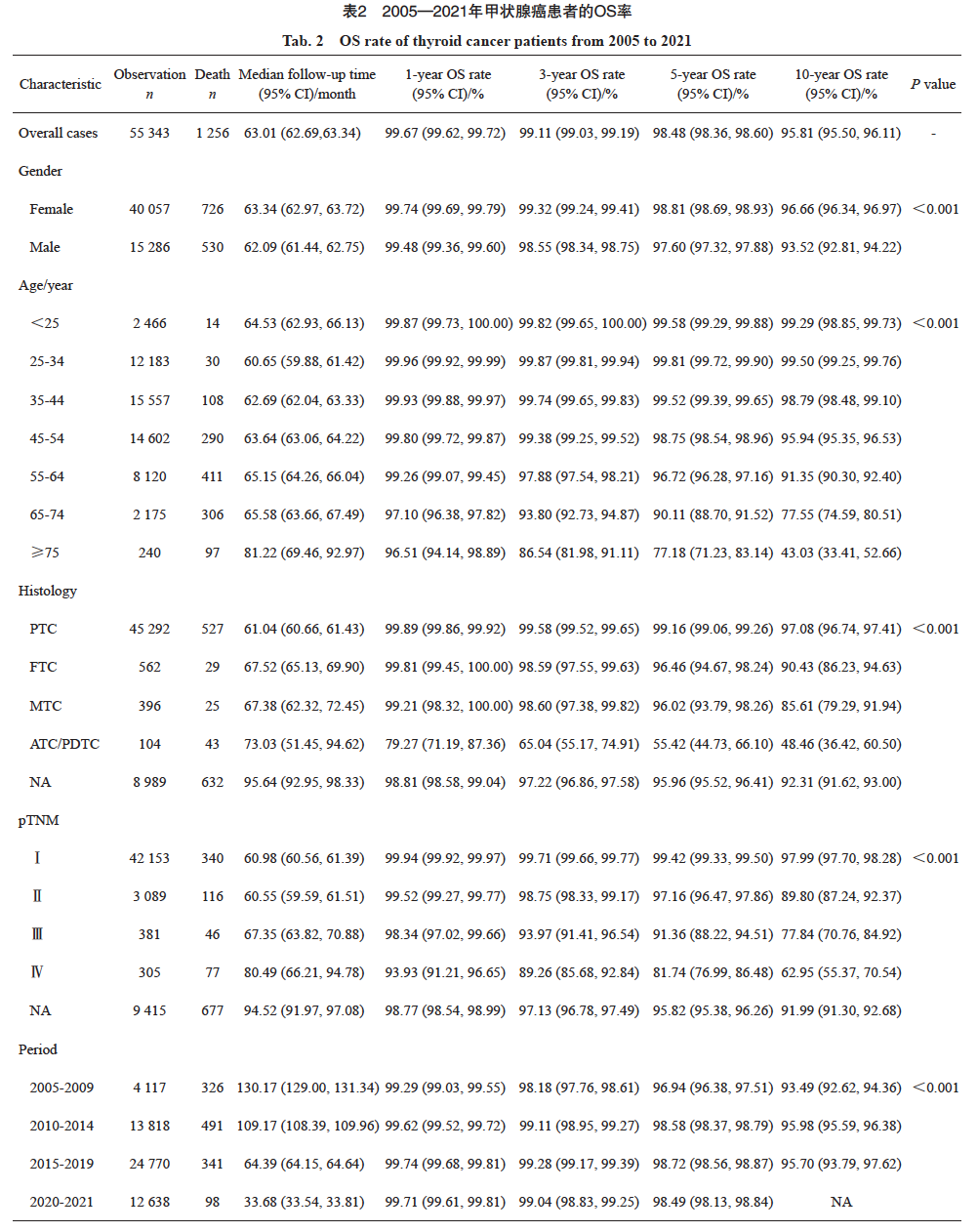
甲状腺癌患者的总体生存较好,2005—2021年甲状腺癌患者1、3、5和10年OS率分别为99.67%(95% CI:99.62~99.72)、99.11%(95% CI:99.03~99.19)、98.48%(95% CI:98.36~98.60)和95.81%(95% CI:95.50~96.11)。不同性别、年龄、组织学分型、分期和诊断时期的患者生存存在显著差异。10年OS率随着年龄不断增大生存不断变差,75岁以上年龄组患者的10年OS率显著低于其他年龄组。不同组织学分型的患者生存差异显著,PTC的生存最优,10年OS率达97.08%,FTC和MTC次之,10年OS率分别为90.43%和85.61%,ATC/PDTC最低,10年OS率仅为48.46%;不同分期的患者生存状况差异明显,Ⅰ、Ⅱ、Ⅲ和Ⅳ期患者的10年OS率分别为97.99%、89.80%、77.84%和62.95%。不同诊断时期的生存也存在显著差异,2010年之后诊断的患者生存有显著提高(表2)。
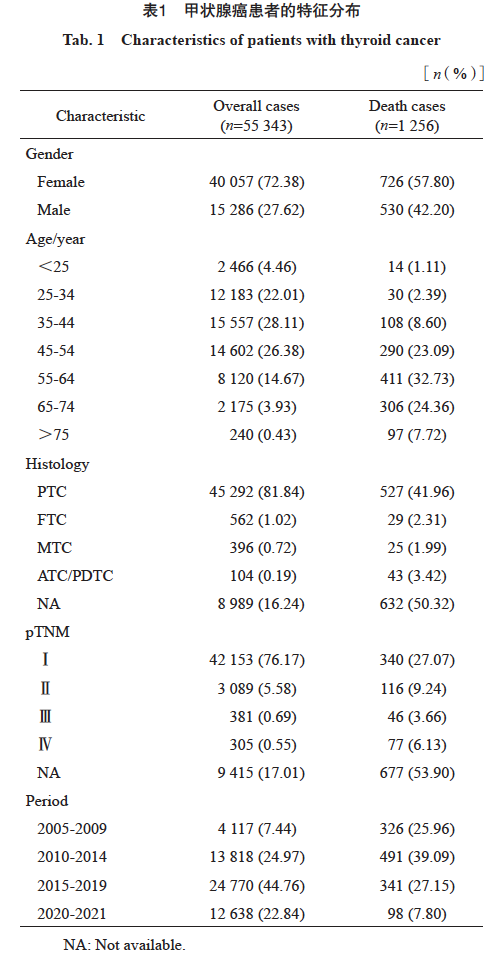
在所有1 256例死亡患者中,18.63%死亡归因于甲状腺癌,最常见的死因为其他肿瘤(n=639,50.88%),另有7.32%死于心脑血管疾病(cardiovascular disease,CVD),8.05%归因于其他非肿瘤、非心血管系统疾病,包括呼吸系统、消化系统、内分泌系统疾病、伤害及意外(表3)。
不同组织学类型的患者死因分布详见图1。亚组分析显示,不同组织学类型的患者在诊断后不同年份的死因分布存在明显差异(Fisher精确检验,P<0.001)。PTC的患者大部分主要是因其他肿瘤而死亡,尤其是在诊断后10年内;FTC患者在诊断后1年内大部分因甲状腺癌而死亡,这一比例随诊断时间而不断下降;MTC患者诊断后10年内因甲状腺癌死亡的比例相近,但10年后大部分因CVD死亡;ATC/PDTC患者因甲状腺癌而死亡的比例随诊断后时间的增加而不断上升,诊断10年后大部分都死于甲状腺癌。
与一般人群相比,各个亚型的甲状腺癌患者的总体死亡风险都较高,PTC、FTC、MTC和ATC/PDTC的死亡风险逐渐升高。ATC/PDTC的死亡风险最高[SMR=79.67(95% CI:58.38~106.31),AER=766.01/1 000人年]。亚组分析显示各个组织学类型的死亡率SMR都随着诊断年龄的增加而逐渐下降(表4)。
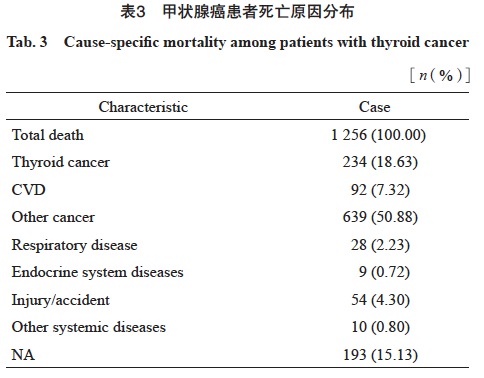
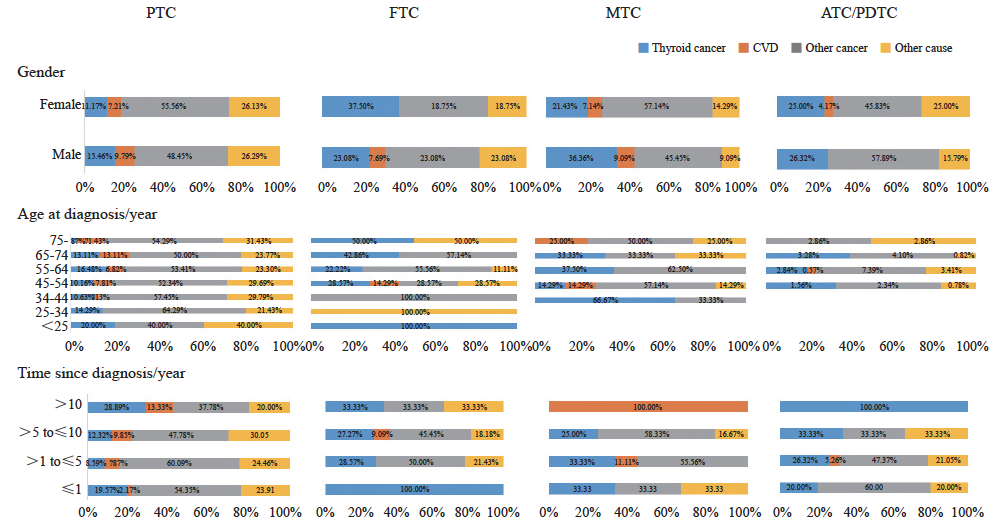
图1 不同组织学类型甲状腺癌患者的死因别比例图
Fig. 1 Proportional mortality ratio by cause of death, stratified by demographic characteristics according to histologic type
3 讨 论
本研究总结了以国内单中心医院登记为基础的5.5万例甲状腺癌患者的生存结局,描绘了不同特征患者的10年OS率,为中国甲状腺癌患者的生存提供了真实世界数据;并对甲状腺癌患者的死亡原因、不同组织学特征患者的死亡风险进行了详细分析,反映了中国经济发达地区近年来甲状腺癌的防治效果、预后及影响因素,作为国内大规模甲状腺癌长期随访、具有丰富临床信息、死因及其死亡风险分析的生存报告,为了解中国个性化甲状腺癌的诊疗、提高死亡高风险患者的生存获益提供了可靠依据。
基于人群的肿瘤登记资料[6]显示,全球甲状腺癌患者整体生存较好,2009—2018年美国甲状腺癌患者的5年OS率为98%。基于29个欧洲国家87个肿瘤登记处的人群研究EUROCARE-5的数据[7]显示,2000—2007年欧洲国家甲状腺癌患者的5年相对生存率女性为88%,男性为81%。英国国家统计局的数据[8]显示,英国甲状腺癌患者的10年净生存率为88.7%。但不同特征的甲状腺癌患者生存差异显著。SEER数据库[9]的统计结果显示,不同分期和组织学类型的甲状腺癌患者生存差异显著,2012—2018年的5年总体年龄标准化相对生存率:PTC局部>99.5%,区域为99%,远处转移为74%;FTC局部>99.5%,区域98%,远处转移为67%;MTC局部>99.5%,区域92%,远处转移43%;ATC局部39%,区域11%,远处转移4%。瑞典肿瘤登记的数据[10]显示,不同性别、组织学类型、TNM分期的甲状腺癌患者的生存差异显著,1999—2018年女性甲状腺癌患者的5年相对生存率:FTC为100.0%,PTC为93.4%,MTC为89.7%,ATC为6.1%;男性甲状腺癌患者的5年相对生存率:FTC为87.2%、PTC为92.6%、MTC为84.4%,ATC为5.4%;从T分期看,T1、T2和T3期女性患者的5年相对生存率类似,分别为100.4%、101.5%和100.5%,而T4期为59.3%,M分期也是影响相对生存率的因素,M0期女性的5年相对生存率为98.2%,而M1期为41.7%。中国32个省市癌症登记的数据[11]显示,2008—2019年中国甲状腺癌患者的年龄标化5年相对生存率为92.9%。本研究数据是以医院为基础的肿瘤登记数据,与人群登记的数据存在较大差异,甲状腺癌患者的5年OS率为98.48%,10年OS率为95.81%;不同性别、组织学和分期的患者生存差异显著,ATC/PDTC和Ⅳ期患者生存较差,10年OS率分别为48.46%和62.95%。以医院为基础的登记数据分析的生存率存在一定的高估,主要是在医院内均为住院治疗的患者,有治疗方案的患者相对生存较好,而人群中存在部分无法进行治疗、生存相对更差的患者,预后更差;这也提示甲状腺癌患者尤其是预后差的部分类型患者,通过规范化治疗,有可能显著改善预后。不同分期生存的数据真实地反映了中国发达城市甲状腺癌的防治水平和预后情况。
本研究中甲状腺癌患者的男女比例为3∶8,男女性的10年OS率有显著差异(男性为93.52%,女性为96.66%,P<0.001),提示男性发病较女性少,但预后却相对较差,多项以人群为基础的研究[12-13]也发现相同的男女性生存差异。有研究[14-15]表明,男性甲状腺癌患者的复发风险更大、预后更差,男性PTC患者的复发风险是女性的1.53倍,且男性甲状腺癌发病的临床特征中,局部晚期(T3、T4期)、区域转移(N1期)及远处转移(M1期)的比例更高。另有一些研究[16-19]提示男女性在基因表达、突变谱等方面,特别是癌症相关基因(如RET、BRAF等)的突变频率上存在差异,导致男性甲状腺癌的恶性程度更高。此外,性别可能通过一些特定的基因调控路径影响肿瘤的生物学行为,女性甲状腺癌的发病率较高可能与雌激素水平高、X染色体启动子甲基化[16]、EZH2、KDM5C和IL7R基因过表达和突变[17-19]有关;而某些雄性激素(如睾酮)相关的基因可能在男性甲状腺癌的进展中起到了促进作用。动物研究[20]表明,睾酮能够促进小鼠FTC的进展,这与男性FTC更具侵袭性和预后不良相一致。男女性甲状腺癌患者的发病率和预后之间的显著差异的机制目前仍不清楚,期待通过进一步探索为甲状腺癌的治疗提供新的思路。
本研究死因分析结果显示,甲状腺癌患者最常见的死因是其他恶性肿瘤(50.88%),甲状腺癌相关死亡次之(18.63%),还有7.32%归因于CVD。死因分布与其他来自医院的研究数据一致,1994—2017年韩国三星医疗中心治疗死亡的107例PTMC患者中[21],58.9%死于其他恶性肿瘤,2.8%死于心血管疾病,仅有0.02%患者死于PTMC。另有来自SEER数据库1992—2019年的51 854例PDTC死亡病例中,最常见的死因也是恶性肿瘤(甲状腺癌除外)(29.7%)和CVD(26.3%),甲状腺癌仅占死亡病例的4.3%。死因构成与以人群为基础的数据有一些差异,韩国国民健康保险服务-国家健康筛查队列[22](2002—2013)中甲状腺癌患者最常见的死亡原因是甲状腺癌特异性死亡(32.8%),其次是其他恶性肿瘤相关死亡(31.1%)和CVD死亡(13.1%)。SEER数据库1975—2015年诊断为甲状腺癌的173 710例患者,经过101个月的中位随访,23 040例(13.3%)患者死亡,其中29.1%和21.7%分别归因于甲状腺癌和CVD[23]。虽然死因构成略有差异,但甲状腺癌患者的死因主要都是归因于甲状腺癌、CVD和其他肿瘤,因此在甲状腺癌患者中,做好诊断后的第二原发癌症风险管理和CVD风险管理尤为重要。另外,本研究发现不同组织学分型患者的死亡差异显著,PDTC/ATC患者因甲状腺癌而死亡的比例随诊断后时间的增加而不断上升,诊断10年后大部分都死于甲状腺癌,与SEER数据库2000—2018年甲状腺癌报道的PDTC/ATC人群首要死亡原因是甲状腺癌一致[24],可能的原因包括:① PDTC/ATC通常生长迅速,且具有高度的局部侵袭性,侵犯周围结构如气管、食管、喉部神经等导致器官功能障碍,如呼吸困难、吞咽困难等,一方面增加肺部疾病的易感性,另一方面气道阻塞可能导致严重缺氧和呼吸窘迫综合征,最终导致肺功能衰竭和心力衰竭;② PDTC/ATC很容易出现肺、骨骼及其他远处器官的转移,导致多脏器功能衰竭。因此对于PDTC/ATC患者,个性化的诊疗、尤其是严格的随访和监测、高危风险识别至关重要。
本研究有一定局限性。首先,本研究并非以人群为基础数据,无法计算相对生存率,不宜与以人群为基础的流行病学数据进行直接比较;其次,本研究未纳入无法进行手术或住院治疗的晚期甲状腺癌患者,尤其是一些ATC/PDTC患者,这部分患者预后更差;再次,整个随访中位时间为63个月,5年生存率的估计较为稳健,但10年的生存率估计可能存在一定偏倚及高估;最后,本研究为描述性研究,描述了不同临床或病理学特征的甲状腺癌患者的OS,并未对影响因素之间的混杂因素进行校正,因此对影响生存的因素的解释存在一定局限性,另外观察性的设计无法得出死因及相关因素之间潜在的因果关系的任何结论。
鉴于中国甲状腺癌生存及死因分析的研究较少,本研究报告了大样本(5.5万例)甲状腺癌患者长期的生存数据,并且本研究数据基于较完善的病例死亡事件随访系统,主动和被动随访相结合,数据有较高完整性和准确性。未来期望在本研究的基础上,进一步收集和挖掘数据,尤其是PDTC/ATC的相关数据,为切实提升预后差的甲状腺癌患者的生存率提供更有力的证据支持。
第一作者:
沈洁,主管医师。
通信作者:
王宇,主任医师,复旦大学附属肿瘤医院头颈外科主任;郑莹,主任医师,复旦大学附属肿瘤医院肿瘤预防部主任。
作者贡献声明:
沈洁:数据收集分析整理,文章撰写和修改;刘婉琳:数据分析构架指导,文章修改;王泽洲,牟思博,莫淼,周昌明,袁晶:数据收集,数据分析指导;王宇,郑莹,嵇庆海:课题设计,文章修改指导。
[参考文献]
[1] HAN B F, ZHENG R S, ZENG H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2] ZENG H M, CHEN W Q, ZHENG R S, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567.
[3] 周昌明, 莫 淼, 袁 晶, 等. 以医院登记为基础的20万例恶性肿瘤患者生存报告[J]. 中国癌症杂志, 2020, 30(1): 11-24.
ZHOU C M, MO M, YUAN J, et al. Report on 200 thousand cancer patients’ survival from a hospital-based cancer registry database[J]. China Oncol, 2020, 30(1): 11-24.
[4] American Joint Committee on Cancer. AJCC Cancer Staging Manual[M]. 8th Edition. Chicago: Springer, 2018.
[5] Shanghai Statistical Yearbook[EB/OL]. (2022-08-29)[2024-12-06]. https://tjj.sh.gov.cn/tjnj/rktjnj2020e.htm.
[6] DAVIES L, GILBERT WELCH H. Thyroid cancer survival in the United States: observational data from 1973 to 2005[J]. Arch Otolaryngol Head Neck Surg, 2010, 136(5): 440-444.
[7] DAL MASO L, TAVILLA A, PACINI F, et al. Survival of 86, 690 patients with thyroid cancer: a population-based study in 29 European countries from EUROCARE-5[J]. Eur J Cancer, 2017, 77: 140-152.
[8] Office for National Statistics. Cancer survival in England: adult, stage at diagnosis and childhood-patients followed up to 2018[EB/OL]. (2019-08-12)[2024-12-06]. https://www.ons.gov.uk/peoplepopulationandcommunity/healthandsocialcare/conditionsanddiseases/bulletins/cancersurvivalinengland/stag eatdiagnosisandchildhoodpatientsfollowedupto2018#10-yearpredicted-survival-estimates.
[9] American Society of Clinical Oncology (ASCO). Thyroid cancer: statistics[EB/OL]. (2024-08-23)[2024-12-06]. https://www.cancer.org/cancer/types/thyroid-cancer/detectiondiagnosis-staging/survival-rates.html.
[10] ZITRICKY F, KOSKINEN A, SUNDQUIST K, et al. Survival in thyroid cancer in Sweden from 1999 to 2018[J]. Clin Epidemiol, 2024, 16: 659-671.
[11] ZENG H M, ZHENG R S, SUN K X, et al. Cancer survival statistics in China 2019-2021: a multicenter, population-based study[J]. J Natl Cancer Cent, 2024, 4(3): 203-213.
[12] TICHANEK F, FÖRSTI A, LISKA V, et al. Early mortality critically impedes improvements in thyroid cancer survival through a half century[J]. Eur J Endocrinol, 2023, 189(3): 355-362.
[13] LI P, DING Y, LIU M Y, et al. Sex disparities in thyroid cancer: a SEER population study[J]. Gland Surg, 2021, 10(12): 3200-3210.
[14] GUO K, WANG Z Y. Risk factors influencing the recurrence of papillary thyroid carcinoma: a systematic review and metaanalysis[J]. Int J Clin Exp Pathol, 2014, 7(9): 5393-5403.
[15] KRUIJFF S, PETERSEN J F, CHEN P, et al. Patterns of structural recurrence in papillary thyroid cancer[J]. World J Surg, 2014, 38(3): 653-659.
[16] SOUSA A, FERREIRA M, OLIVEIRA C, et al. Gender differential transcriptome in gastric and thyroid cancers[J]. Front Genet, 2020, 11: 808.
[17] KIM K H, ROBERTS C W M. Targeting EZH2 in cancer[J]. Nat Med, 2016, 22(2): 128-134.
[18] TRICARICO R, NICOLAS E, HALL M J, et al. X- and Y-linked chromatin-modifying genes as regulators of sex-specific cancer incidence and prognosis[J]. Clin Cancer Res, 2020, 26(21): 5567-5578.
[19] KIM M J, CHOI S K, HONG S H, et al. Oncogenic IL7R is downregulated by histone deacetylase inhibitor in esophageal squamous cell carcinoma via modulation of acetylated FOXO1[J]. Int J Oncol, 2018, 53(1): 395-403.
[20] ZHANG L J, XIONG Y, NILUBOL N, et al. Testosterone regulates thyroid cancer progression by modifying tumor suppressor genes and tumor immunity[J]. Carcinogenesis, 2015, 36(4): 420-428.
[21] HEO J, RYU H J, PARK H, et al. Mortality rate and causes of death in papillary thyroid microcarcinoma[J]. Endocrine, 2024, 83(3): 671-680.
[22] KIM K J, JANG S, KIM K J, et al. Actual causes of death in thyroid cancer patients in Korea: a Nationwide case control cohort study[J]. Eur J Endocrinol, 2020, 182(1): 103-110.
[23] DU B B, WANG F, WU L M, et al. Cause-specific mortality after diagnosis of thyroid cancer: a large population-based study[J]. Endocrine, 2021, 72(1): 179-189.
[24] ZHANG K, WANG X Y, WEI T, et al. Comparative study between poorly differentiated thyroid cancer and anaplastic thyroid cancer: real-world pathological distribution, death attribution, and prognostic factor estimation[J]. Front Endocrinol (Lausanne), 2024, 15: 1347362.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)