首页 > 医疗资讯/ 正文

在医学研究领域,转化研究的核心目标是将基础研究成果转化为有效的临床治疗手段,评估各种治疗和干预措施的疗效与效果。对于癌症治疗而言,探寻能够降低癌症复发风险的围手术期干预措施至关重要,因为癌症转移是癌症患者死亡的主要原因之一,也是全球范围内的第二大死因。但实际上经常会发现大量临床前研究表明有益的措施在强有力的临床试验中却显示无益,两者之间为何会出现这种脱节?答案很复杂,但可能是由于临床前研究受机械论驱动,以还原论模型为基础,基础科学家和临床研究人员都低估了各种临床前模型的局限性。2024年3月, Cata Juan P等人在《Anesthesiology》杂志上发表一篇题为《Lost in Translation: Failure of Preclinical Studies to Accurately Predict the Effect of Regional Analgesia on Cancer Recurrence》的综述,聚焦局部镇痛与癌症复发的关系,详细探讨了临床前研究和临床试验结果存在差异的原因,并探讨从这种脱节中可以学到什么。
局部镇痛与癌症复发
大量临床前研究表明,局部镇痛可能通过减少手术应激、避免挥发性麻醉剂使用和降低阿片类药物需求等机制,降低癌症复发风险。基于这些临床前证据,2007年,一项大型临床试验启动,旨在研究椎旁镇痛对乳腺癌复发的影响。然而,该试验以及另外三项近期的随机试验(共纳入4770名患者)表明,局部镇痛并不能改善乳腺癌、肺癌和腹部癌症患者的复发或生存。
区域阻滞经常被用于癌症患者以提供镇痛并减少对阿片类药物的需求。区域麻醉的一个更为重要的潜在好处是,它可能会减少在潜在治愈性癌症手术后的癌症复发。三大机制可能对此有所贡献:(1) 避免使用挥发性麻醉剂;(2) 减少应激反应;(3) 减少对阿片类药物的需求(图1)。区域镇痛减少癌症复发的假设基于广泛的临床前体外和动物体内研究。
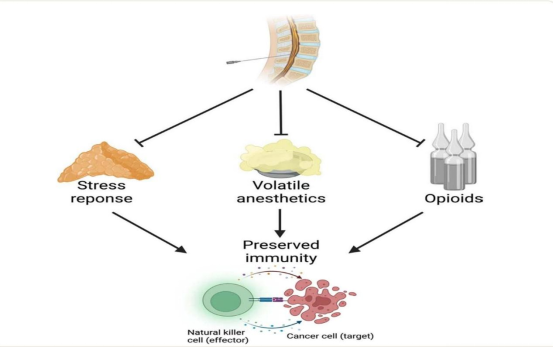
图1:区域麻醉可能减少癌症复发的假设机制。
主要临床试验结果
为了全面评估局部镇痛对癌症复发的影响,研究人员进行了系统的文献搜索。由专业医学图书馆员代表进行检索,查询了Medline(Ovid)、Embase(Ovid)和PubMed数据库,时间跨度从1970年至2023年9月17日。检索词涵盖了局部麻醉、癌症、手术结果和全身麻醉等相关的词汇术语。经过筛选,最终确定了469条独特记录,并将结果限制为以癌症复发为主要结局的英文随机对照试验,排除了随机对照试验的二次分析出版物,最终只有4篇符合纳入标准。作者简要回顾了有关区域镇痛和癌症复发的这四项可靠试验及其局限性。
第一项试验将2132名接受潜在治愈性乳腺癌手术的女性随机分配到仅使用挥发性全身麻醉与T1至T5单次注射布比卡因椎旁阻滞加异丙酚镇静和必要时使用挥发性麻醉。该试验始于2007年,分配到椎旁阻滞组的女性使用的异丙酚量约为4.5倍,且只有17%接受了任何挥发性麻醉。中位随访时间为36个月,基线特征在如此大规模的试验中预期是平衡的。局部或转移性癌症复发的调整风险比(椎旁vs全身麻醉)为0.97(95% CI,0.74 to 1.28) (P = 0.84),各亚组的结果相似。该试验的主要局限性包括:两组患者的疼痛评分和阿片类药物使用量都相对较低,而且手术规模相对较小,与大型手术相比,手术压力可能要小得多。
第二项试验将526名女性随机分配到接受罗哌卡因的II型胸神经阻滞组(加上全身麻醉)或仅全身麻醉组。两组的脑电双频指数、丙泊酚使用量和瑞芬太尼消耗量相似。基于85个结果事件,无复发生存的调整风险比为0.9(95% CI,0.76 to 1.32)。然而,该试验未报告术后阿片类药物的使用情况,因此无法确定阻滞的有效性,也不清楚是否使用了挥发性麻醉剂以及使用剂量。
第三项试验将1712名非心脏胸腹部癌症(主要是结直肠癌)患者随机分配到单独全身麻醉组或全身麻醉联合术后维持的胸段硬膜外镇痛组。手术持续时间平均接近4 h ,基线特征平衡良好。尽管单独全身麻醉组患者主要使用吗啡,而硬膜外镇痛组主要使用硬膜外舒芬太尼,但硬膜外镇痛仅略微减少了术后阿片类药物的等效使用。基于790个结局事件(P = 0.69),无复发生存的调整风险比为0.97(95% CI, 0.84 to 1.12)。同样,各亚组的结果相似。试验的主要局限性包括挥发性麻醉剂剂量细节缺失以及术后阿片类药物使用量相似。
第四项关于区域镇痛与癌症复发的主要试验将400名接受肺癌切除手术的患者随机分为仅使用全身麻醉和全身麻醉联合术后维持的胸段硬膜外镇痛。在中位随访32个月时,基于102个结果事件,全身联合硬膜外麻醉与仅全身麻醉的调整后风险比为0.90 (95% CI,0.60 to 1.35) (P = 0.61),各亚组的结果相似。仅使用全身麻醉的患者中位使用了42 mg静脉注射吗啡,而使用全身联合硬膜外麻醉的患者中位使用了0 mg。该试验的局限性是在单一中心进行,且置信区间较宽。
四项试验中有三项报告的置信区间并未排除区域镇痛可能带来的显著益处或危害。然而,所有的点估计值均未表明临床上有意义的益处,这可能表明结果统计效能不足而非真正中性。合并的调整后风险比为0.95,95% CI较窄(0.85 to 1.06;(P=0.40);图2)。这些试验包括了腹部肿瘤、乳腺癌和肺癌,这是三种最常见的非皮肤癌症。还有报告称,乳腺癌肿瘤周围浸润局部麻醉可减少局部复发和转移,这可能是通过一种新的局部机制实现的。
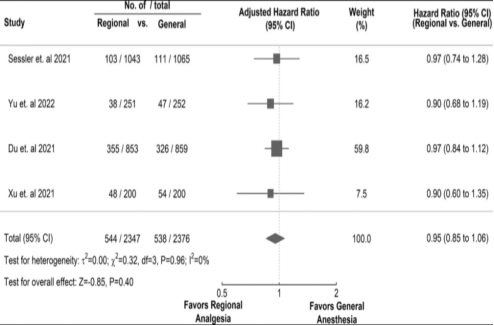
图2:比较区域麻醉与单纯全身麻醉对癌症复发的无癌生存分析的调整风险比的森林图。
综合来看,四项在常见癌症患者中进行的可靠试验(总计N = 4770)表明,区域阻滞对癌症复发的保护作用微乎其微。这些结果与大量体外和动物研究的结果相悖,后者认为区域镇痛应能减少潜在治愈性癌症手术后的癌症复发。那为什么临床前结果与临床结果之间会出现如此大的脱节呢?为此作者重新回顾了临床前研究,并讨论为什么实验室和动物研究可能具有误导性,以及对其结果的误解如何误导临床研究人员去探讨区域麻醉对癌症复发的影响。
临床前研究证据
免疫细胞毒性试验
在我们每个人体内,每天都有数十亿个细胞发生突变和畸变,这些突变和畸变可能导致癌细胞转移。幸运的是,我们的免疫系统时刻监控并清除可能癌变的细胞,自然杀伤细胞(NK细胞)在其中发挥着关键作用,这是一种专门类型的T细胞,预先编程以识别和消除癌细胞。NK细胞的功能在癌症患者手术期间和之后可能尤为重要,它能够识别并清除进入血液循环的癌细胞。而癌症手术会使人类自然杀伤细胞的数量和功能减少30%至40%。因此,挥发性麻醉剂、阿片类药物和手术应激对NK细胞功能的影响至关重要。
肿瘤细胞体外杀伤试验已被广泛接受,近半个世纪以来一直被用于研究和开发免疫疗法。然而,NK细胞活性试验的数据存在缺陷,实验结果的可重复性较差。体外杀伤试验已被用于评估手术应激反应介质、阿片类药物和麻醉剂对NK细胞数量和功能的影响。例如,自20世纪70年代中期以来,研究人员报告称,体外暴露于氟烷和一氧化二氮等挥发性麻醉剂后,人类NK细胞的细胞毒性活性会受到剂量依赖性和可逆性抑制。其他研究使用暴露于氟烷或异氟醚的啮齿动物离体NK细胞也得出了类似的结果。Bar-Yosef 等人和 Wada 等人在体外研究了布比卡因脊髓麻醉对手术大鼠NK细胞功能的影响,并报告称脊髓麻醉可逆转手术和挥发性麻醉剂对NK细胞活性和数量的抑制作用。这些研究表明,区域麻醉可能保护围手术期NK细胞的功能。
阿片类药物也会抑制人类和啮齿动物的NK细胞活性。然而,这种效果是类型、剂量和时间依赖性的。例如,高剂量的吗啡会抑制NK细胞的功能,而曲马多却会改善其功能。氢吗啡酮和羟考酮对NK细胞的细胞毒性活性没有显著影响。因此,阿片类药物对NK细胞的影响似乎是高度可变的,幅度不大且持续时间短暂。
手术应激的特征是释放儿茶酚胺和其他应激激素,这些激素可能损害NK细胞功能。例如,使用大鼠体外NK细胞的研究报告称,手术应激抑制了NK细胞对癌细胞的杀伤,这种效应可以通过β阻滞剂逆转。然而,使用人类体外NK细胞进行的手术和非手术研究表明,硬膜外或星状神经节阻滞仅略微改善NK细胞功能,并且这种效果与全身儿茶酚胺浓度的变化无关。因此,只有有限的证据表明手术应激显著损害NK细胞功能,或者神经轴与区域阻滞逆转了这种效应。
然而,这些体外细胞毒性测定的结果可能存在一定的误导性。首先,使用动物和人类NK细胞的体外实验结果之间存在明显差异,甚至在不同动物品系之间也存在差异。例如,MADB106 乳腺癌细胞最初是从大鼠的乳腺腺癌中分离出来的。此外,EL4 T细胞淋巴瘤细胞(小鼠来源)被用于研究脊髓麻醉对免疫正常小鼠的影响。然而,小鼠NK细胞在静息条件下不一定能复制人类NK细胞的功能或活性。此外,从外周血单核细胞中分离的NK细胞活性的批次间差异也会影响对结果的解释。其次,在手术组织损伤的情况下,脊髓或硬膜外麻醉对人类NK细胞功能的保护作用通常被组织损伤的免疫抑制作用所掩盖。第三,肿瘤微环境中富含免疫介质(如前列腺素、白细胞介素和儿茶酚胺),这些介质调节NK细胞的活性,但在细胞操作过程中或以固定浓度使用时会丢失。第四,体外杀伤试验使用永生癌细胞系作为NK细胞的靶标。而永生癌细胞系在长期培养过程中会产生异质性和基因组多样性,导致对免疫介质和抗癌治疗的敏感性或抗性发生变化,从而影响实验结果的准确性。突变可解释为何即使实验得到充分控制,细胞系内的治疗效果仍存在差异。
总之,细胞毒性实验总体上表现良好,有助于我们了解挥发性麻醉剂、阿片类药物和脊髓麻醉如何影响NK细胞的功能。然而,由于杀伤活性的差异一般不大,这些实验的结果往往被过度解读,或者由于细胞毒性杀伤实验固有的重要动力学方面(即起效、峰值效应或效应持续时间)以及与物种有关的差异而被误读。未来研究围手术期药物干预对啮齿类动物NK细胞介导的肿瘤杀伤作用的影响时,应采用更新、更全面的方法进行评估,如脱颗粒和成熟试验以及使用全外周血单核细胞或纯化NK细胞的三维球形模型。三维模型可以更好地模拟体内肿瘤结构。如果试验成功,对所提出干预措施的测试可以推进到患者来源的异种移植或同基因小鼠模型。
肿瘤细胞行为实验
体外试验是研究转移机制的常规方法。研究癌细胞行为(如增殖、迁移和侵袭)的体外试验具有成本相对低廉、操作简便和可重复性高等优点。不过,对其结果的解释仍需慎重考虑。
1968年,Fink等人发现氟烷对肉瘤细胞有体外作用。从那时起到21世纪初,各种研究报告称挥发性麻醉剂对迁移和侵袭试验没有实质性影响。然而,最近使用现代挥发性麻醉剂(包括七氟醚和地氟醚)进行的研究表明,体外对细胞行为的影响可能促进转移。体外研究还表明,阿片类药物可通过各种肺癌或乳腺癌细胞系中的μ-阿片受体促进肿瘤增殖、侵袭、迁移和血管生成。体外研究还表明,应激激素在转移过程中起关键作用。Sood等人和Yang等人的研究表明,肾上腺素和去甲肾上腺素能显著增加卵巢癌和鼻咽癌细胞株的侵袭。因此,肿瘤细胞行为实验有大量证据表明,减少挥发性麻醉剂的使用、减少阿片类药物的用量、降低手术压力可能会减少癌症复发。
然而,由于各种原因,细胞行为测定法误导了临床研究人员。首先,大多数研究使用的是在没有结构成分(如淋巴管或胶原结构)的二维培养物中繁殖的永生癌细胞系。现在人们已经充分认识到,体外实验与患者体内肿瘤的结构和微环境并不相似。因此,体外培养的恶性细胞系在表型、癌细胞组成和治疗反应方面复制人类癌症的能力很差。 其次,关于癌细胞系中受体构象变化或异构体类型的信息很少。例如,μ-阿片受体有超过10种异构体,但哪些异构体存在于各种癌细胞系中仍未知,人类标本中肿瘤异质性的程度也未知。第三,体外实验通常忽略了影响反应的变量,包括播种细胞数、高药物剂量、长培养时间、培养基类型以及培养后细胞上清液的清除。例如,一项研究报告称,七氟醚可促进体外乳腺癌细胞的增殖和侵袭性细胞行为,但该研究是基于将挥发性麻醉剂溶解在培养基中,而不是使用具有临床意义浓度的密闭室。
总之,人们普遍认为,癌细胞必须与其他细胞相互作用,降解细胞外基质,并进行增殖,然后才能建立茁壮的转移瘤。许多研究报告称,麻醉剂、阿片类药物和手术应激在体外促进了这些机制。然而,增殖、迁移和侵袭试验并不能很好地预测麻醉剂、阿片类药物和手术应激的长期后果。这导致研究人员基于高度还原论的癌症研究方法,高估了体外实验结果的普遍性。
在进行关键的体外癌症-麻醉研究时,人们对经典体外模型的局限性认识不足。未来的体外研究应考虑更强大的模型,包括三维模型,这些模型可以更好地预测体内癌症的增殖、迁移和侵袭。如果研究人员能更好地说明他们所使用模型的局限性以及研究结果在多大程度上可能(或不可能)应用于临床,也会有所帮助。同样,临床研究人员在解释基础科学结果时也需要更加细致入微,并认识到所有体外模型都是抽象的,有时甚至无法为试验设计提供指导。
动物研究
动物模型是体外结果与临床试验之间的桥梁。临床前动物研究的基本假设是,研究结果将在合理程度上预测人体反应。因此,动物模型被用来研究区域麻醉对术后转移过程的影响。例如,两项研究表明,在转移性乳腺癌和纤维肉瘤的大鼠和小鼠模型中,使用氟烷进行手术会明显增加肺部肿瘤的存留。同样,加入布比卡因的鞘内麻醉也明显减弱了手术对转移的促进作用(图3)。显而易见的问题是,为什么这些及相关的动物研究未能转化为人类研究。
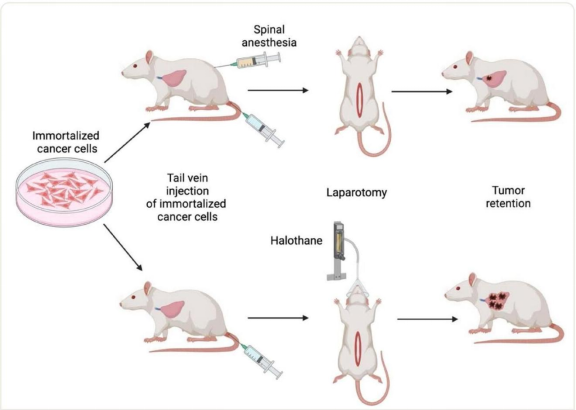
图3:评估区域麻醉对癌症复发影响的啮齿动物模型示意图。
转移性小鼠和大鼠模型有两大类。在原位模型中,转移细胞来源于原位生长的肿瘤,随后肿瘤细胞迁移到转移部位。在播散模型中,尾静脉注射肿瘤细胞可促进肺、骨髓或脑转移。许多调查麻醉剂、阿片类药物或应激影响的研究都使用了后一种模型,即通过尾静脉注射永生化癌细胞(MADB106和EL4 T细胞)。因此,高转移性细胞(如 MADB106)通常用于获得转移形成的疗效。虽然这种产生远处肺转移的方法已被广泛接受,但它可能只能部分模拟人类的转移形成,因为:(1)它没有遵循转移过程的早期生物步骤;(2)将大量肿瘤细胞注入循环系统并不是术后转移性疾病的最常见机制;(3)肿瘤在动物模型中的生长速度快于人类。可以说,与尾静脉接种癌细胞系相比,原位和致癌物质诱导的自发肿瘤模型被认为是更好的临床癌症模型,具有更强的外部有效性。这些模型的主要优势是更确切模仿早期转移步骤。然而,在设计区域麻醉与癌症的主要试验时,还没有来自原位和致癌物诱导的自发肿瘤模型的实验数据,而且这些数据至今仍然缺乏。
在动物中,手术后疼痛本身可能会促进转移过程。相反,强烈的痛觉阻滞会减少转移。例如,研究报告显示,鞘内布比卡因深度阻滞的啮齿类动物的转移负荷低于没有深度阻滞的啮齿类动物。同样,接受鞘内吗啡的动物转移负荷更高。相反,给予全身吗啡的动物肿瘤负荷减少。这些研究表明,需要强有力的疼痛控制来减少癌症进展。区域阻滞通常能很好地缓解疼痛,但也许不足以影响转移。此外,在一些试验中,参照组的疼痛程度并不严重或未报告。
循环肿瘤细胞在癌症患者中很常见,并且是转移的种子。大多数循环中的癌细胞会被NK细胞清除,但任何残留的癌细胞都可能成为转移灶(经过许多步骤,每个步骤都可以防止癌症进展)。动物实验报告显示,使用布比卡因进行脊髓麻醉可以防止手术对体内NK细胞活性的抑制作用,而氟烷则会抑制NK细胞在手术中的功能。最近来自随机试验和荟萃分析的证据表明,NK细胞的数量和功能与循环肿瘤细胞的数量并不相关。因此,在体外细胞毒性试验中观察到的有区域阻滞和无区域阻滞动物之间的“显著 ”差异,可能与基于循环肿瘤细胞分析的具有临床意义的免疫保护并不相符。
大多数动物研究仅评估了一种或两种药物(即挥发性麻醉剂或阿片类药物)与脊髓麻醉联合使用或单独使用脊髓麻醉的效果。这种实验设计背后的原理是为了获得一种机理方法,而不受混杂或混淆因素的影响。然而,在手术期间和手术后通常会给予多种药物,包括抗生素、肌肉松弛剂和类固醇。许多此类药物直接影响NK细胞的功能,因此可能减弱了区域麻醉对细胞体外杀伤活性的影响。此外,动物研究高估了区域麻醉对癌症复发的影响约30%或更多,这与其他领域已发表的数据一致。
另外,动物研究往往忽略了正式的随机化和研究者的盲法,从而影响了内部有效性,这可能与缺乏动物试验的最佳实践标准有关。样本量往往不合理、不充分,统计分析有时也不成熟。对271篇有关啮齿动物和非人灵长类动物研究的文章进行调查后发现,87%的文章未报告随机治疗分配,86%的文章未报告研究者盲法。
假设驱动的临床试验通常旨在控制与主要结果相关的I型和II型误差。然而,实验室研究通常使用6至12只动物/组,并不合理地假设治疗效果大,这种做法缺乏科学和统计学依据。与临床研究不同,基础科学研究几乎没有既定的标准。很多时候,动物的数量是任意决定的,物种的选择基于方便性和成本,缺乏正式的随机化和盲法。此外,动物研究往往止步于啮齿类动物,而没有在更大和更相关的物种中进行后续研究。与此相反,在对患者进行有趣的观察分析之后,通常会进行小型临床试验,并在适当的时候进行大型、稳健的试验。
总之,临床试验基于动物实验数据,表明区域阻滞、避免使用挥发性麻醉剂和减少阿片类药物用量可能会减少术后癌症复发。然而,癌症动物模型似乎并不能预测人类的反应,这或许可以解释为什么临床试验人员被误导,相信区域麻醉可以减少癌症复发。在未来的研究中应考虑更好的实验范例,如原位和致癌物质诱导的自发性肿瘤模型。例如,Doornebal等人使用了一种乳腺癌小鼠原位模型,比较了乳房切除术后吗啡(与生理盐水)的影响。在该模型中,吗啡并未促进淋巴或远处转移的形成,这与乳腺癌的临床研究一致。最后,动物实验研究应使用足够的样本量和严谨的统计方法,采用类似于临床研究常规使用的设计,以免出现错误。
临床前研究与临床试验差异的启示
临床前研究涉及细胞、组织、动物和其他生物材料的实验,旨在更好地了解疾病的生物机制,开发潜在疗法。研究学科包括分子生物学、药理学、毒理学和动物行为科学。临床前研究是麻醉学重大发现和进步的基础,包括局麻药和镇静药(如世界卫生组织宣布为 “基本药物 ”的异丙酚)的作用机制。
转化科学是指从基础科学观察到治疗进展的知识转化过程。这一过程旨在选择最有可能在人体试验中取得成功的基础发现。几十年来,人类癌症实验模型一直被用于研究肿瘤生物学和评估治疗药物的疗效。然而,癌症是一种高度复杂的疾病,其病程和对治疗的反应各不相同。因此,实验模型只能大致复制人类癌症进展或扩散的条件。
许多临床前研究表明,区域镇痛可能会降低潜在治愈性手术后癌症复发的风险,但实际不会。相关体外研究的局限性包括:使用已建立的细胞系而非源自患者的癌细胞、肿瘤微环境的复制能力差、缺乏三维肿瘤组织和细胞外基质,以及药物浓度过高和持续时间过长。动物模型是基于还原论的方法来研究人类肿瘤发生和转移的过程,所使用的肿瘤基因组构成与自然发生的肿瘤不同。此外,一些动物模型如尾静脉注射癌细胞,复制自然肿瘤的效果很差。
虽然我们现在知道临床前研究中使用的许多癌症模型都有缺陷,但它们往往是当时最好的模型,而且这些研究一般都进行得很好。然而,体外研究和动物研究的多种局限性似乎促成了区域镇痛可预防潜在治愈性癌症手术后癌症复发的理论(显然是不正确的)。
讨论与小结
临床试验的价值与受其研究结果影响的人数及其对决策的影响成正比。癌症转移是癌症患者的主要死因,因此,研究围手术期的干预措施是否可能减缓癌症复发显然非常重要。
转化研究是一个反复循环的过程,包括设计可靠的实验研究、正确解释研究结果,以及利用由此获得的理解来设计临床试验,为改善临床实践提供有力的因果信息。在区域麻醉与癌症复发的案例中,临床前研究与临床试验之间的不一致显然至少部分是由于使用了我们现在知道是次优的模型,尽管这些模型在当时已被广泛接受。因此,基础科学家高估了体外和体内实验模型的可靠性,临床研究人员同样错误地估计了临床前证据的可靠性。结果,四项大型试验耗费了大量人力物力,但没有一项试验支持临床前证据,即区域镇痛可减少癌症复发。
当然,重点在于临床前研究与临床试验之间的脱节是否可以避免。这个问题没有简单的答案。基础科学方法的改进日新月异,对以往方法缺陷的认识也是如此。相比之下,组织并进行一系列从不同角度探索理论的临床试验往往需要十年或更长时间。因此,等临床试验完成时,其所基于的基础科学依据至少在某种程度上已经过时。然而,临床前科学的一个主要目的就是为临床试验提供指导,这是迈向合理临床应用的第一步。临床前证据结果的质量取决于规划和实施,即使这可能涉及在高等动物物种中进行实验。所以要求基础科学家助力这一过渡是合理的,他们可能更有能力判断哪些研究结果有可能转化应用。
目前并不存在为临床试验设定优先级,也没有一个正式的流程来让基础科学家指导临床研究人员。一个指导选题的多学科流程可能会促成更好的试验设计。重要的是,指导小组应跨越多个领域,至少在一个临床专科领域内如此。这一过程会迫使基础科学家向其同事论证自己建议的优势,而这些同事大概有能力评判各种提议的价值。某种强制排序的过程将有助于确定在众多研究领域中哪些领域有可能带来临床益处。然后,临床研究人员可以专注于优先级最高的选项,并考虑他们所关注的问题,包括面临风险的人数、可能的治疗效果、患者的可及性、监管问题以及试验设计中的许多其他实际考量。如果运作良好,这样一个多学科流程将指导试验课题的选择,其中一些课题将有效地推动医疗水平的进步。
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)