首页 > 医疗资讯/ 正文
代谢重编程
代谢重编程是癌症进化的一个标志,其使细胞能够获得独特的代谢和生物能量特征,从而支持快速增殖。这种重编程的一个关键特征是糖酵解通量的增加,这不仅维持了肿瘤的生长,还损害了免疫细胞功能,创造了免疫抑制性的肿瘤微环境(TMEs)。鉴于肿瘤代谢与免疫景观之间的强相关性,最近的研究越来越关注通过靶向代谢途径来对抗免疫抵抗并增强抗癌免疫反应。
具有高糖酵解活性的癌细胞难以经历完全的免疫原性细胞死亡(ICD),而ICD正是增强免疫反应的关键机制。研究发现,化疗诱导的糖酵解酶己糖激酶2(Hk2)的下调可增加线粒体膜的通透性并促进了ICD。此外,抑制葡萄糖转运蛋白1也可减少糖酵解乳酸的产生,导致免疫抑制性肿瘤相关巨噬细胞(TAMs)和调节性T细胞(Tregs)的减少,同时增加TMEs内的效应T细胞,特别是在与程序性死亡-1/程序性死亡配体-1(PD-1/PD-L1)抑制剂联合使用时。这些发现表明,糖酵解抑制与增强ICD、逆转免疫抑制和加强T细胞介导的免疫反应有关。因此,深入研究糖酵解干扰如何加强抗癌免疫反应对于临床治疗至关重要。
新型聚氨基酸纳米制剂
在此,中国科学院长春应用化学研究所陈学思研究员和丁建勋研究员等人开发了一种靶向葡萄糖代谢的聚氨基酸纳米制剂——奥沙利铂(IV)-阿司匹林前药(NP/OXA-ASP2),通过抑制肿瘤糖酵解来改善化学免疫治疗。这种聚氨基酸纳米颗粒在还原条件下表现出选择性释放行为,可在36小时内释放90.0%的OXA-ASP2。此外,超过80%的前药在12小时内转化为OXA和ASP,促进线粒体损伤和糖酵解抑制,从而增强OXA诱导的免疫原性细胞死亡。同时,抑制糖酵解通量减少了乳酸泄漏,缓解了免疫抑制性TMEs。这些机制共同作用增强了化学免疫治疗的疗效。与OXA加ASP的制剂相比,NP/OXA-ASP2表现出更优越的性能:肿瘤部位的乳酸水平降低了25.4%,细胞毒性T淋巴细胞的比例增加了1.53倍,调节性T细胞的比例减少了2.20倍,肿瘤抑制率提高了1.39倍。这些发现表明,NP/OXA-ASP2是一个将肿瘤代谢调控与免疫调节相结合的有前景的平台,并具有推动临床化学免疫治疗发展的巨大潜力。相关工作以“Glucose Metabolism-Targeted Poly(amino acid) Nanoformulation of Oxaliplatin(IV)-Aspirin Prodrug for Enhanced Chemo-Immunotherapy”为题发表在Advanced Materials。

【文章要点】
一、NP/OXA-ASP2的制备表征
目前仍迫切需要开发能够有效整合糖酵解抑制、化疗和免疫治疗,同时确保精确时空药物递送的平台。奥沙利铂(OXA)作为一种铂(Pt)基药物,显示出激活免疫原性细胞死亡(ICD)并桥接化疗与免疫治疗的显著潜力。通过将生物活性物质整合到二羟基奥沙利铂(IV)(OXA(OH)2)的轴向配体中,有可能开发一种化学方法,解决药物分布不一致的挑战,并协同靶向葡萄糖代谢与化学免疫治疗。为此,如图1所示,研究人员开发了一种靶向葡萄糖代谢的聚氨基酸纳米制剂——奥沙利铂(IV)-阿司匹林前药(NP/OXA-ASP2),通过抑制肿瘤糖酵解来增强化学免疫治疗的疗效。阿司匹林(ASP)是一种众所周知的非甾体抗炎药,同时具有多种对癌症治疗有益的功能,包括抑制血小板活化、细胞能量代谢途径以及肿瘤生长相关的激酶,如PI3激酶和蛋白激酶B。而OXA-ASP2被合成并封装在聚氨基酸纳米颗粒(PAA NP)中,以克服前药的疏水性。
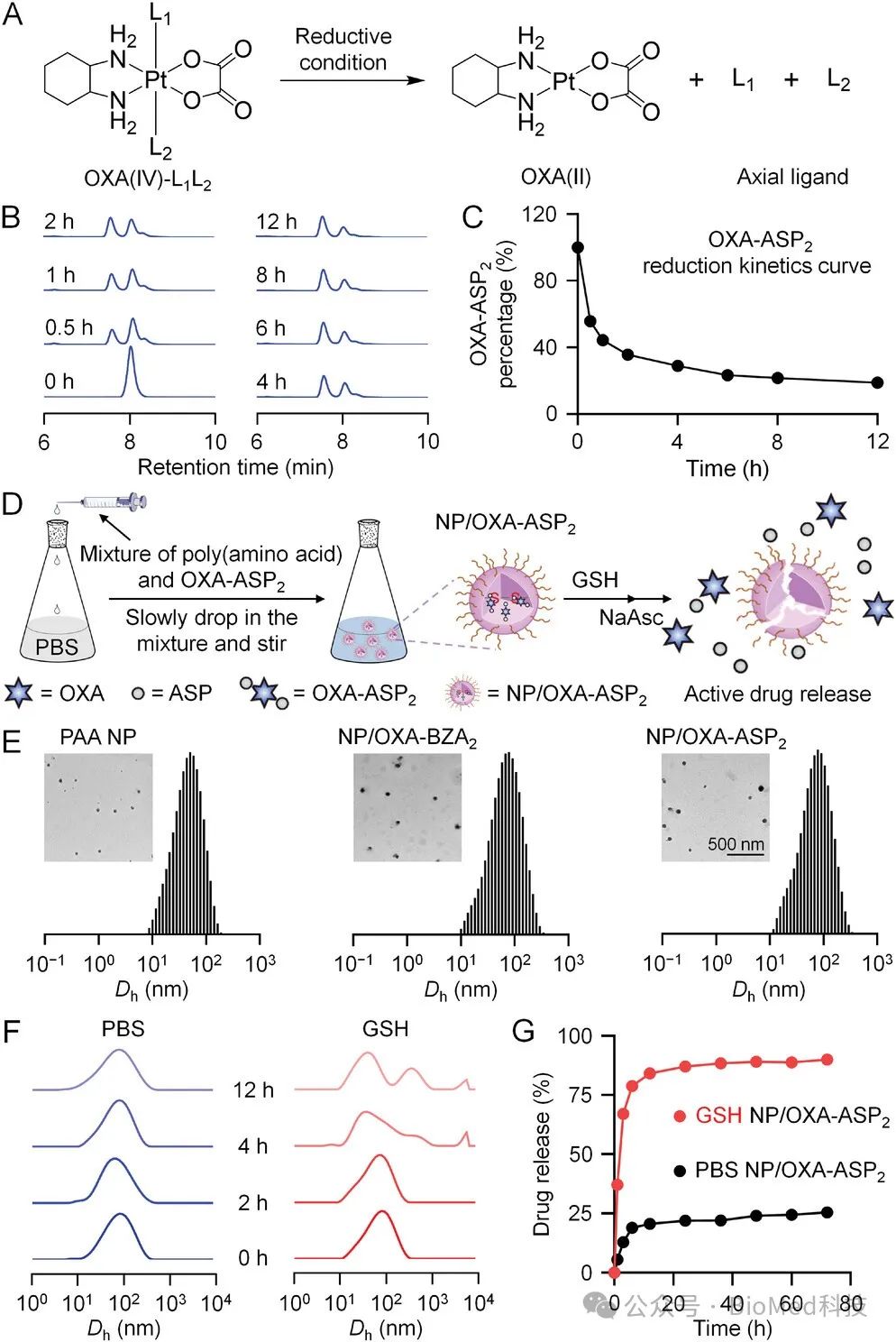
图1 OXA(IV)纳米制剂的物化性质
二、性能研究
这种纳米制剂具有以下优势:a) PAA NP和OXA-ASP2均对肿瘤的还原性微环境有响应,提高了NP/OXA-ASP2的靶向能力和生物安全性,并减少了还原性物质的水平;b) OXA-ASP2确保了OXA和ASP在肿瘤细胞内的精确时空递送,并在ICD激活和糖酵解抑制方面比OXA加ASP的组合具有更强的效果;c) 增强的ICD促进了免疫细胞对肿瘤抗原的识别,而降低的肿瘤糖酵解通量限制了乳酸泄漏,增加了细胞毒性T淋巴细胞(CTL)的浸润和活性,并减少了免疫抑制细胞(如Tregs和髓源性抑制细胞(MDSCs))的丰度。最终,免疫抑制性肿瘤微环境被逆转(图2)。
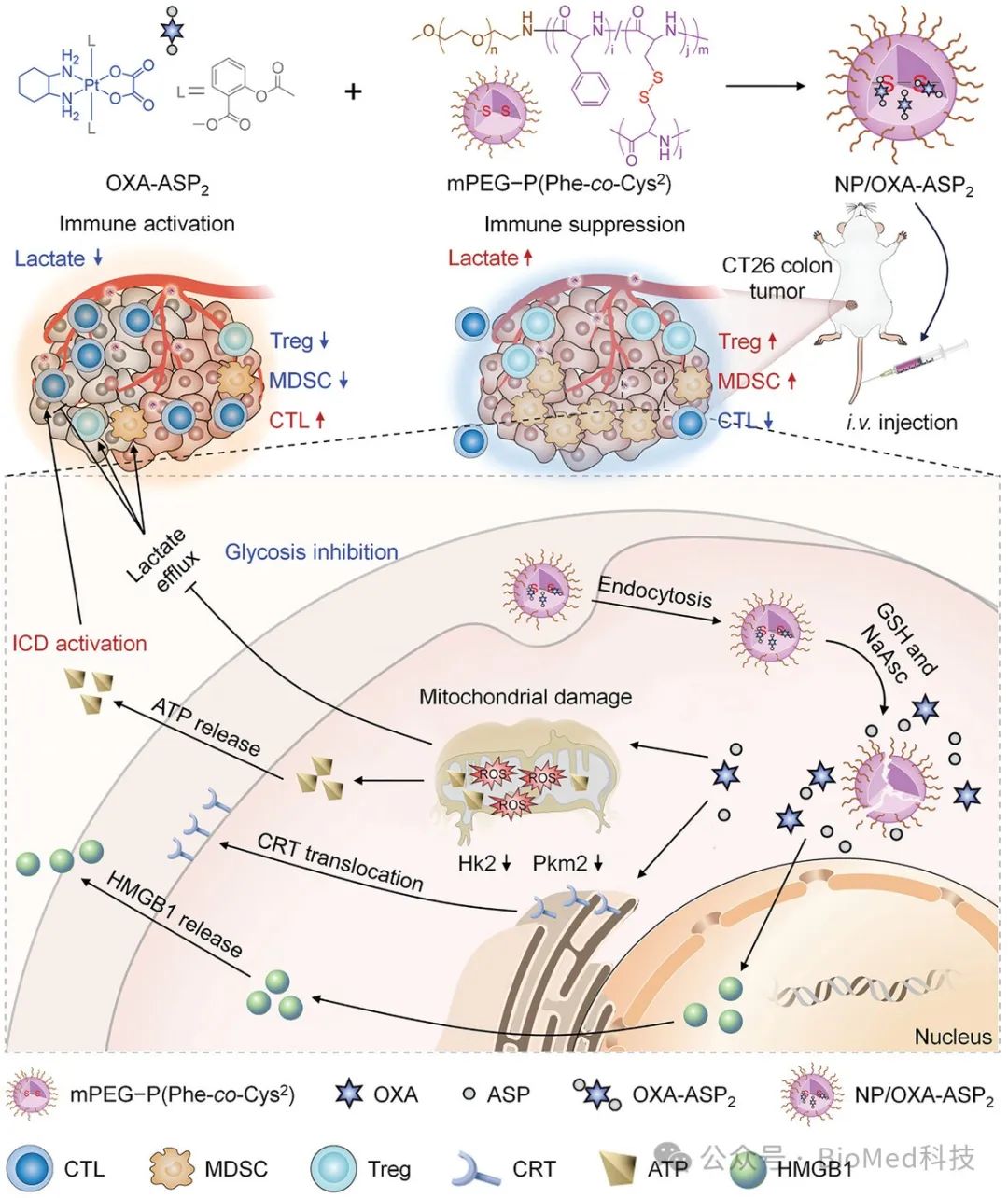
图2 NP/OXA-ASP2通过增强糖酵解抑制和ICD激活抑制CT26结肠癌的机制
三、抗癌效力
动物抗癌实验显示,NP/OXA-ASP2有效抑制了肿瘤糖酵解,将乳酸外流减少了27.6%,诱导线粒体损伤并促进ICD,最终使肿瘤组织中的CD8+ T细胞比例增加了153%,同时与OXA加ASP组相比,髓源性抑制细胞(MDSCs)和Tregs的比例分别减少了47.2%和54.5%。这些机制使得肿瘤抑制率比单独使用OXA提高了1.48倍(图3)。
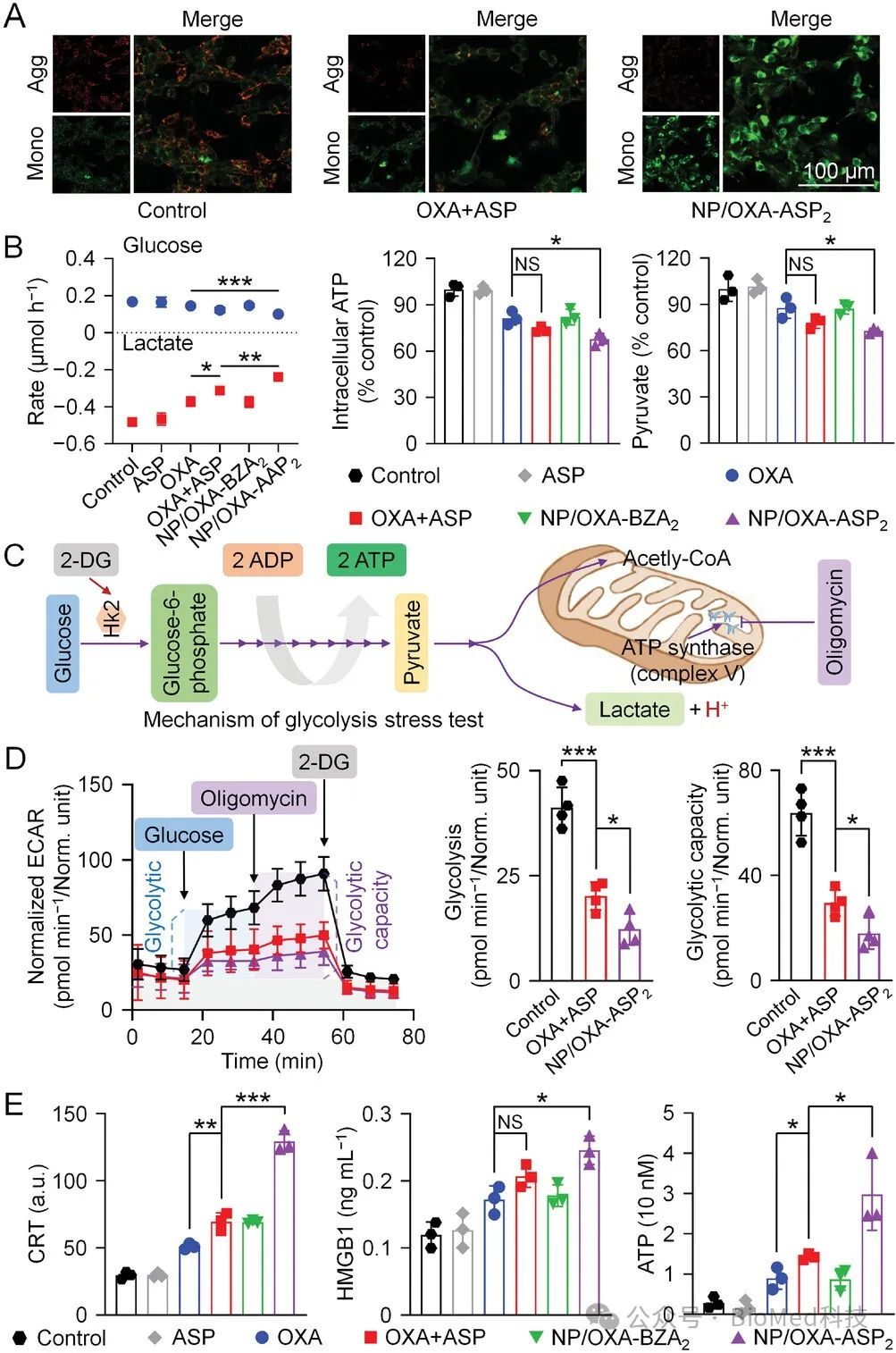
图3 制剂对糖酵解抑制和ICD活化的影响
【结论与展望】
OXA(IV)纳米制剂为将癌细胞代谢调控与化学免疫治疗相结合提供了一个多功能平台。药物在肿瘤内以固定比例同步释放,最大限度地减少了体外和体内药物分布的差异。此外,各种治疗剂可以通过常见的化学反应轻松与OXA(OH)2结合,从而可在特定反应条件下精确调整药物比例。由此制备的OXA(IV)纳米制剂具有将化学免疫治疗与其他治疗模式(如光热或光动力治疗)以及其他代谢途径(包括腺苷或氨基酸代谢)相结合的潜力。OXA(OH)2的双反应位点还使其成为创建具有自组装特性的聚合物的理想构建模块,从而简化了纳米制剂的组成。因此,OXA(IV)纳米制剂具有增强化学免疫治疗抗癌疗效的潜力,并有助于探索其与其他临床疗法联合使用时的协同机制。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202419033
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)