首页 > 医疗资讯/ 正文
2024年12月23日,江南大学孙茂忠、瞿爱华共同通讯在 Advanced Materials 在线发表题为 “Renal Clearable Chiral Manganese Oxide Supraparticles for In Vivo Detection of Metalloproteinase-9 in Early Cancer Diagnosis” 的研究论文。该研究制备了多肽TGGGPLGVARGKGGC诱导的手性二氧化锰超颗粒(MnO2 SPs),用于体外和体内基质金属蛋白酶-9(MMP-9)的定量检测。
结果表明,L型二氧化锰超颗粒(L-MnO2 SPs)对癌细胞膜受体CD47(分化簇,整合素相关蛋白)的亲和力是D型二氧化锰超颗粒(D-MnO2 SPs)的两倍,经精氨酸-甘氨酸-天冬氨酸(iRGD)配体表面修饰后积聚在肿瘤部位,与MMP-9特异性反应,分解成超小纳米颗粒(NPs),并有效地进行肾清除。此外,L-MnO2促进了小鼠肿瘤异种移植物中MMP-9的定量。2小时内圆二色谱(CD)和磁共振成像(MRI)观察到MMP-9浓度与CD和MRI强度之间存在强线性关系,范围为0.01 ng/mL-1至10ng/mL-1。CD和MRI的相应检测限(LOD)分别为0.0054 ng/mL-1和0.0062 ng/mL-1。该研究为开发用于癌症早期诊断的手性高级生物传感器提供了一种新方法。

早期诊断对于恶性肿瘤初始阶段的有效治疗,降低与癌症相关的死亡率至关重要。然而,有限的肿瘤生物标志物和分泌型生物标志物特异性的缺乏,给早期检测带来了障碍。蛋白酶活性作为癌症诊断的生物标志物,是解决灵敏度和特异性限制的替代方法。基质金属蛋白酶-9(MMP-9)在乳腺癌、结肠癌、胃癌和肺癌等恶性肿瘤中显著升高,已成为抗肿瘤药物的重要靶点。肿瘤部位MMP-9的表达与肿瘤的发生发展密切相关。
手性纳米材料在生物成像、手性识别、生物医学、催化、光学器件、手性传感、疾病诊断和治疗等方面应用潜力巨大,手性纳米材料在过去几年中受到了广泛关注。手性检测是一种具有良好的特异性和高灵敏度。磁共振成像(MRI)为软组织检查提供高分辨率成像。使用功能化磁性纳米颗粒(NPs)进行MRI在重大疾病的早期诊断中显示出应用前景,特别是在生物治疗和生物医学领域。为满足对目标位点精确诊断的需求,优化和精心设计目标响应磁性材料至关重要。
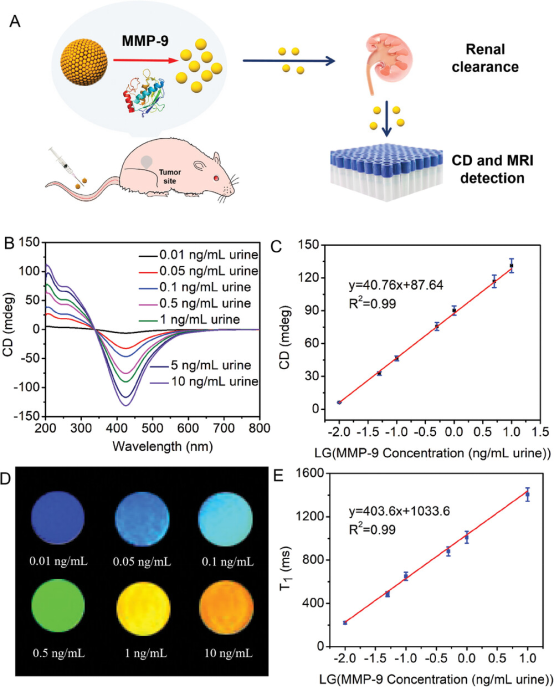
图1 L-MnO2 SPs在体内模型中的应用(摘自Advanced Materials )
肾脏在NP的清除中起着关键作用,已经开发了各种肾脏清除纳米结构来提高生物安全性,其中一些用于动物模型中的生物分析。众所周知,体内超小NP(<2nm)肾脏清除极快。近期研究开发了几种用于检测MMP-9的生物传感器。使用固定在Au电极上的亚甲基蓝(MB)标记的肽开发了一种用于MMP-9检测的电化学生物传感器,AuNPs@gelatin/AuNCs纳米复合材料通过内部分子能量转移实现了对MMP-9的定量检测。有研究创建了基于基因编码的Förster共振能量转移(FRET)生物传感器,连续监测活细胞中的MMP-9活性。然而,目前大多数关于MMP-9检测的研究主要强调体外检测的高灵敏度,很少有报道涉及体内MMP-9检测。
该研究合成了多肽TGGGPLGVARGKGGC配体修饰的手性二氧化锰超粒子(MnO2 SPs),该配体由许多通过多肽二聚体互连的较小颗粒组成。对映异构体依赖性分析表明,肿瘤细胞对L-MnO2 SPs的摄取率是D-MnO2 SPs,L-MnO2 SPs对CD47受体的亲和力是D-MnO2 SPs的两倍。肿瘤部位高表达的MMP-9会裂解多肽,导致MnO2 SPs解体为更小的颗粒(<5nm),保持其手光活性,促进小鼠肾脏的快速排泄。通过测量尿液中这些较小L-MnO2 SPs的双圆二色性(CD)和MRI响应,在体内定量分析MMP-9,从而对乳腺癌和结肠癌的小鼠模型进行早期、特异性和灵敏的监测。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202415656
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)