首页 > 医疗资讯/ 正文
放疗(RT)诱导的远隔效应引起了广泛关注,但由于肿瘤缺氧相关的放射耐药性、免疫刺激不足和免疫抑制性肿瘤微环境,在临床上很少观察到该现象。
2024年12月18日,四川大学巩长旸及刘磊共同通讯在 Biomaterials 上在线发表题为 “Radiotherapy-immunomodulated nanoplatform triggers both hypoxic and normoxic tumor associated antigens generation for robust abscopal effect and sustained immune memory” 的研究论文,该研究构建了一个放放射治疗免疫调节纳米平台(THUNDER),与RT协同作用,触发缺氧和常氧肿瘤细胞衍生的肿瘤相关抗原(TAA)的产生,从而产生强大的免疫抑制效应和持续的免疫记忆。
THUNDER的血液循环明显延长,具备高肿瘤保留能力。与RT联合使用时,THUNDER可有效破坏缺氧和常氧肿瘤细胞,促进两种细胞大量释放TAA,从而进一步促进树突状细胞(DC)的成熟,形成强大的免疫刺激并启动全身抗肿瘤免疫。小鼠模型中,THUNDER和RT的组合有效抑制了三阴性乳腺癌的生长。此外,进一步联合PD-L1阻断可显著抑制远处转移和肿瘤复发,远端肿瘤内CD8+ T淋巴细胞增加5.2倍,脾脏中效应记忆T细胞增加2.8倍。总之,放疗免疫调节纳米平台通过诱导低氧和常氧TAA释放为对抗肿瘤转移和复发提供了一种有效策略,是放射免疫治疗的重要途径。

放疗(RT)是一种重要的抗肿瘤方式,大约60%-70%的癌症患者使用该方法进行治疗。除高效的局部肿瘤控制外,RT还诱导全身抗肿瘤免疫,通常表现为远隔效应,即在原发肿瘤照射后间接消除远端转移。然而,由于肿瘤缺氧相关的放射耐药、免疫刺激不足和免疫抑制性肿瘤微环境,RT诱导的全身免疫反应在临床实践中不足以有效触发远隔效应和免疫记忆来对抗转移性和复发性肿瘤。
为增强RT诱导的抗肿瘤免疫力,在临床上将免疫检查点抑制剂(ICI)与RT同时使用。尽管杀瘤功效在一定程度上有所提高,但激活的免疫仍然不足以实现理想的全身性肿瘤控制的强效远隔效应和免疫记忆。主要障碍是肿瘤缺氧相关的放射耐药性。由于实体瘤内血管发育异常,肿瘤缺氧是一个普遍的特征,缺氧细胞通常占肿瘤质量的10-50%。缺氧严重限制RT诱导的肿瘤细胞损伤,导致缺氧肿瘤细胞肿瘤相关抗原(TAA)生成不足,进一步阻碍RT启动的全身抗肿瘤免疫。
值得注意的是,缺氧肿瘤细胞中的TAA表达谱与常氧条件下的TAA表达谱不同。如与在常氧条件下培养的癌细胞相比,在低氧条件下培养的癌细胞中的癌胚抗原表达水平会增加。因此,在RT过程中破坏缺氧肿瘤细胞可能具有增强抗肿瘤免疫反应,以触发有效远隔效应和免疫记忆的潜力。
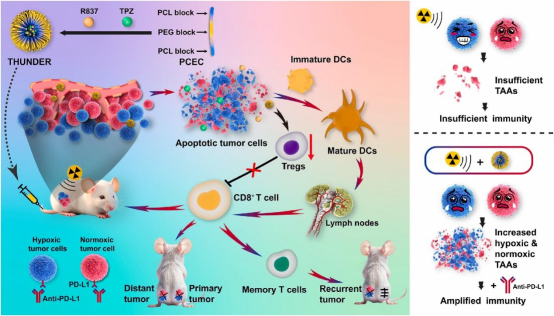
图1 放射治疗免疫调节纳米平台THUNDER出发强大的远隔效应和持续的免疫记忆(图源自Biomaterials )
该研究构建了一个放射治疗免疫调节纳米平台(THUNDER),触发低氧和常氧TAAs生成,从而放大RT触发的远隔效应和免疫记忆,以更有效地对抗肿瘤转移和复发。THUNDER由噻拉帕嗪(TPZ)和咪喹莫特(R837)共包封构建,实现缺氧激活的肿瘤细胞杀伤和抗肿瘤免疫调节。THUNDER的血液循环时间明显延长,肿瘤滞留能力增强。在RT的照射下,THUNDER释放的TPZ仅在低氧肿瘤组织中被还原为自由基中间体,精确地破坏低氧肿瘤细胞。同时,RT诱导常氧肿瘤细胞死亡,消耗氧气并加重肿瘤缺氧,进一步激活TPZ并增强缺氧肿瘤细胞的清除,有效破坏原发性肿瘤,极大地诱发缺氧和常氧肿瘤细胞释放TAAs。
然后,TAAs和THUNDER从强免疫刺激中释放R837(一种toll样受体7激动剂),促进树突状细胞(DC)成熟,并在原发性肿瘤、远处肿瘤和脾脏中积累细胞毒性CD8+ T细胞。当与ICIs组合时,在双侧肿瘤小鼠模型和肿瘤再攻击模型中分别观察到对远处转移和肿瘤复发的显著抑制。总之,基于THUNDER的放射免疫治疗策略是一种通过诱发低氧和常氧癌细胞释放TAAs来对抗肿瘤转移和复发的有效途径,从而触发强大的远隔效应和免疫记忆,为放射免疫治疗提供了一种有效方法。
参考消息:
https://www.sciencedirect.com/science/article/pii/S0142961224005416?via%3Dihub
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)