首页 > 医疗资讯/ 正文
高危乳腺癌和卵巢癌(HBOC)突变研究已在不同种族的患者中得到广泛探索。本研究比较了有和没有其他危险因素的良性乳腺疾病或乳腺癌患者(n = 4341)的胚系突变率和突变谱。纳入了三个中国患者队列。第一个队列,高危队列(HR,n = 3935),包括符合高危 HBOC 标准的高危乳腺癌患者,来自遗传中心。第二个队列,未经选择的癌症队列(CC,n = 307),由来自乳腺外科的乳腺癌患者组成。第三个队列,良性乳腺病变队列(NC,n = 99),包括 99 名患有良性乳腺疾病的患者,例如纤维腺瘤、纤维腺瘤样增生和导管内乳头状瘤。上述患者队列进行了 30 个 HBOC 相关基因测序。HR、CC 和 NC 队列的胚系突变率分别为 11.9%、6.5% 和 8.1%。在 CC 队列中,29.3%(90/307)的患者符合美国国家综合癌症网络(NCCN)2022 v.2 高危基因检测标准,这组患者的突变率为 11.1%,与 HR 队列相似,而不符合检测标准的患者的突变率为 4.6%,与 NC 队列相似。高外显率基因(BRCA1/2、CDH1、PALB2、PTEN 和 TP53)突变仅在 HR(10.6%)和 CC(3.3%)队列中发现,未在 NC 队列中发现。ATM、BRIP1、RAD51C 和 RAD51D 突变见于所有队列。RAD51C 和 RAD51D 突变显示矛盾的外显率,在 NC 队列中观察到出乎意料的 2% 的高突变率,而在 HR 队列和 CC 队列中突变率分别仅为 0.3% 和 0.5%。本研究结果表明,临床需要加强对未经选择的乳腺癌患者的基因检测,以识别高危患者。
研究背景
PARP 抑制剂奥拉帕利和他拉唑帕利已被批准用于治疗携带胚系 BRCA1/2 突变(gBRCAm)的转移性乳腺癌。最近的 OlympiA 试验显示,奥拉帕利辅助治疗能够改善携带 gBRCAm 的 HER2 阴性高危早期乳腺癌患者的无进展生存期(PFS)和无远处转移生存期。与非铂类单药化疗相比,使用 PARP 抑制剂可显著改善 gBRCAm 携带者的 PFS 和健康相关生活质量。同源重组修复(HRR)基因胚系突变也被列为评估他拉唑帕利治疗 HER2 阴性乳腺癌有效性的试验的纳入标准。分子遗传学的进展已经在几个参与调节细胞生长和/或DNA修复的高至中等外显率基因中发现了致病性或可能致病性(P/LP)变异,这些基因与乳腺癌、卵巢癌、前列腺癌、结肠癌和胰腺癌的遗传易感性有关(如BRCA1/2、TP53、CDH1、PTEN和PALB2),特征是发病早,表现出常染色体显性遗传模式。随着下一代测序(NGS)技术的发展,NGS 已在许多发展中国家可及,检测成本也大大降低。多基因 panel 检测已成为遗传性乳腺癌患者及其亲属疾病相关基因突变检测的常见选择。2014 年,King 等人首次倡导对所有女性进行基于人群的胚系 BRCA1/2 筛查,但他们遇到了争议。2019 年,美国乳腺外科医师学会发表了一份关于对所有有乳腺癌个人史的患者进行基因检测的共识声明。美国医学遗传学与基因组学学会(ACMG)随后也建议评估对所有乳腺癌患者进行胚系基因检测的需求。2020 年,梅奥诊所的一项研究提出了一种用于乳腺癌患者基因检测的融合方法。该研究建议对所有 65 岁之前诊断的女性进行检测,对 65 岁之后诊断的女性遵循 NCCN 检测标准。然而,NCCN 胚系基因检测指南倾向于更严格的方法,由于阳性检出率低,推荐仅对高危患者进行检测。直到 2021 年,在 2021 v.1 指南中,NCCN 才放宽了标准,包括了更多的乳腺癌患者进行基因筛查,以辅助 PARP 抑制剂治疗决策。在 2023 v.1 更新中,NCCN 进一步更改了他们的检测标准,将其扩大到包括更多的乳腺癌患者,基于诊断年龄和家族史进行基因筛查。ASCO 外科肿瘤学会最近的一项更新也推荐对所有 ≤65 岁的新诊断的乳腺癌患者(I-III 期或新发 IV 期/转移性疾病)进行检测,基于癌症个人史、家族史和种族的检测标准仅应用于 >65 岁的患者。
本研究分析了三个不同专科中心(高危遗传中心、乳腺外科中心和一般乳腺中心)的连续患者的胚系突变,在中国人群中比较突变频谱。我们的结果表明,临床需要加强对所有乳腺癌患者的基因检测,以识别高危突变携带者。
研究结果
本研究共纳入了 4341 名中国乳腺癌或良性乳腺疾病患者。这些患者来自三个中国患者队列。第一个队列,HBOC 高危队列(HR,n = 3935),由高危乳腺癌患者组成,包括满足以下任何标准的患者:(1)在任何年龄被诊断为乳腺癌,至少有一名一级或二级亲属患有乳腺癌和/或卵巢癌, 无论年龄如何;(2)在 45 岁或之前被诊断为乳腺癌;(3)患有双侧乳腺癌;(4)患有三阴性乳腺癌;或(5)为男性乳腺癌患者。第二个队列,未经选择的癌症队列(CC,n = 307),由普通乳腺外科中心的乳腺癌患者组成,无论选择标准如何。第三个队列,良性乳腺病变队列(NC,n = 99),包括 99 名患有良性乳腺疾病或异常的患者,例如纤维腺瘤、纤维腺瘤样增生和导管内乳头状瘤。这些患者队列进行了 30 个 HBOC 相关基因检测。
各队列的患者特征
3935 名 HBOC 高危(HR)患者(n = 3935)来自遗传中心。这些患者在首次转诊时符合 NCCN 2022.v2 检测标准,中位诊断年龄为 47.6 岁,范围从 19.3 岁到 95.8 岁不等。该队列中超过 70% 的乳腺癌是激素阳性浸润性导管癌。在这些患者中,40.8% 有乳腺癌家族史,30.7% 有 BRCA 相关癌症家族史。
未经选择的乳腺癌对照队列(CC,n = 307)来自乳腺外科癌症中心。在这些患者中,29.3%(90/307)符合 NCCN 2022.v2 检测指南,70.7%(217/307)不符合任何高危标准。符合检测标准的患者的中位诊断年龄为 55.3 岁,范围从 32.1 岁到 90.6 岁不等,而不符合标准的患者的中位诊断年龄更大,为 59.8 岁,范围从 45.0 岁到 82.5 岁不等。两组的组织学主要为浸润性导管癌,分别占 90% 和 82.5%。符合或不符合 NCCN 2022.v2 检测指南的患者之间的主要区别在于 TNBC 亚型和乳腺癌或卵巢癌家族史(表 1)。在符合 NCCN 标准的 CC 队列中,22.5% 的患者患有 TNBC,36.7% 有乳腺癌家族史,5.6% 有卵巢癌家族史。
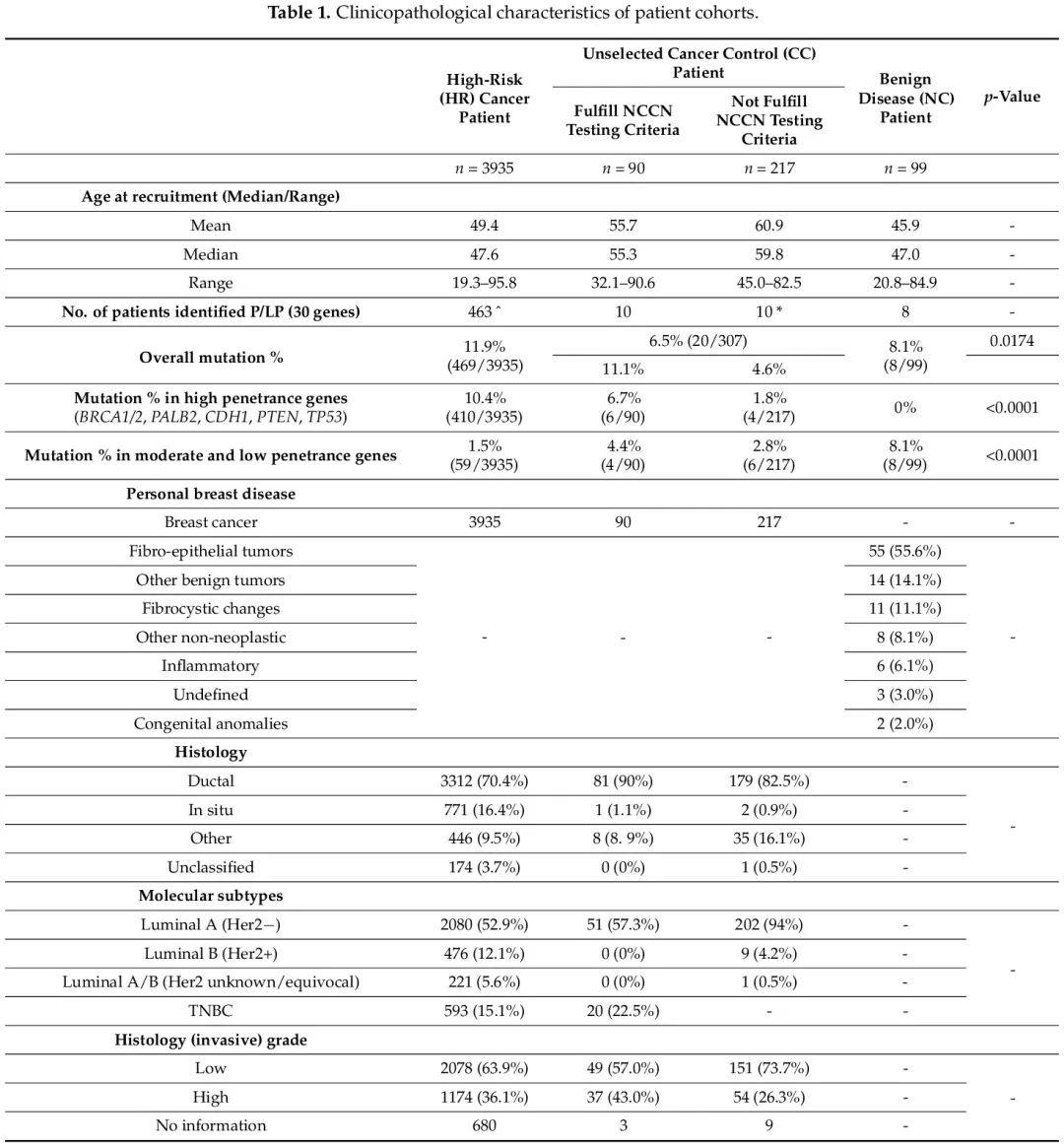
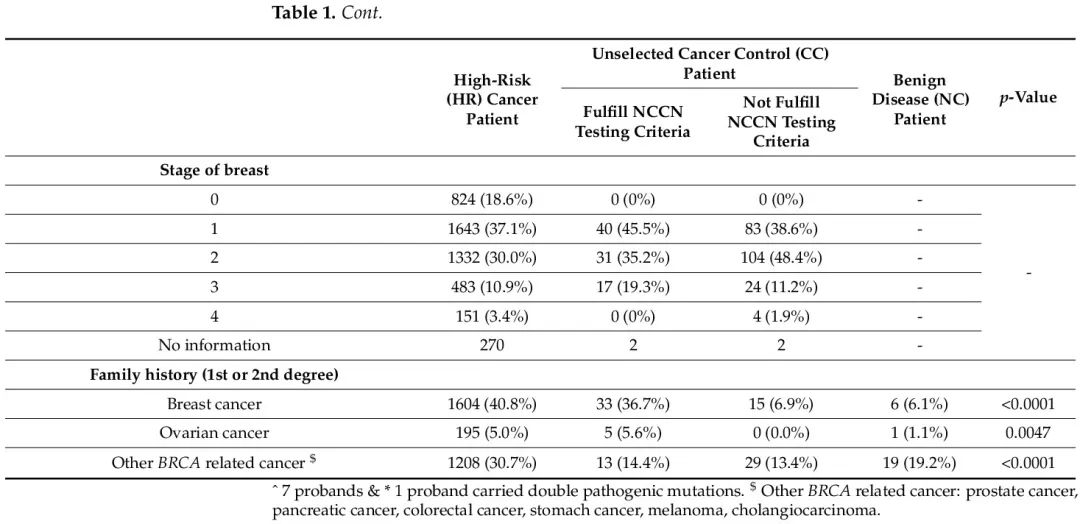
表1
在 NC 队列的 99 名良性乳腺患者中,乳腺良性疾病的中位诊断年龄为 47.0 岁,范围为 20.8 至 84.9 岁。这些患者的乳腺疾病多为纤维上皮性肿瘤(55.6%),如纤维腺瘤、叶状肿瘤和纤维腺瘤样改变。14.1% 的患者患有导管内乳头状瘤、导管腺瘤或纤维瘤病,并被归类为其他良性肿瘤。11.1% 的患者有乳腺纤维囊性改变,8.1% 有其他非肿瘤性良性乳腺问题。这些 NC 患者中分别只有 6.1% 和 1.1% 有乳腺癌或卵巢癌家族史。患者队列的临床病理特征列于表 1。
各队列的胚系突变
在 HR、CC 和 NC 队列中,30 个 HBOC 相关基因存在致病性或可能致病性胚系突变的患者比例分别为 11.9%、6.5% 和 8.1%。在 CC 队列中,符合 NCCN 基因检测标准的患者突变率为 11.1%,与 HR 队列相似,而不满足检测标准的患者突变率为 4.6%,与 NC 队列相同。高外显率基因突变(BRCA1/2、CDH1、PALB2、PTEN 和 TP53)见于 10.6% 的 HR 患者和 3.3% 的 CC 队列(符合和不符合 NCCN 标准的患者突变率分别为 6.7% 和 1.8%),而在 NC 队列中未发现(表 2)。在 HR 和 CC(符合标准)队列中,突变频率最高的基因是 BRCA2,突变率分别为 5% 和 3.3%。在 CC 非高危队列中也发现了 BRCA2 突变,但突变率仅为 0.5%,在 NC 队列中未发现 BRCA2 突变。关于其他中等和低外显率基因,仅在 1.3% 的 HR 患者和 3.3% 的 CC 队列中发现突变(符合和不符合 NCCN 标准的患者的突变率分别为 4.4% 和 2.8%),而在 NC 队列中这一比例为 8.1%(表 2)。在所有队列中均发现 ATM、BRIP1、RAD51C 和 RAD51D 突变。RAD51C 和 RAD51D 突变显示矛盾的外显率,在 NC 队列中发现了 2% 的意外高突变率,在 HR 队列和 CC 非高危队列中突变率分别仅为 0.3% 和 0.5%(见表 2 和图 1)。
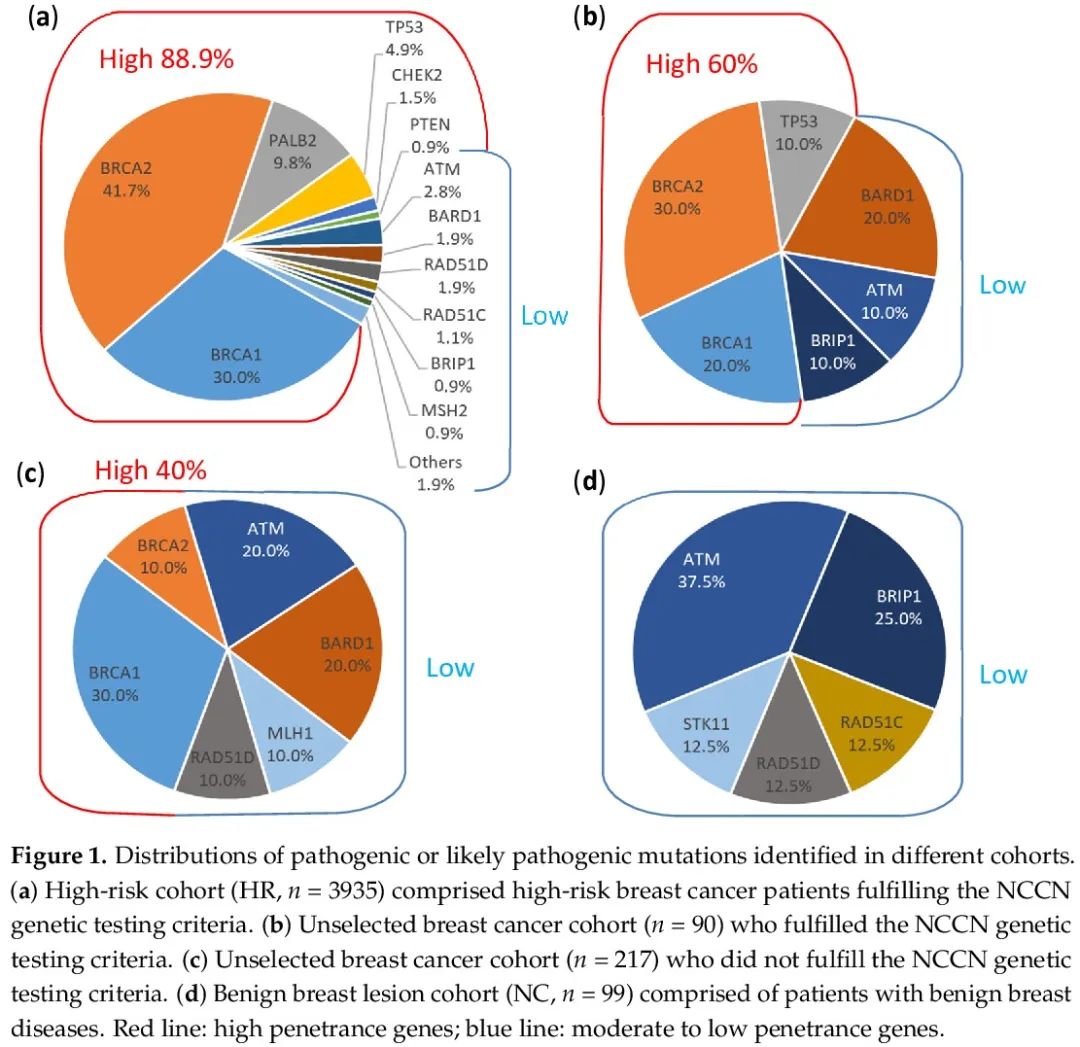
图1
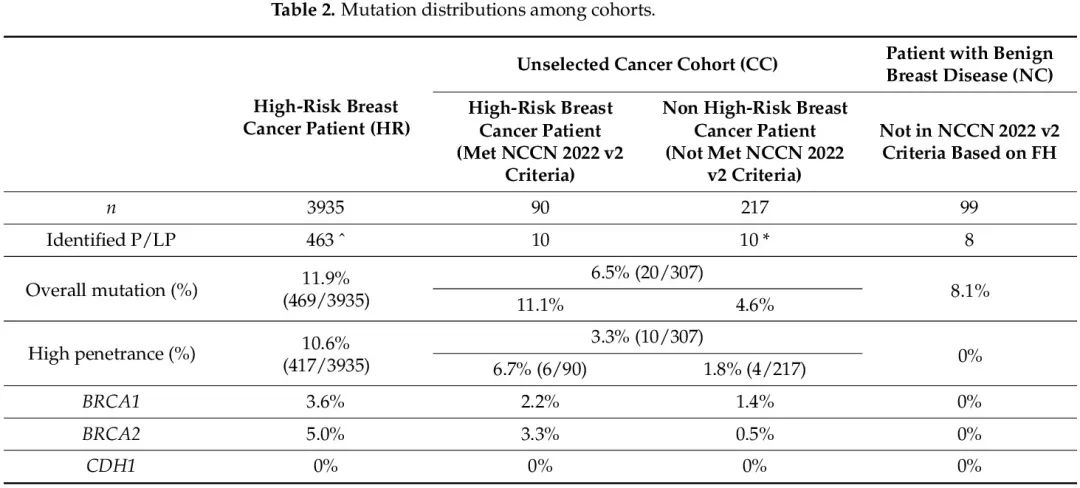
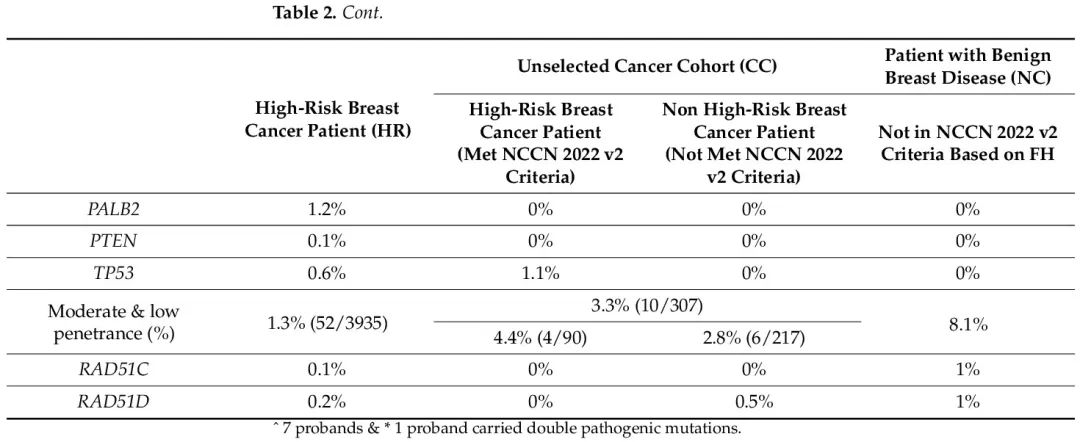
表2
讨 论
NGS 多基因检测提高了突变的检出率,提供了具有成本效益的癌症风险评估。识别癌症易感基因胚系致病性或可能致病性突变,对癌症预防、早期发现、治疗(例如使用聚 ADP 核糖聚合酶抑制剂 PARPi)和管理具有相当大的意义,对患者及其亲属均是如此。尽管分子筛查有好处,但由于目前采用的检测标准,例如主要依赖于肿瘤家族史和病理学的英国 NICE 检测标准,许多乳腺癌患者未接受过检测。一项研究纳入了 35000 名来自多个种族的未经选择的乳腺癌患者,使用 25 基因 panel,发现突变率为 9.3%,不同种族的阳性率在 7.2% 到 11.5% 之间。在另一项连续系列研究中,10000 名癌症患者和未患病个体接受了 29 基因 NGS 检测,其中 82% 的患者是白种人,分析发现,9.0% 的患者携带至少一种致病性或可能致病性变异,其中 51.2% 的突变涉及高外显率基因。在另一项多中心研究中,2984 名有未经选择的癌症个人史和家族史的患者进行了 80 基因 panel 检测,结果显示,13.3% 的患者存在 P/LP 变异,其中 5% 的突变来自高外显率基因,超过一半的变异来自中等或低外显率基因。在亚洲人群中,研究了未经选择的乳腺癌的胚系突变谱,BRCA1 的突变率为 1.5% 至 2.7%,BRCA2 的突变率为 2.4% 至 3.8%。对于亚洲 HBOC 患者,BRCA1 的突变率为 1.3%-14.6%,BRCA2 的突变率为 3.2%-10.8%。在另一项针对 13129 名无癌中国个体的研究中,BRCA1 和 BRCA2 突变率分别为 0.2% 和 0.4%。中国至少有 10% 的未经选择的乳腺癌患者携带癌症易感基因致病性变异。这些发现表明,在没有选择标准的情况下,乳腺癌患者的 BRCA1/2 突变率至少为 1.5% 至 3.8%。我们的研究显示,高外显率基因的突变率为 1.8%,其中 1.4% 来自 BRCA1,0.5% 来自 BRCA2(表 2),隐藏在非高危乳腺癌患者中,这些患者在持续的医疗保健中需要改变管理。
关于中等和低外显率基因的突变频谱,在所有队列中均发现了 ATM、BRIP1、RAD51C 和 RAD51D 突变。一项系统综述显示,ATM 缺失、插入、替换突变与乳腺癌相关。在美国,ATM 突变率高达 6.6%,已经描述了许多 ATM 突变,与患乳腺癌的中等风险相关。在亚洲人群中,HBOC 患者的 ATM 致病突变发生率约为 1%,在未经选择的乳腺癌患者中观察到类似的发生率。而良性乳腺疾病患者的突变比例增加到 3%(表3)。
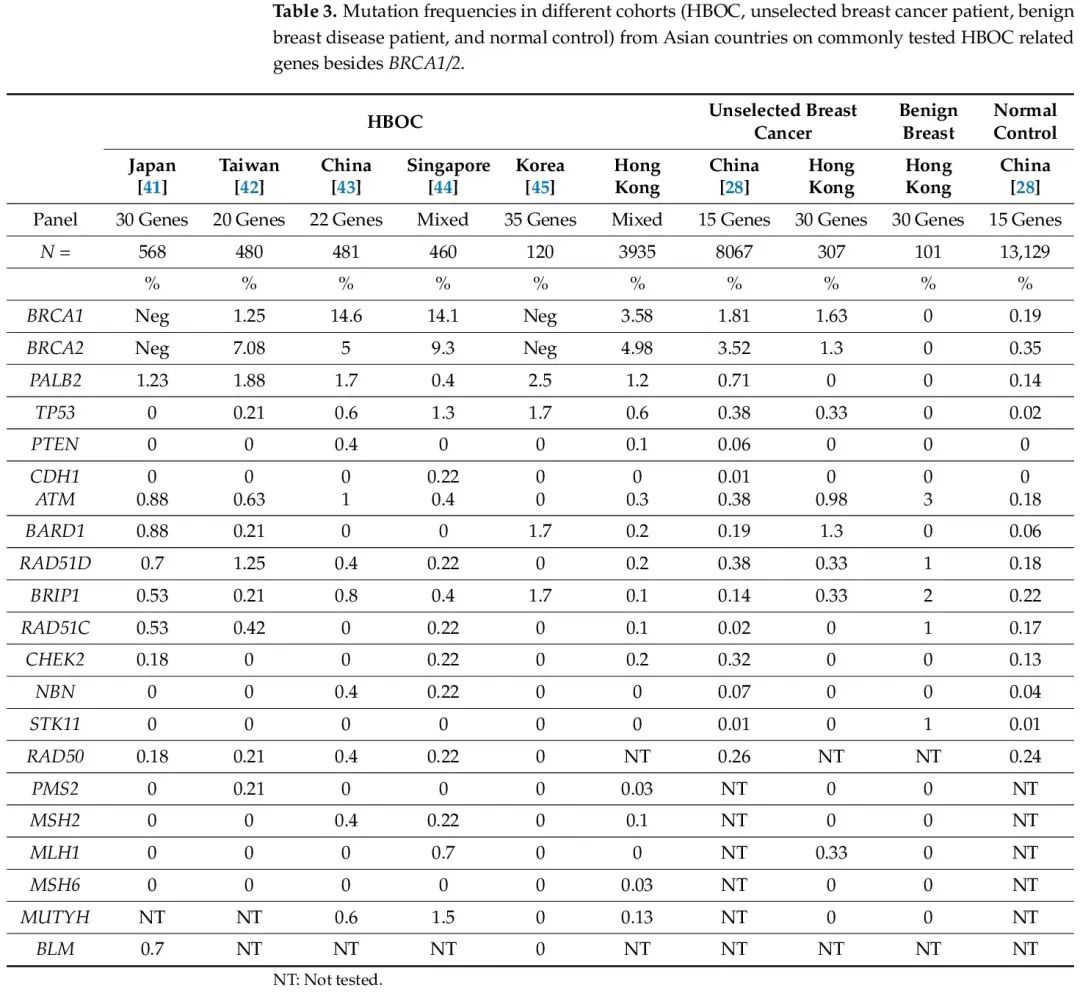
表3
胚系突变也常见于乳腺纤维腺瘤患者。在 12 名中国纤维腺瘤患者中发现了 1 名 ATM c.8246A > T; p. (Lys2749Ile) 胚系突变携带者。瑞典、芬兰和丹麦的大多数研究报道,常见的 ATM 基因变异与乳腺癌易感性无关。这一观察结果也在我们的中国人群中观察到。
RAD51C 和 RAD51D 突变显示矛盾的外显率。在 NC 队列中发现了 2.0% 的意外高突变率,但在 HR 和 CC 队列中突变率分别只有 0.36% 和 0.33%。我们的大多数 RAD51D 突变携带者携带c.270_271dupTA; p. (Lys91Ilefs*13) 突变,这是一个已知突变,尤其是在亚洲人群中。基因组聚合数据库(gnomAD)显示,在 14/18394(0.076%)的东亚人群中观察到该变异,而在其他人群中没有观察到。RAD51C 和 RAD51D 突变携带者的管理一直存在争议。在ACMG发布的关于在临床外显子组和基因组测序背景下报告次要发现的指南中,RAD51C和RAD51D突变未在SF v3.1中列出,也不再作为次要发现报告,并提到了主要晚发性乳腺癌的中等风险和卵巢癌的低外显率。在 NCCN 管理指南 2023 v.3 中,RAD51C 和 RAD51D 突变携带者患乳腺癌的绝对风险从 15-40% 改为 20-40%,对管理也进行了修改,包括每年进行一次乳腺 X 光检查,以及考虑从 40 岁开始进行乳腺增强 MRI。对于卵巢癌,也修改了 RAD51C 和 RAD51D 突变携带者的管理,目前推荐患者在 45-50 岁时进行降低风险的输卵管卵巢切除术(RRSO),而不仅仅是考虑。RAD51D 致病性变异的不完全外显率已从临床、分子病理学和体外角度得到证明(稿件正在审查中)。鉴于在 NC 队列中观察到的不完全外显率和高突变率,人群筛查方法尤为重要。
本研究有一些局限性。使用单因素方差分析和 LSD 检验对四个队列的年龄分布进行多重比较,结果显示存在显著差异(p < 0.001)。发现 HR 队列比 CC(符合 NCCN)队列相对年轻,导致高外显率基因的突变频率更高,即使他们具有相同的分组标准。此外,这两个队列中 BRCA 相关癌症的家族史也显示 p 值为 0.0007。在 HR 队列中,30.7% 的患者有家族成员患有乳腺癌和卵巢癌以外的 BRCA 相关癌症(如前列腺癌、胰腺癌、结直肠癌、胃癌、黑色素瘤和胆管癌),而只有 14.4% 的 CC(符合 NCCN)患者有此类家族史。这可能提示,临床医生经常遗漏这些 BRCA 相关癌症,患者不会被转诊到高危遗传中心进行基因检测。这揭示了转诊系统的问题,因为 CC(符合 NCCN)队列患者应该被转诊进行基因检测。在我们之前的一项研究中,我们采访了香港乳腺癌和卵巢癌医学专家,发现8.5%的专家可能对转诊患者进行基因检测犹豫不决,9.9%的专家没有相关信息和资源转诊患者进行基因检测。
鉴于高外显率基因突变不仅见于高危队列,还见于未经选择的乳腺癌对照队列,因此对未经选择的乳腺癌队列进行基因筛查尤为重要,尤其是在识别适合使用 PARPi 的患者方面。然而,财政支持是基因检测限制的另一个问题。许多国家通常要求患者满足严格的基因检测标准才能报销,而该检测不受许多发达亚洲国家地区政府的支持,包括香港、新加坡、马来西亚和台湾,韩国和日本仅支持疑似 HBOC 的患者。为了平衡策略和普遍筛查之间的局限性,梅奥诊所建议采用混合方法,对所有65岁之前诊断为乳腺癌的女性进行检测,对老年患者使用NCCN标准。在我们识别的 19 名来自非高危乳腺癌患者的致病突变携带者中,10 名携带高外显率基因突变,10 名中有 3 名年龄超过 65 岁,其中两名是 BCRA1 突变携带者。从这一发现来看,混合检测方法不适用于中国人群。因此,我们建议对所有乳腺癌患者进行普遍的胚系突变筛查,作为在中国人群中实施的较好方法。
综上所述,我们包括这三种临床环境的研究揭示了扩大中国人群乳腺癌患者基因检测方案的必要性。实施更全面的检测策略可以更好地发现高危胚系突变并改善这些个体的临床管理。
参考文献:
Kwong A, Ho CYS, Leung HCM, Leung AWS, Au CH, Ma ESK. Mutation Spectrum Comparison between Benign Breast Lesion Cohort, Unselected Cancer Cohort and High-Risk Breast Cancer Cohort. Cancers (Basel). 2024 Sep 3;16(17):3066. doi: 10.3390/cancers16173066. PMID: 39272924; PMCID: PMC11393947.

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)