首页 > 医疗资讯/ 正文
前言:现在的磨玻璃肺癌很常见,大家都知道风险相对较小,手术可做得小一些,复发或转移风险极低,随访以及必要时的楔形切除正越来越被结友和医生所接受。但对于实性小肺癌,尤其是浸润性腺癌,病理亚型含高危的时候,正越来越困惑着广大早期肺癌患者和专科医生。而且医生对是否需要行标准肺叶切除加淋巴结清扫存在争议与不一致的意见。虽然大部分医生肯定倾向做肺叶切除。这类病人虽然术后TNM分期算1A期,但是否需要术后辅助靶向治疗或化疗也困扰着大家。今天我想以一个病例入手,来分析与探讨这一类病例该如何处理。仅一家之言,不代表医院立场,也不代表业内共识或必为最科学的观点。只作为抛砖引玉的作用,希望大家重视并来研究这一类疾病群体。
(一)网络咨询结缘
病史信息:
女性、36岁。
病情描述:
本人7月初嗓子肿了一个星期,然后开始咳嗽一直不见好,气道不舒服,于2024年8月9日去某市人民医院呼吸科A医院处就医,她觉得我咳嗽应该是气道敏感,但是当时拍胸部平扫CT,发现左肺上叶尖有个10mm×8mm的实性结节(可扫二维码查看),她帮我约了次周该医院胸外科B医生的门诊。等待中间,8月11日我先去某市中心医院胸外科C医生看,给做了一个左肺靶扫描检查(可扫二维码查看),医生让我立马去手术。8月13日我回到某市人民医院胸外科B医生处,B医生大概意思是可以观察下,但是要重视,也不能隔太久。因为我们单位一般在10月或者11月还会在该医院体检,我就计划安排在单位体检的时候再做一个CT。B医生给我开了12片盐酸莫西沙星,我自己最近在D医生某中医那里吃中药调理肺结节。
问诊回复截图展示:

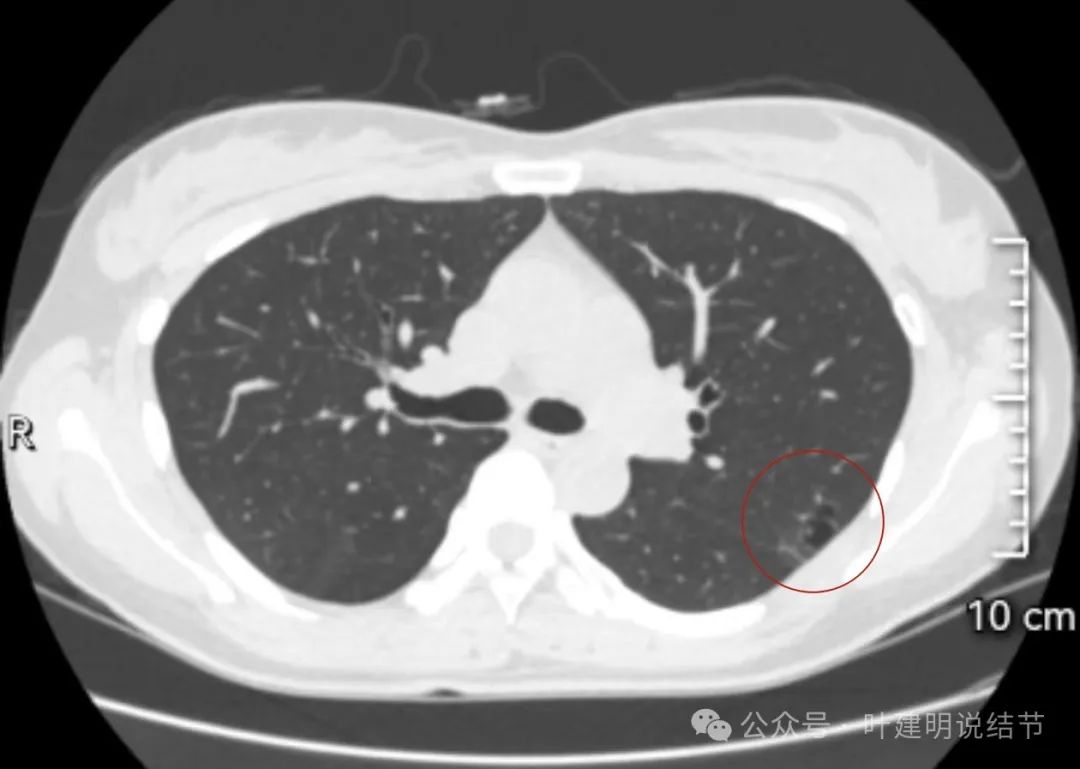
某市人民医院第一次查出来时的报告提示左上叶尖后段实性结节,约10*8毫米,有分叶与胸膜凹陷征,需要警惕并靶扫描评估。

某市中心医院靶扫描后示左上叶尖后段单发实性结节,考虑肿瘤可能,建议多学科门诊。
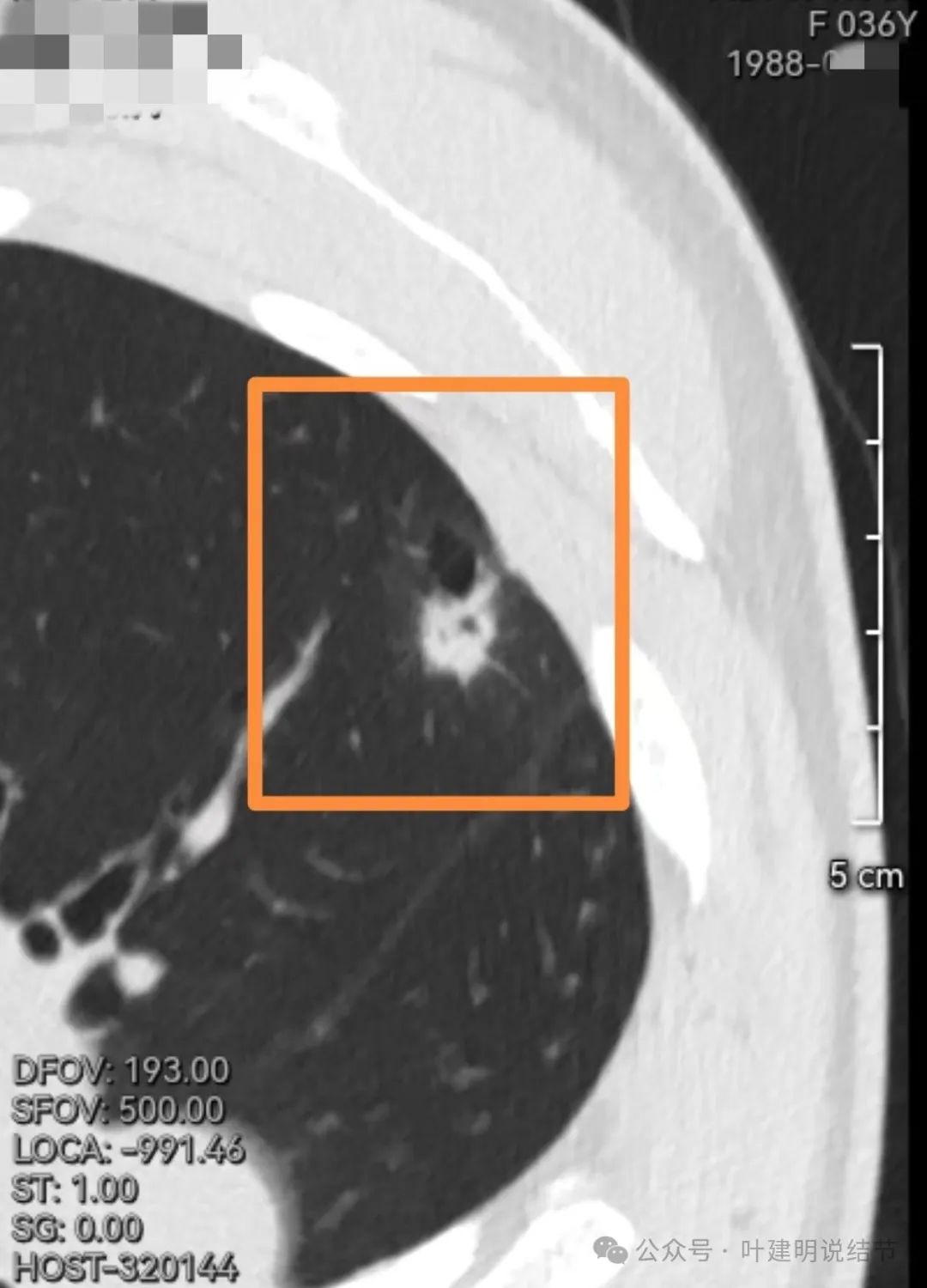
病灶明显处截图,见其为囊腔型病灶,主要部分实性,边缘不平有毛刺样征,囊腔的壁其他部分是较淡的磨玻璃成分,但轮廓清楚,瘤肺边界清。壁内有血管穿行。
我的意见:
这个病灶实性密度伴有囊腔,囊壁厚薄不均,实性部分有毛刺,有收缩力,叶间胸膜有轻微牵拉,具备诸多恶性影像特征,高度怀疑是肺癌,而且是浸润性癌,恶性程度不低。我建议尽早手术为妥。意见供参考!
(二)结友听从我的建议,下定了手术的决心,影像细节展示与分析
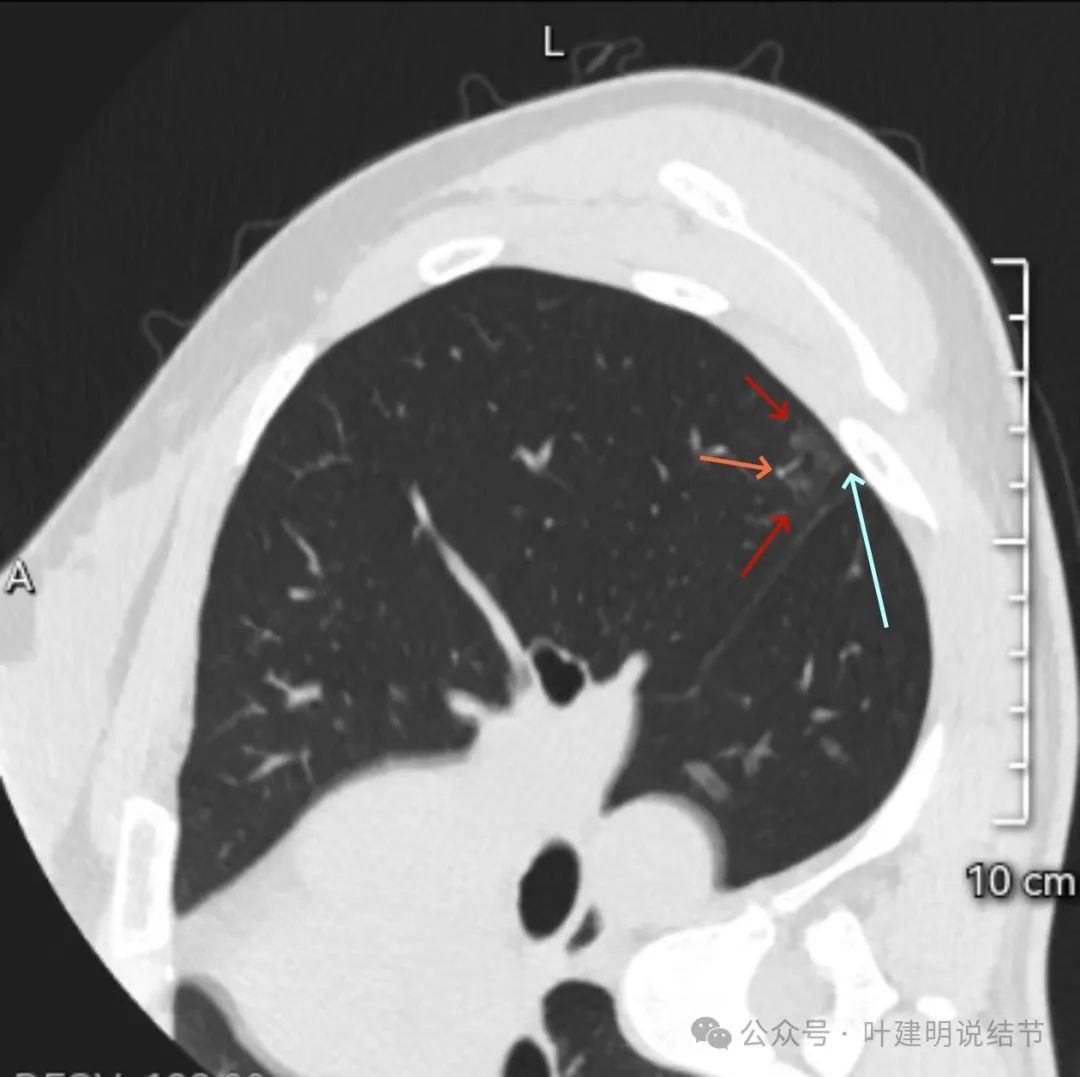
平扫明显层面:
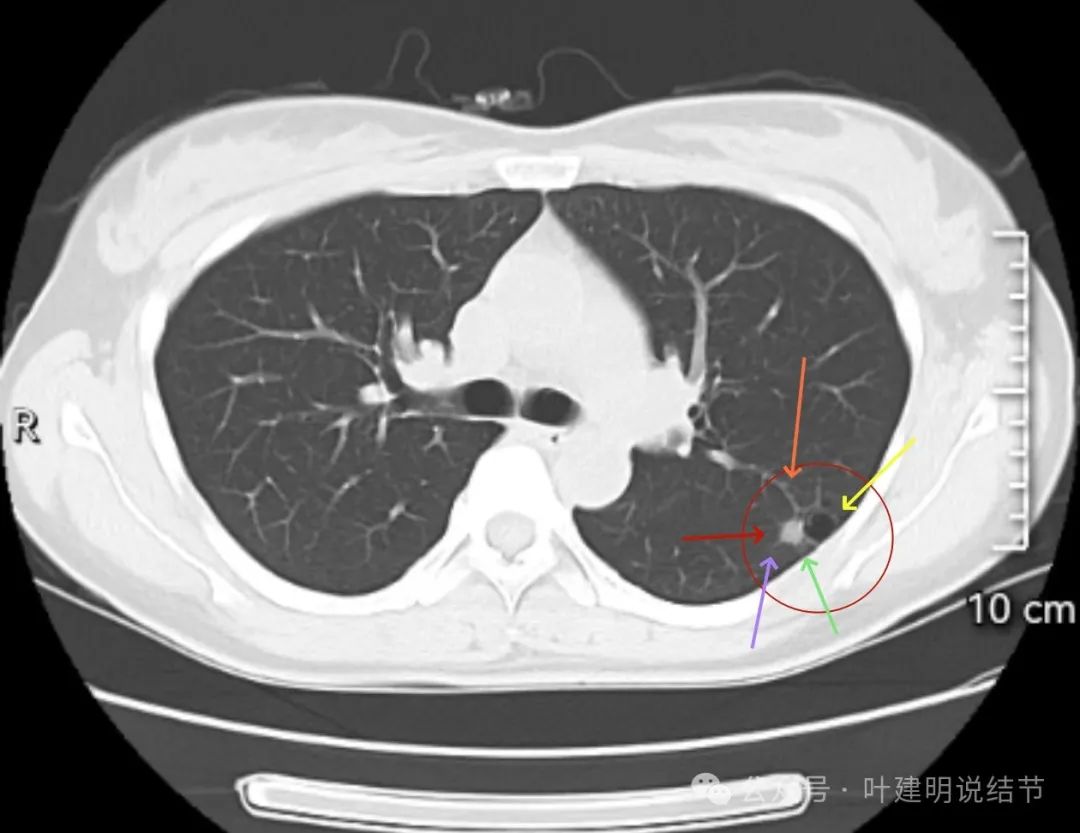
病灶囊腔灶,主要部分实性密度,有血管走向实性部分,囊壁是淡磨玻璃成分,囊腔内壁不光滑,有小的棘突征,整体表面不平,与胸膜表面紧贴。
薄层影像:
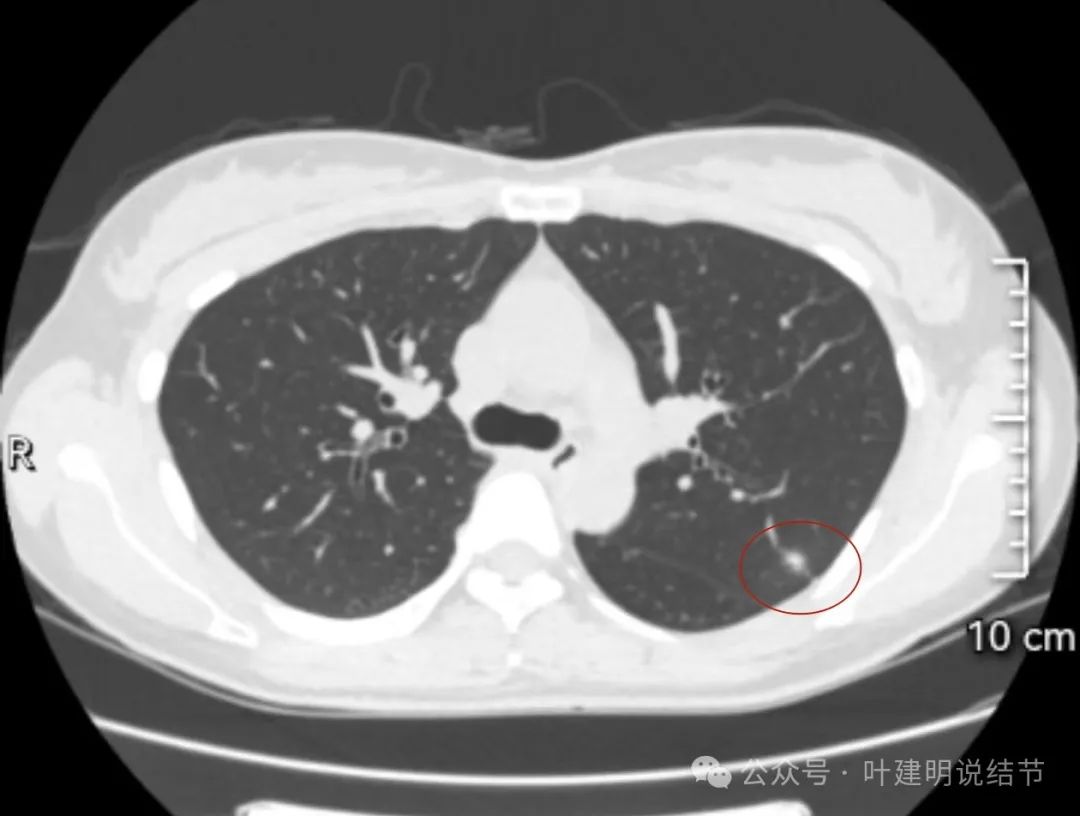
病灶出现,似乎边缘略模糊。
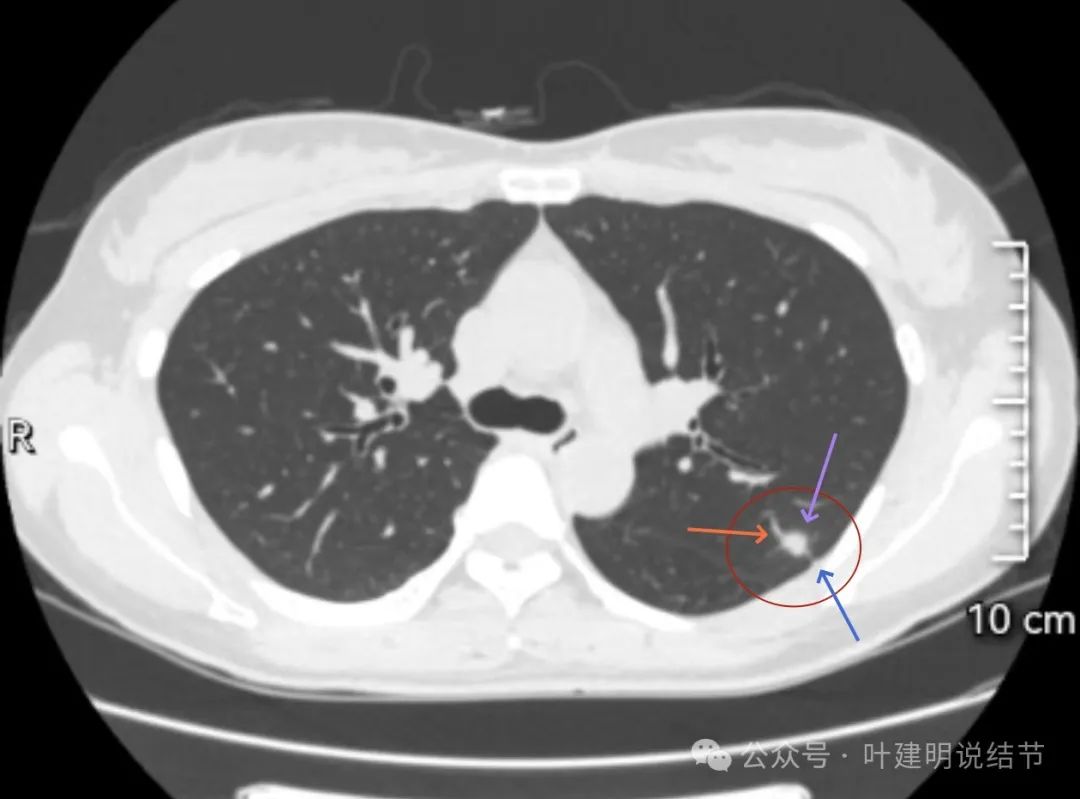
有血管进入,密度较高,胸膜似轻微牵拉。部分边缘似见细毛刺征。
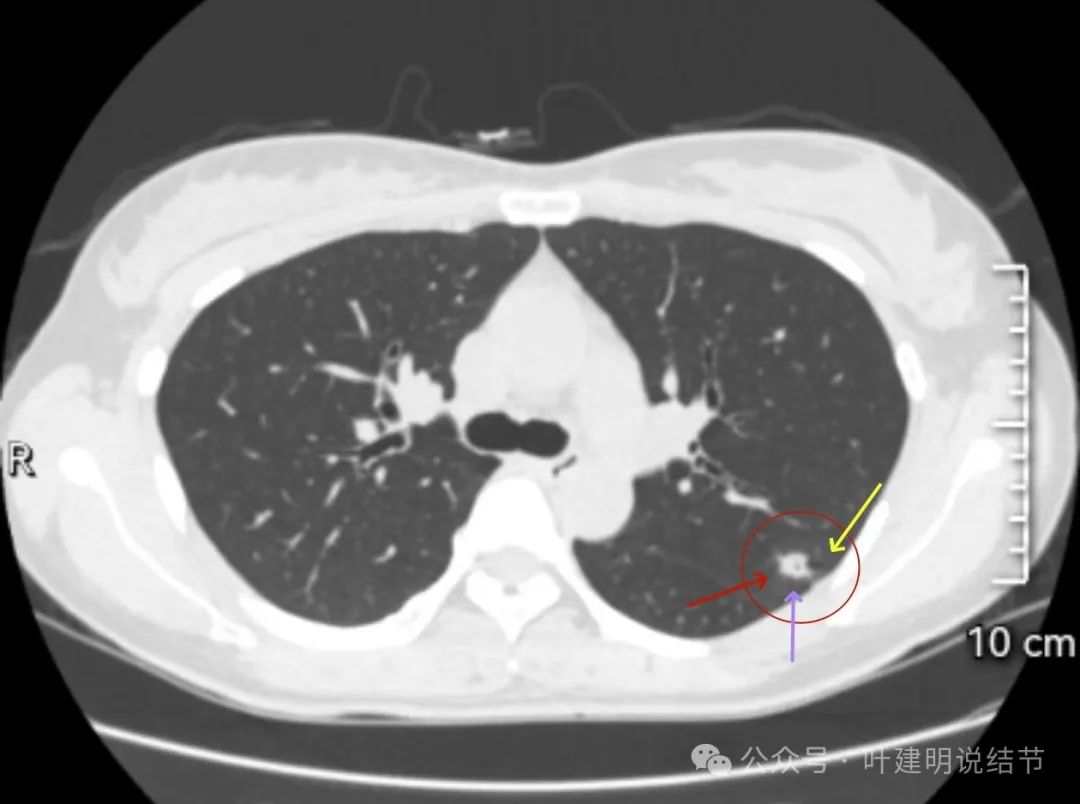
病灶内部有小空泡似的,表面不光滑;边上出现小的囊腔。
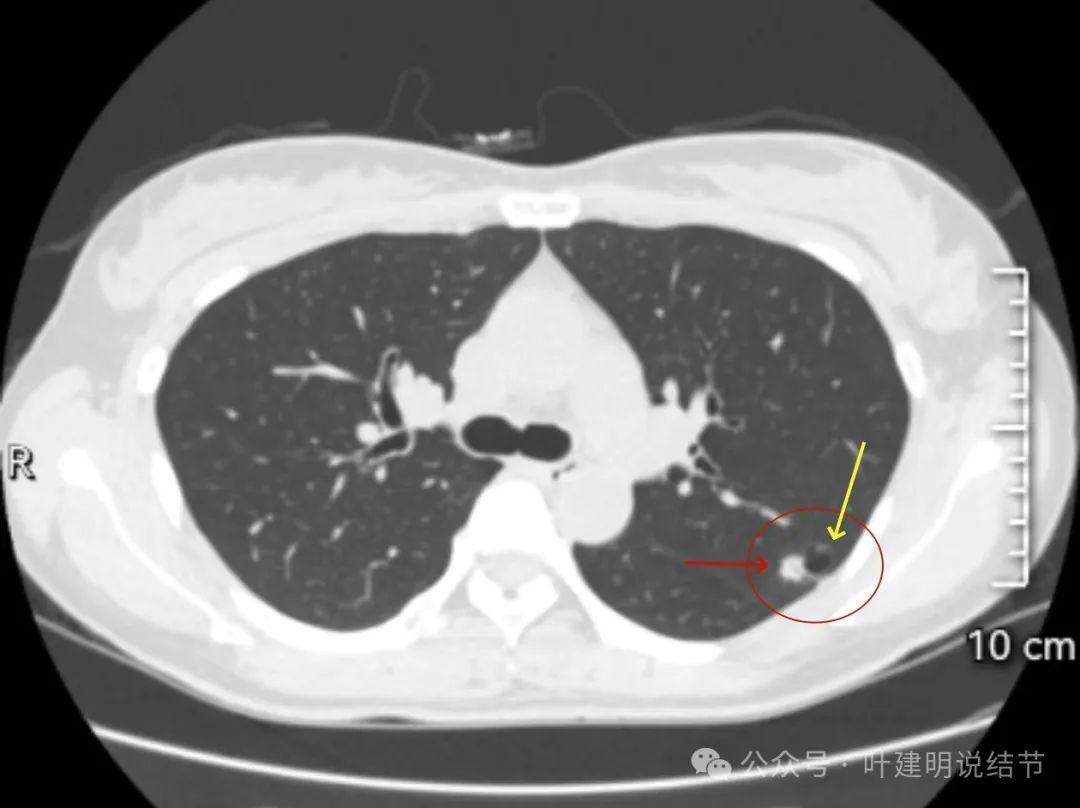
囊腔扩大,实性部分表面不平,密度稍显不均。
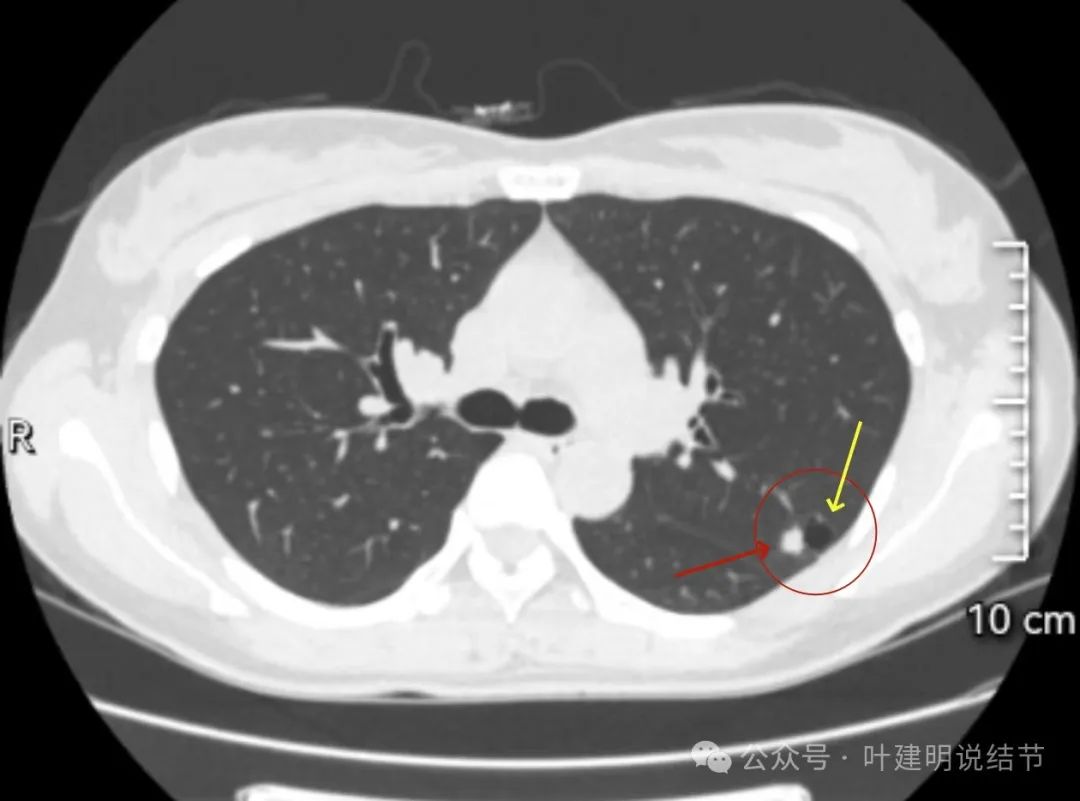
实性部分密度高,囊壁是磨玻璃,但很淡。
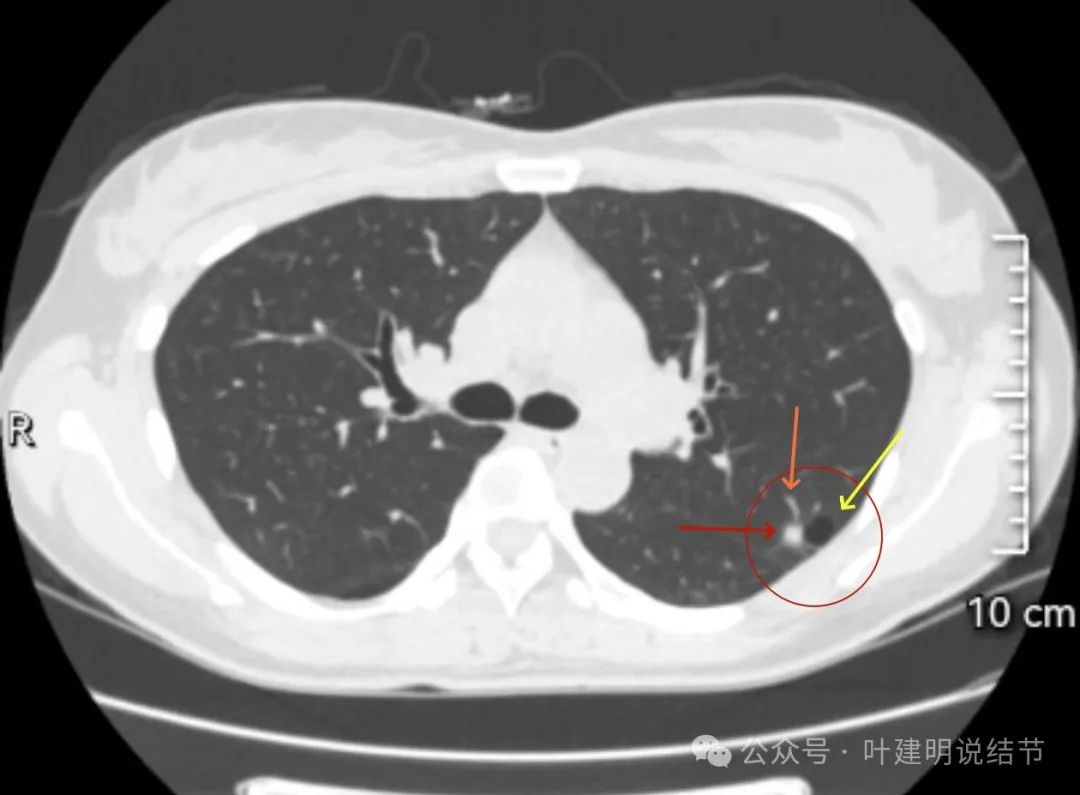
血管进入明显,囊腔明显。
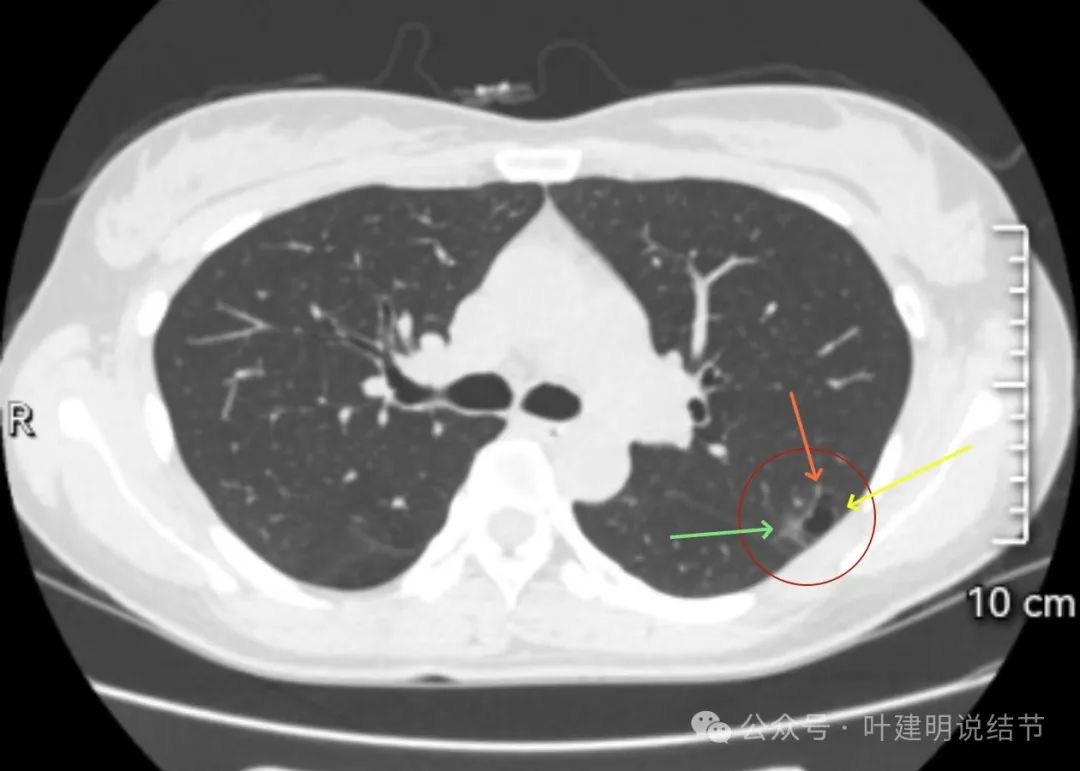
较为边缘区显得整体轮廓清,磨玻璃成分较前面明显些,囊腔不规则,内壁不平整。
囊腔内壁不平,似有分隔似的。
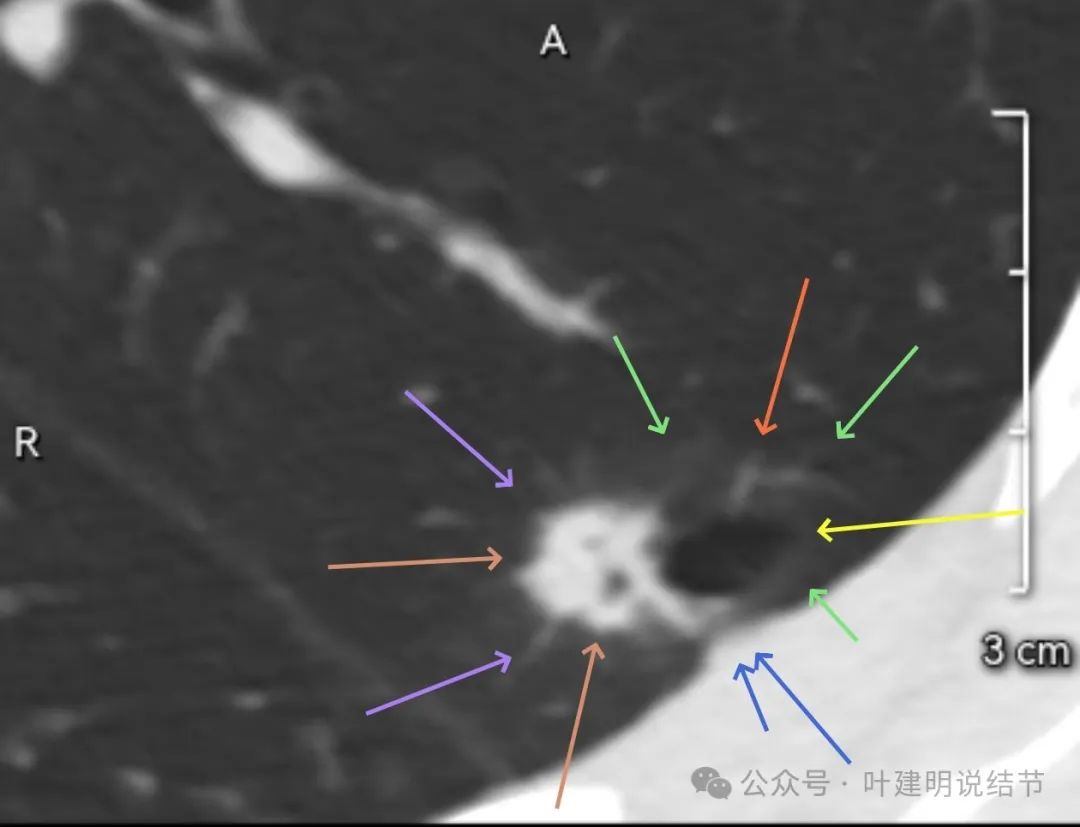
靶重建影像:
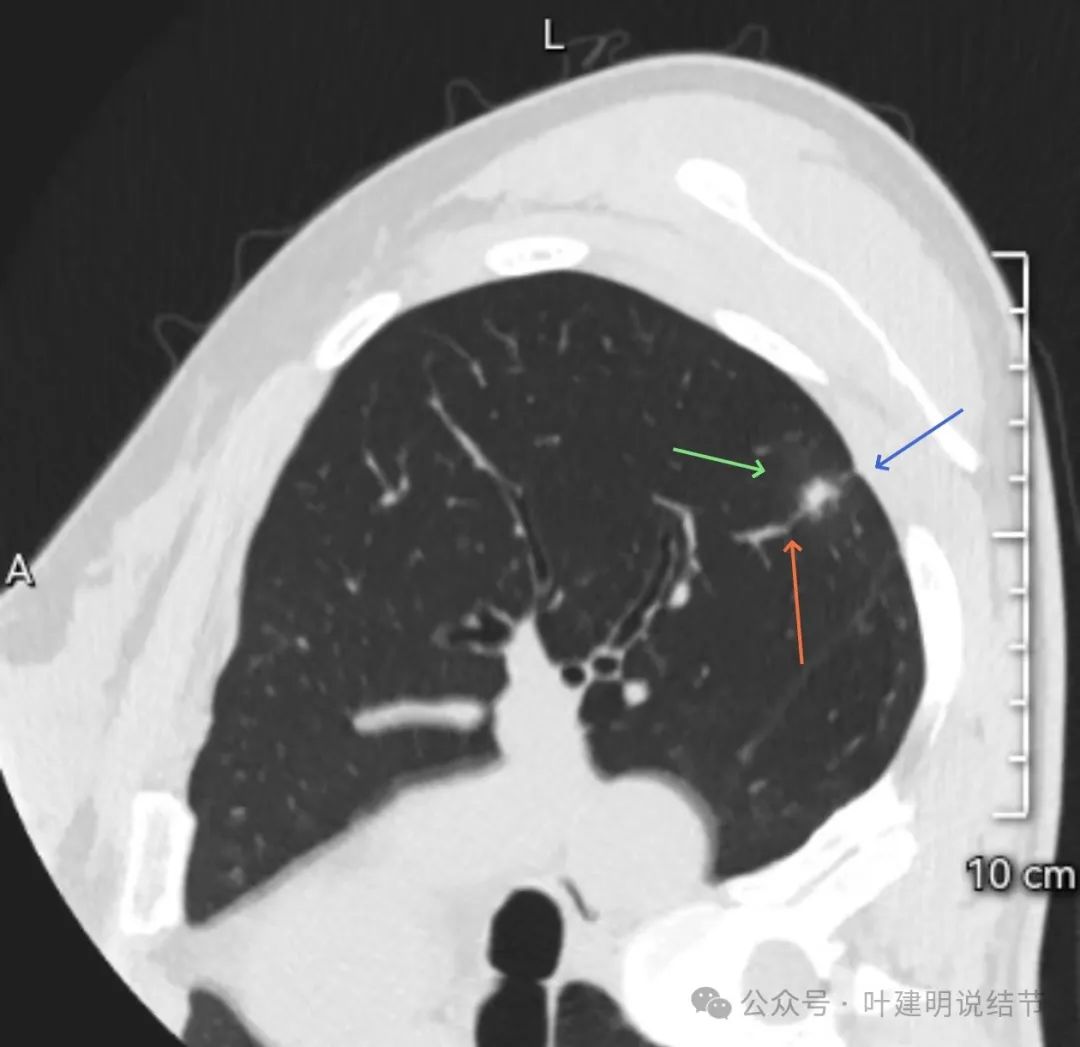
血管进入,病灶混合密度,灶内密度不均,轻微胸膜牵拉。
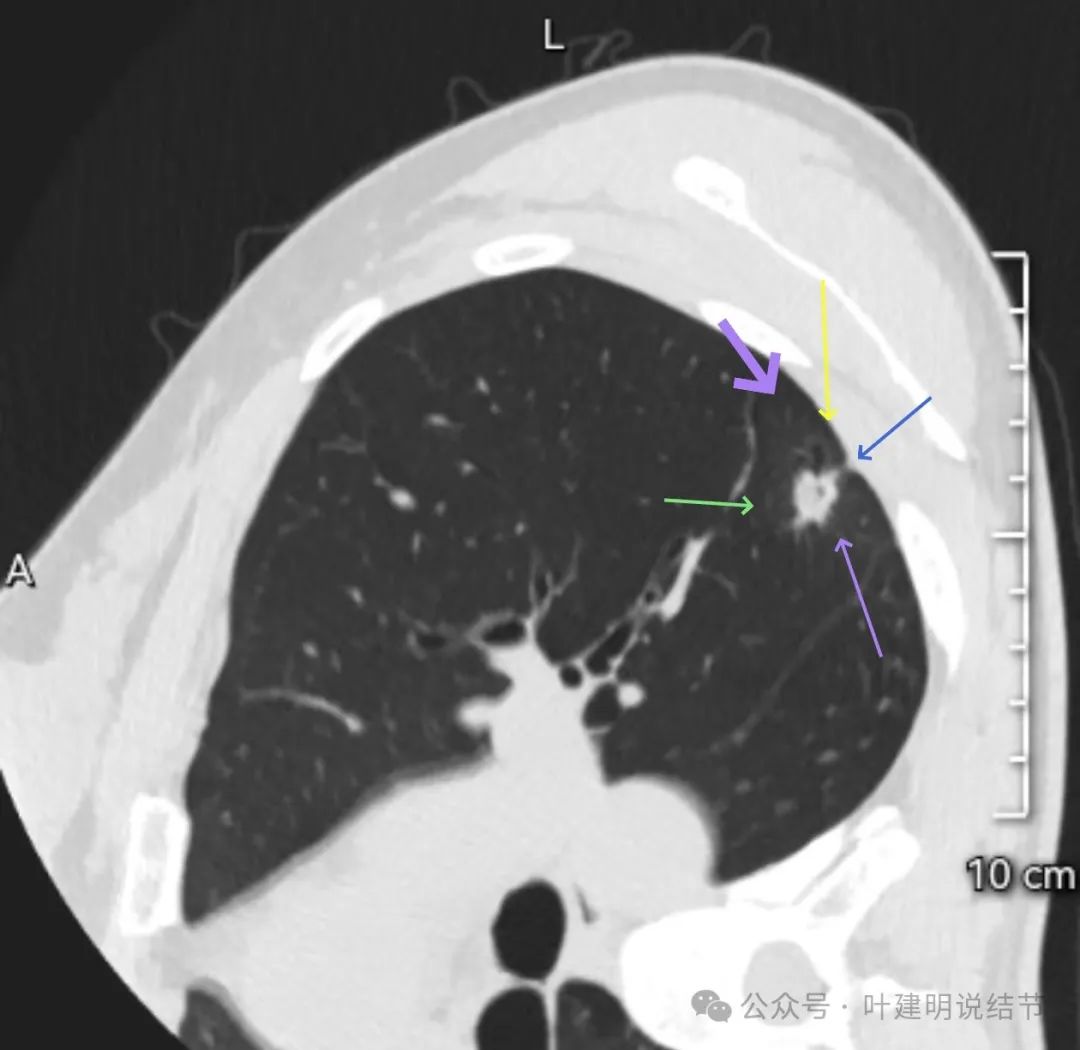
表面毛刺明显,而且不平分叶,囊腔出现。
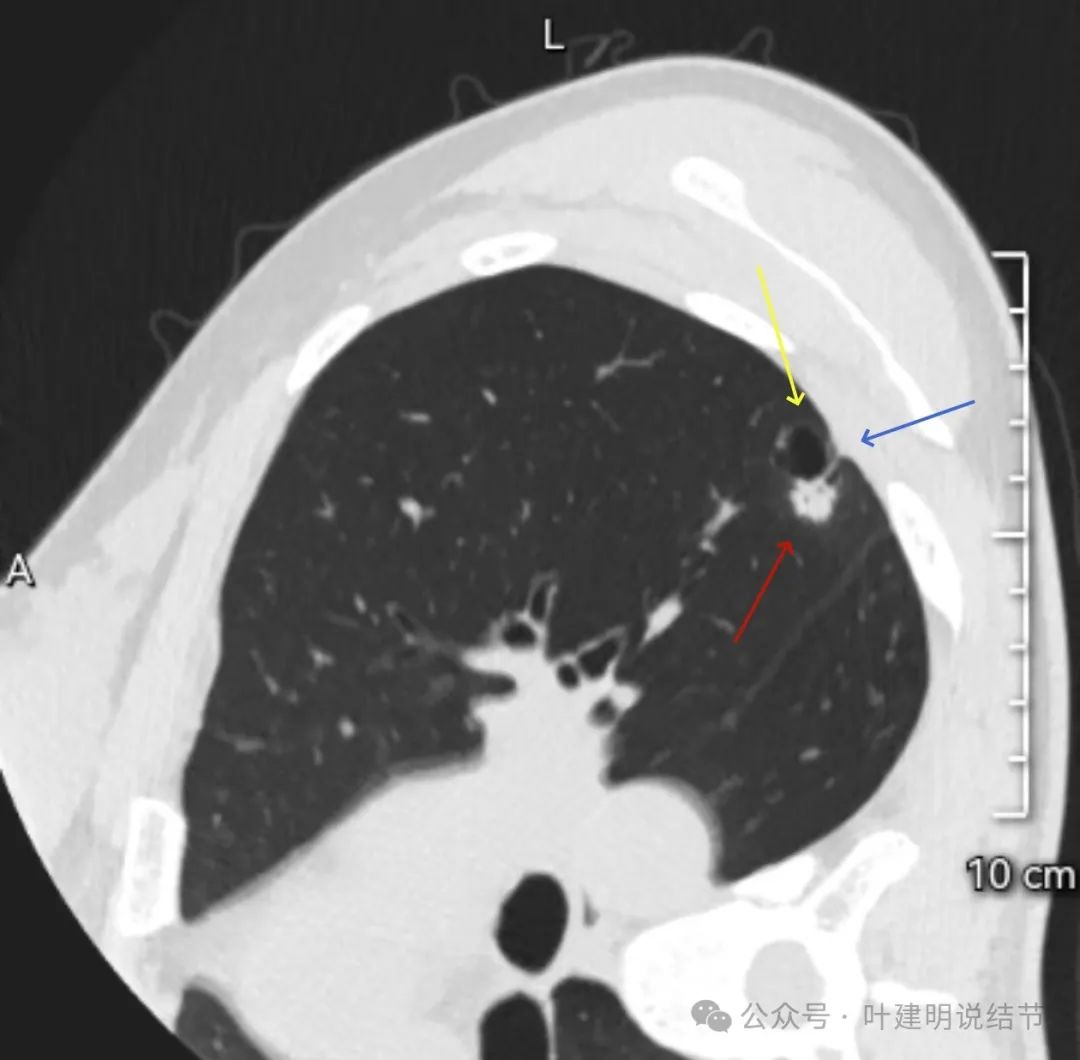
囊腔型病灶,实性部分密度高,不平,分叶与灶内空泡征,邻近胸膜有牵拉,整体囊腔轮廓与边界较清。
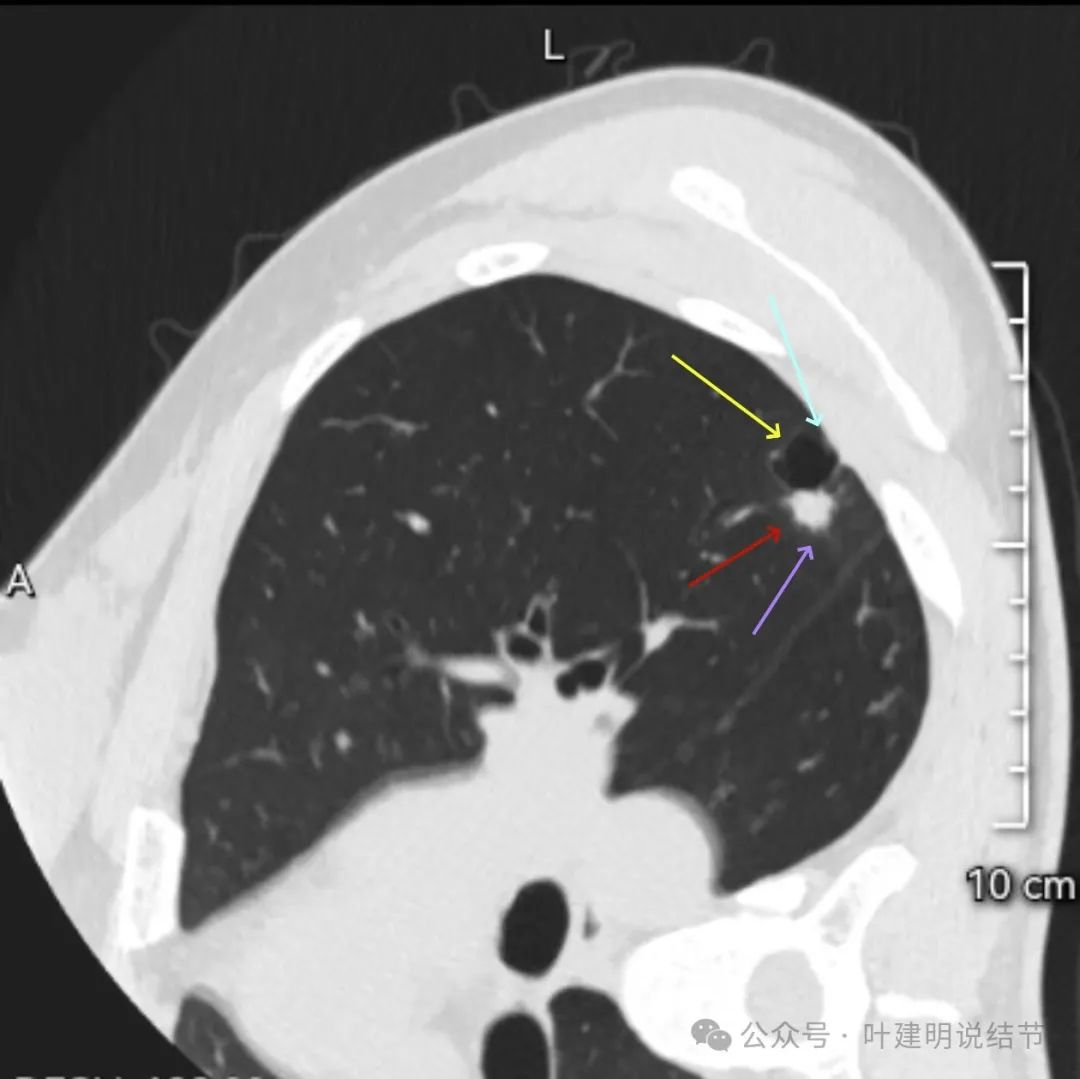
病灶与胸膜之间有间隙在,如果是炎性病灶,靠得这么近,一般胸膜要有粘连或增厚。实性部分表面不平有毛刺,囊腔部分形态不规则。
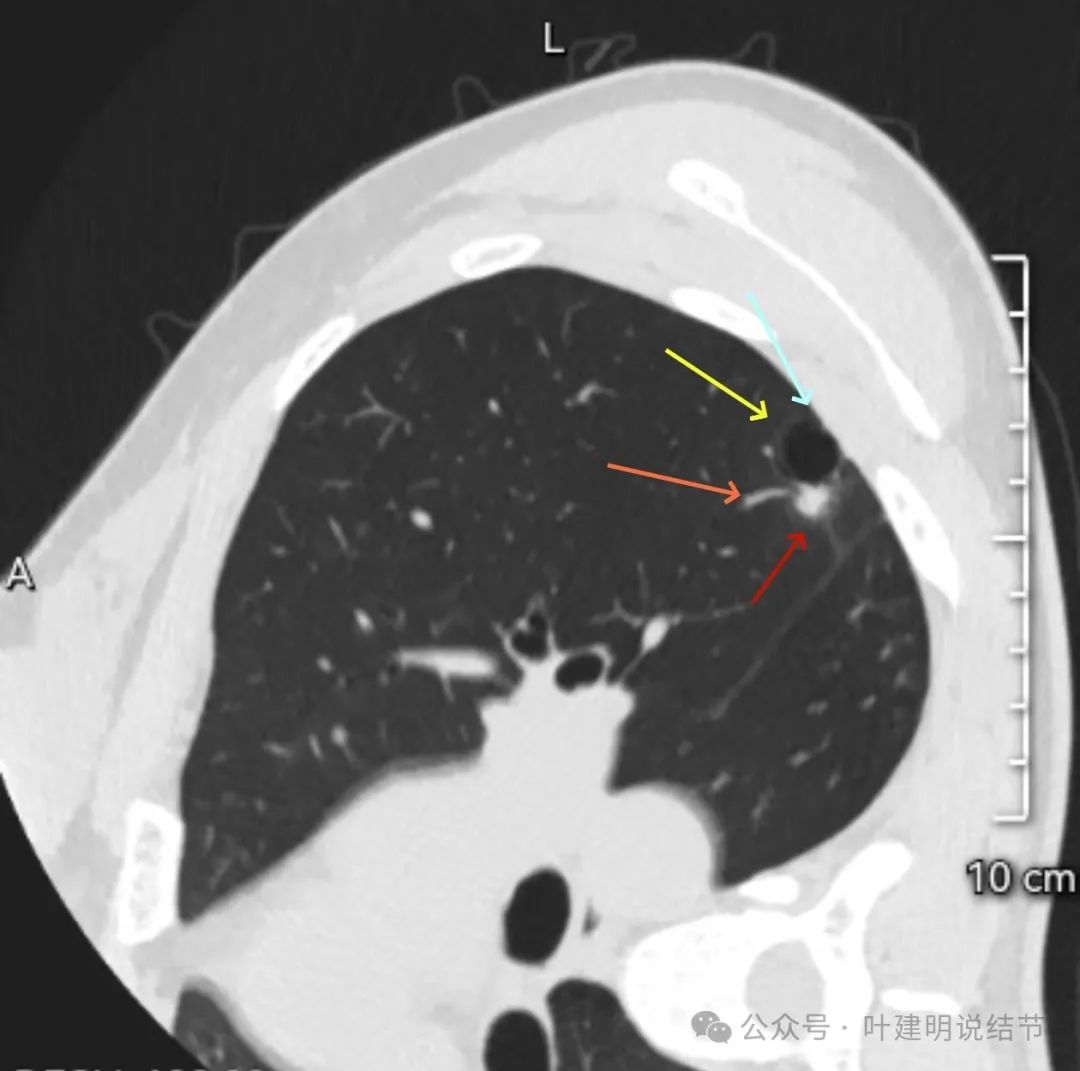
血管进入与囊壁磨玻璃部分稍不均。
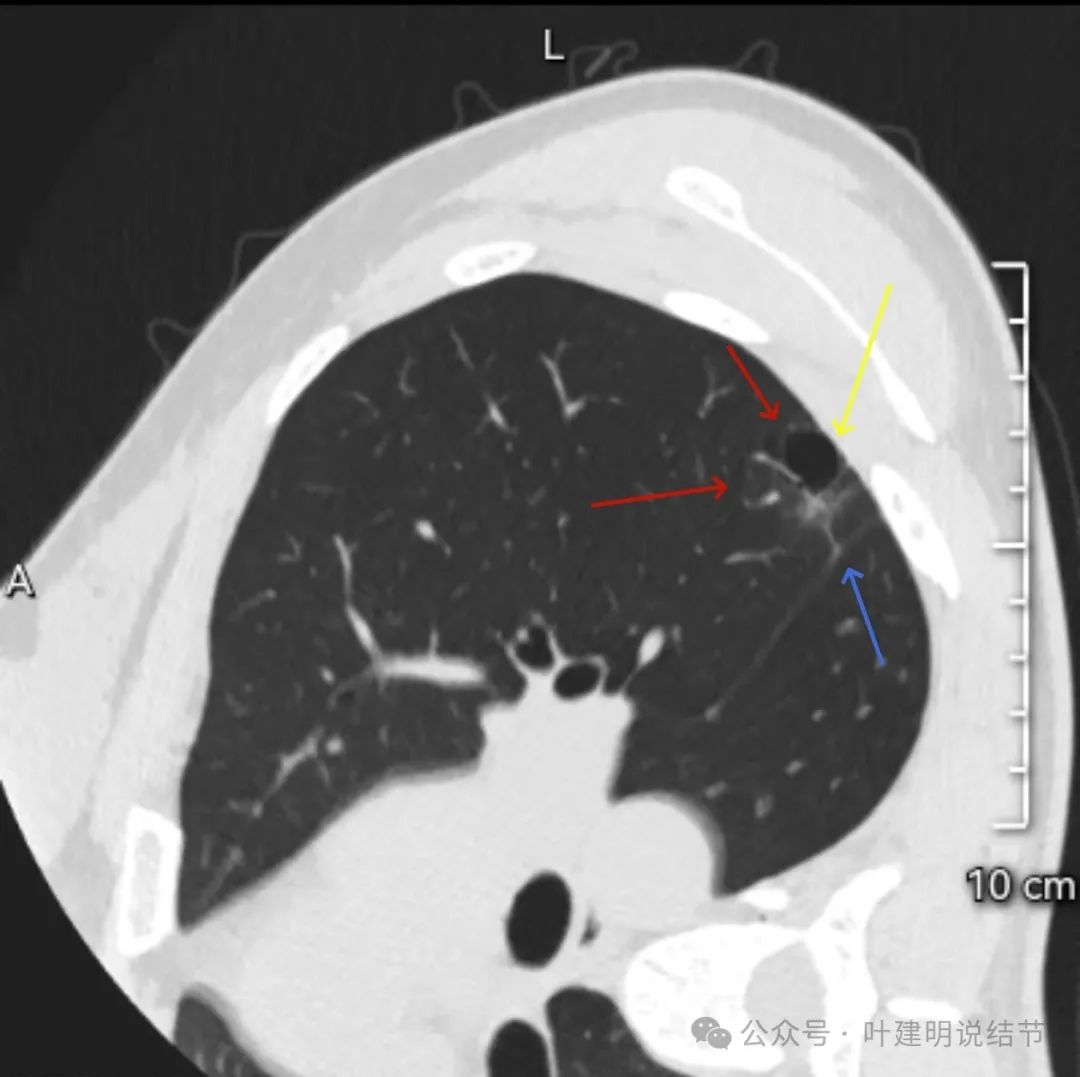
整体轮廓清,磨玻璃囊壁内有血管进入与穿行。
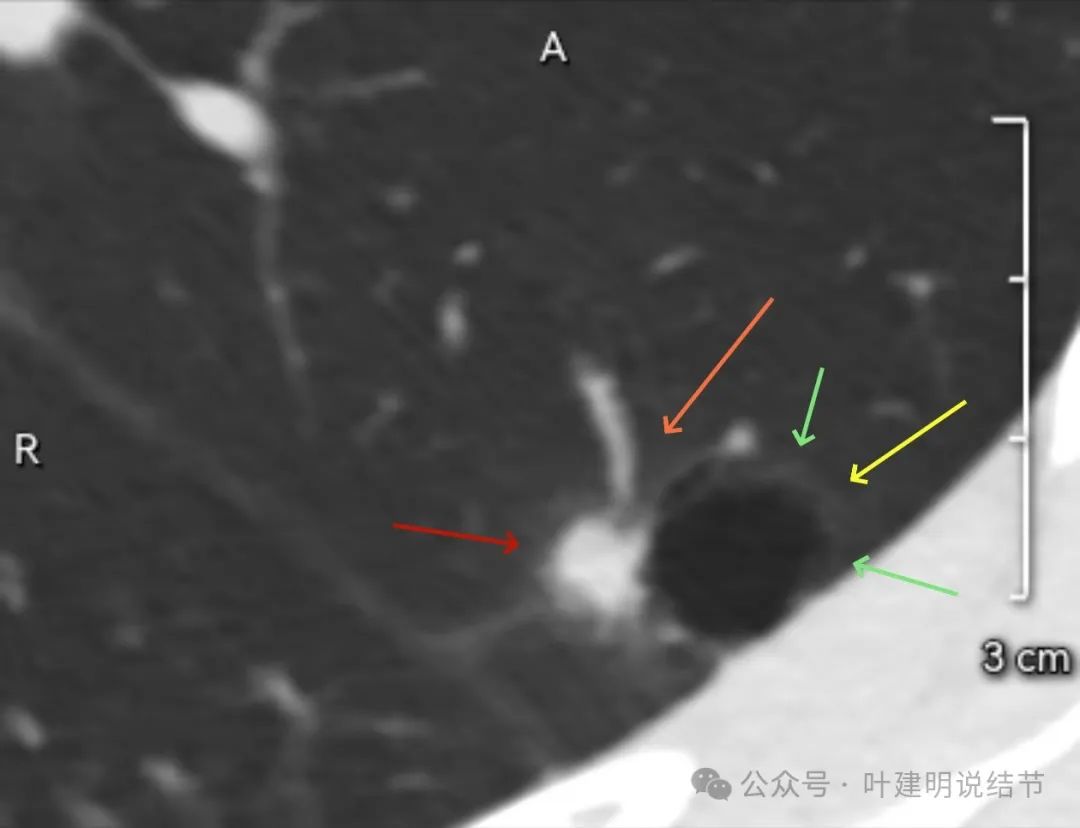
整体轮廓较清。分叶以及血管进入囊壁。
显示了明显的毛刺、实性密度部分不均质,邻近胸膜有受影响,囊腔明显;囊壁内血管穿行。
血管进入以及囊腔内壁不平。
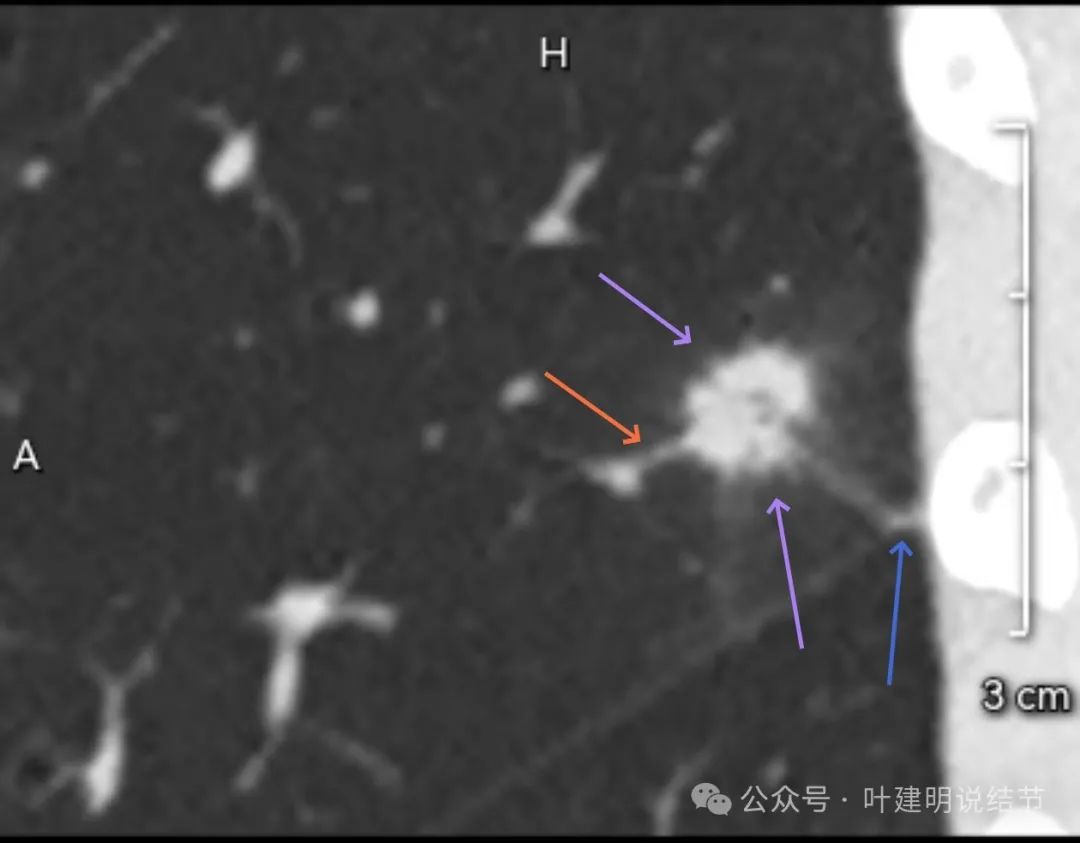
实性部分明显像板栗或杨梅似的,说明病灶有较强的浸润性或侵袭性。
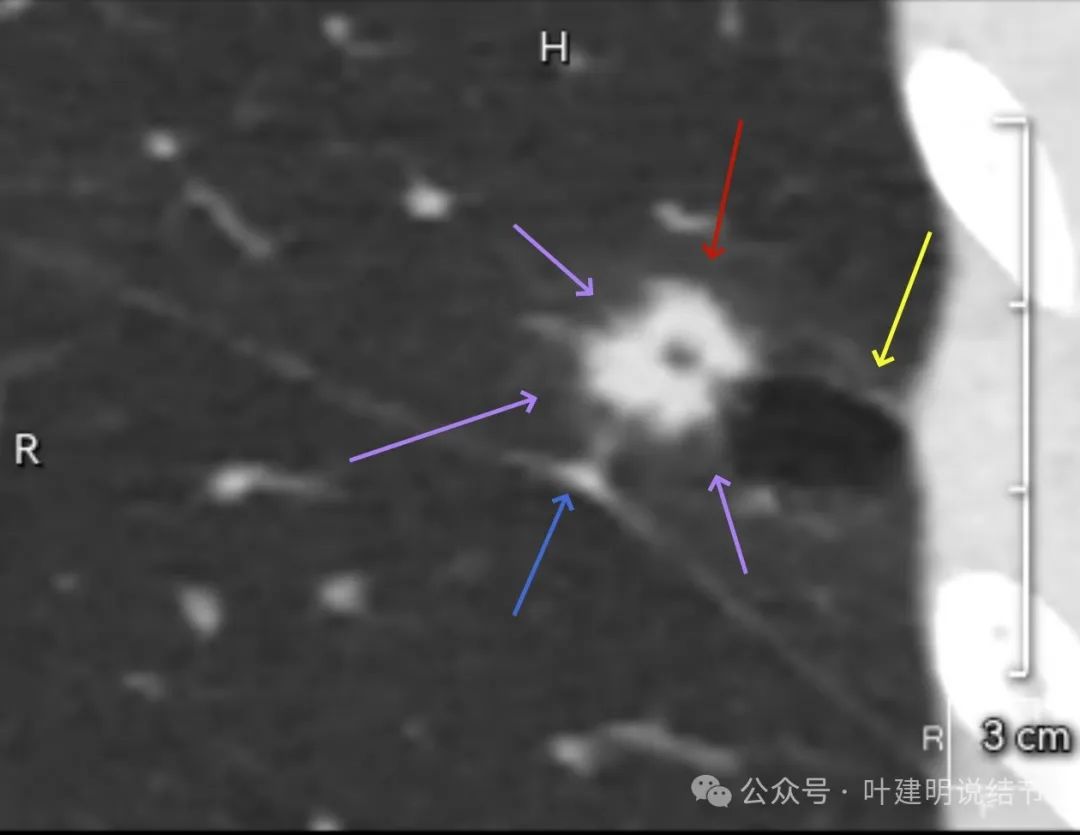
病灶表面不平毛糙,密度不均,囊腔壁不均,内壁欠光滑,叶间裂略有牵拉影响。
影像考虑:
这是非常典型的囊腔型肺癌,而且实性部分有许多恶性的影像特征,包括:混杂不均的密度、边缘毛刺与分叶、血管进入、灶内小空泡征,整体显得有较强收缩力;囊腔部分的囊壁是磨玻璃密度,内壁不光滑有棘突、囊壁有血管进入与穿行、磨玻璃部分的囊壁厚薄稍不均;整体轮廓较清楚,邻近胸膜受影响。不是特别典型的只是磨玻璃部分的囊壁密度感觉偏低了点,肿瘤性的磨玻璃成分要密度再高点多见。但此灶风险高,不能等,要及时处理。退一万讲,即使真切下来良性,也是由于位置在边上,能在术中先楔形切除,肺功能损失并不大,切了不亏。
(三)不同手术方式的指南表述或研究结果
1、中华医学会肺癌诊疗指南2024年版:
基本原则:
根治性外科手术切除(解剖性肺切除和纵隔淋巴结清扫或采样)是早期NSCLC的推荐首选局部治疗方式。
手术原则:
完整彻底切除是保证手术根治性、分期准确性、加强局控和长期生存的关键。
手术方式:
解剖性肺叶切除仍是标准术式(1类推荐证据)。LCSG821前瞻性研究结果显示,T1期肺癌肺叶切除的局部复发率明显低于亚肺叶切除,生存率显著高于亚肺叶切除,因此,目前早期肺癌的标准术式仍为解剖性肺叶切除(1类推荐证据)。
解剖性肺段切除:
CALGB140503研究:对于外周型、长径≤2 cm的NSCLC,在证实了肺门和纵隔淋巴结阴性后,亚肺叶切除5年无病生存率和5年生存率与肺叶切除相似,肺功能保留较之肺叶切除略有提高。
JCOG0802研究:对于外周型、长径≤2 cm、薄层扫描CT上实性成分占比(consolidation tumor ratio,CTR)>0.5的NSCLC,无复发生存肺段切除与肺叶切除无显著差异,总生存肺段切除优于肺叶切除。
JCOG1211研究:长径3 cm以内、CTR 0.5以下的磨玻璃影(GGO)为主的ⅠA期肺癌行肺段切除的疗效,结果显示患者的5年无复发生存率和5年生存率均达到98%。
楔形切除:
JCOG0804研究:对于长径≤2 cm、CTR≤0.25的早期肺癌,手术方式以楔形切除为主(82%),非浸润性肺癌占97.7%,5年无复发生存率达到99.7%,且无局部复发事件。
CALGB140503研究:亚肺叶切除组中肺楔形切除占比近60%,亚肺叶切除组5年无复发生存率和5年总生存率与肺叶切除组差异均无统计学意义。故在肺门及纵隔淋巴结评估阴性的情况下,肺楔形切除可以用于外周型肿瘤长径2 cm以内的NSCLC。
亚肺叶切除术可适用于以下情况(1类推荐证据):
(1)对于外周型、T1a~b、N0的含有磨玻璃成分的非小细胞肺癌,应强烈考虑进行亚肺叶切除术,首选肺段切除术;(2)对于外周型、T1a~b、N0但是肺功能储备差或者存在其他重大合并症不适宜进行肺叶切除术的高危患者,推荐楔形切除术,其次考虑肺段切除术。
我的总结:
1、早期肺癌的标准术式仍是解剖性肺叶切除(也就是说只要是肺癌,切肺叶都是符合指南精神的);2、外周型不大于2厘米,淋巴结阴性情况下,亚肺叶切除(其中60%是楔形切除)与肺叶切除效果相似;3、外周型不大于2厘米,实性成分占比大于50%的肺段切除与肺叶切除效果相似;实性占比不大于25%的楔形切除效果优秀;4、大小在3厘米以内,磨玻璃成分占比50%以上的肺段切除效果也是优秀。
结合此例考虑:
按照此指南意见,病灶不足2厘米(报告示1厘米,但未包括囊腔部分,而囊腔部分的磨玻璃成分部分密度过淡,风险并不大,关键仍是实性成分),如果淋巴结能证实阴性,按总结中的第2条亚肺叶切除(研究中60%是楔形)效果不劣于肺叶切除;按第3条,实性占比大于50%归类则是肺段切除效果不劣于肺叶切除。关键是如何证实淋巴结阴性?
指南中的淋巴结清扫标准中指出:
Ⅰ~Ⅲ期肺癌在术前规范纵隔分期未发现淋巴结转移(PET-CT或EBUS、纵隔镜检查阴性)的前提下,淋巴结清扫较采样并未明显升期或带来术后生存优势,但术前仅行常规影像分期(未行PET或EBUS、纵隔镜分期)者,仍推荐行淋巴结清扫(1类推荐证据)。
我的理解考虑:
这段话有三层意思:1、如果规范纵隔淋巴结分期阴性情况下,清扫或采样没有影响预后;2、规范淋巴结分期是指PET-CT或EBUS、纵隔镜检查阴性;3、常规分期的话不能认定是淋巴结分期阴性。
结合此例:
术前应该进行纵隔淋巴结分期,要么是EBUS或纵隔镜检查病理确认,要么是PET-CT检查认为没有转移。那么是否意味着如果给这位患者术前完善PET检查后没有肺门与纵隔淋巴结转移,那么肺段切除或楔形切除都是可以选择的,而且也是1类推荐证据。
2、国家卫健委原发性肺癌诊疗指南2022年版关于手术部分的表述
肺叶切除术被大多数胸外科医师认为是 I 期非小细胞肺癌手术切除的标准术式,而最近的临床证据支持对于直径不超过 2cm 的周围型 I 期非小细胞肺癌,尤其是纯磨玻璃样结节,肺段切除或楔形切除可能是更好的手术切除方式。随着回顾性报道的不断增多,对于以磨玻璃成分为主的外周型早期肺癌采用部分肺叶切除(肺段或者楔形切除)已逐渐成为胸外科的共识。最近大样本随机对照试验 JCOG0802 的研究结果显示, 对于实性成分大于 50%、肿瘤直径≤2cm 的外周型非小细胞肺癌,肺段切除 5 年生存率优于肺叶切除且肺功能保留程度 更佳。随着更多类似研究结果的披露,部分肺叶切除可能成为此类肺癌的标准术式。
结合此例:
按照卫健委的指南来说,标准术式也是肺叶切除,但基于JCOG0802研究,实性成分大于50%,肿瘤直径不大于2厘米,若选择肺段切除,5年生存率反而优于肺叶切除。所以选择肺段切除是可行的。
3、周围型临床T1aN0非小细胞肺癌的肺叶切除、肺段切除或楔形切除:CALGB140503(联盟)的进一步分析
入组标准:术前CT上存在实性成分且大小≤2厘米的周围型肺结节,推测或确认为非小细胞肺癌;CT扫描显示肿瘤中心位于肺外周三分之一,肿瘤位置适合进行LR(肺叶切除)或SLR(楔形或肺段)。
入组情况:在2007年6月15日至2017年3月13日期间,共有697名患者符合术前和术中的资格标准,并被随机分配到LR组(n=357)或SLR组(n=340)。最后根据实际进行的手术,362名患者接受了肺叶切除,131名患者接受了解剖肺段切除,204名患者接受了楔形切除。
研究结果:中位随访7年后,亚肺叶切除术后无病生存期(DFS)的主要终点并不低于肺叶切除术后。分别为63.6%和64.1% 。两组试验的关键次要终点总生存期(OS)相似。分别为80.3%和78.9% 。CALGB140503研究的后续进一步分析表明,楔形切除术和解剖性肺段切除术都是周围型T1a不伴有肺门和纵隔淋巴结转移非小细胞肺患者可接受的治疗方案,两组生存率没有显著差异。同时,进一步证明了亚肺叶切除与肺叶切除相比,在无病生存率的主要终点方面具有非劣性。
(四)亚肺叶切除中的肺段切除或楔形切除怎么选
基于前文相关指南或文献的精神,对于外周部位的不大于2厘米的早期肺癌,在淋巴结术前分期(要么PET-CT分期,要么纵隔镜或EBUS分期)阴性情况下,亚肺叶切除(包括肺段切除或楔形切除)是可以选择的,并不一定要行肺叶切除。那么这两种亚肺叶切除又该怎么选呢?当然从证据级别上,或者从本来是要行肺叶切除来讲,选择比肺叶切少点,比楔形切多点的肺段切除更容易接受,也更觉得心理踏实。但两者的真正区别在哪里呢?我们假定右上叶有一结节,位于可楔形切除的位置:
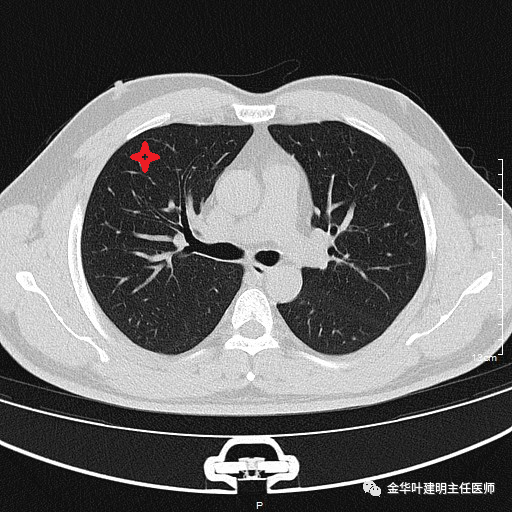
如果做右上叶楔切、右上叶前段切除以及右上叶切除,需要离断的地方分别如下:
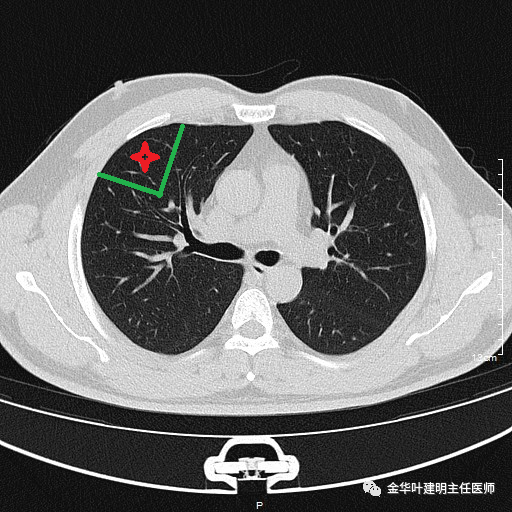
上图示局部楔形切除,绿色实线示大致的切缘
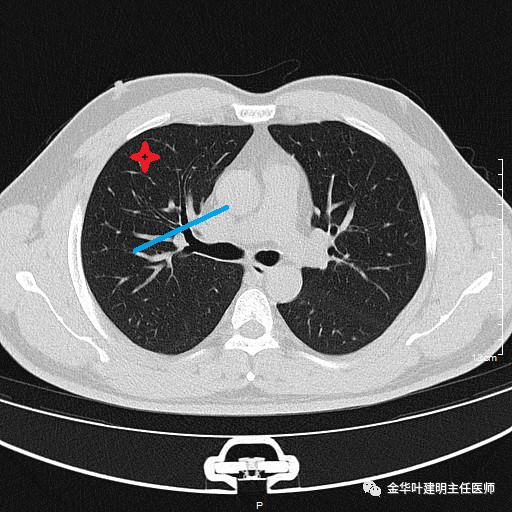
蓝色箭头示右上叶前段切除时拟切断的支气管处
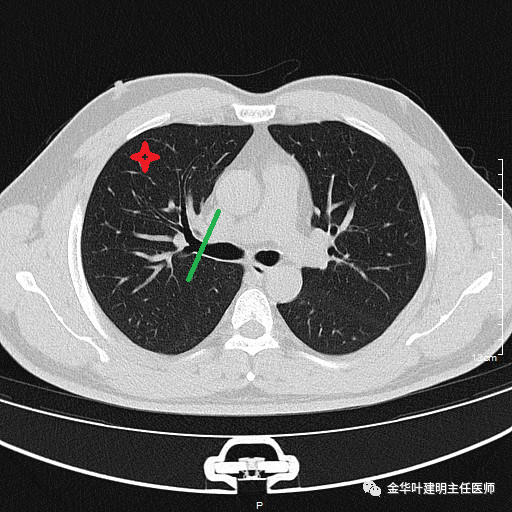
上图示右上叶切除时拟离断的支气管处
假如病灶确实只位于局部,没有肺内的气腔播散,也无肺门、纵隔淋巴结转移,也无第12-14组的淋巴结转移,那么以上三种手术切除的方式从治疗效果上来看显然是没有区别的。假如病灶影像上没有明显转移,实际上已经存在扩散(如果有影像上的转移,肺段根本不是适应证)而医生未知的情况下,则分以下几种:星形示原发灶,椭圆形示气腔内播散转移灶、菱形示转移淋巴结。
1、肿瘤存在隐匿的气腔内播散:如下图
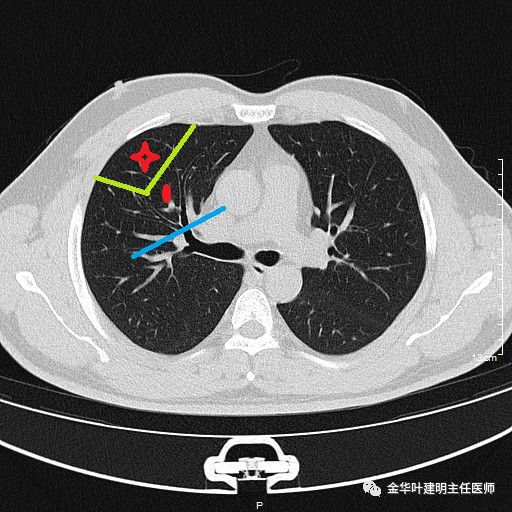
这种情况下,楔形切除时将主病灶切除了,但把转移灶留在了肺内,导致术后较短时间内的复发或出现新的病灶;而若按蓝色实线所示的切除肺段,则可达到完全的病灶切除,但已经存在转移的还是早期吗?还是符合亚肺叶切除的适应证吗?显然是不合适的!
2、肿瘤存在隐匿的肺内淋巴结转移(第12-14组淋巴结),如下图:
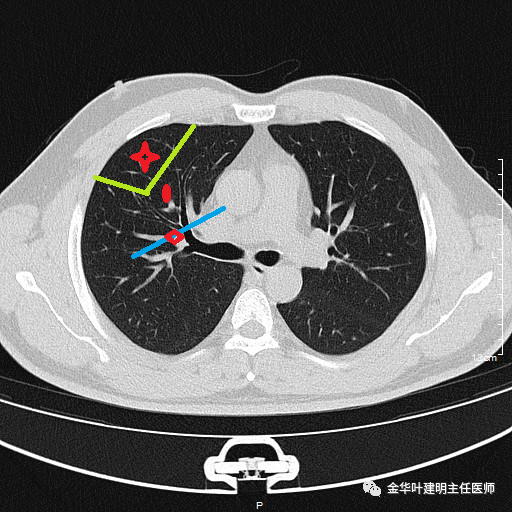
此时如果做段切除虽然能取到段门处的转移淋巴结,从而证实已经存在淋巴结转移,也就是俗话说中期的病人,你取到了又如何?若此处淋巴结阳性,还能结束手术吗?仍得进一步行肺叶切除。那么该段切就是多余的,重复了一些操作,多花了许多时间与器械。
3、肿瘤存在隐匿的肺门淋巴结转移(第10-11组)或者已经有纵隔淋巴结转移:如下图
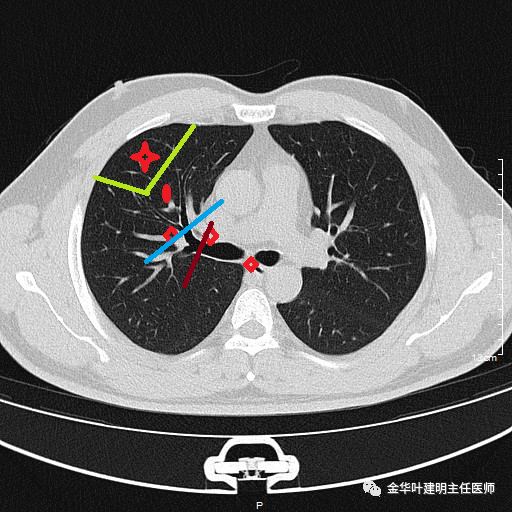
此时根本不是段切能解决问题的,即使叶切仍需后续的辅助治疗。当然更谈不上选择楔形切除。
我们不要循证依据,只要从逻辑上来推理,应该就是:如果没有转移的早期肺癌,楔切就够了;如果存在转移的肺癌,肺段反正也不够!所以在基于前面指南与文献研究的基础上,若属于早期肺癌,而且确实在事实上并无转移,那么楔形切除就可以的!
(五)今天分享病例的选择
经过与患者的充分沟通以及不同术式选择的利弊分析,最后在征求患意见的基础上,决定:术前完善PET-CT的淋巴结分期,若淋巴结未提示转移,选择了单孔胸腔镜下左上叶楔形切除加淋巴结采样;如果存在淋巴结转移,术中先楔形切除送快速切片确诊肺癌后行左上叶切除加淋巴结清扫术。主要还是觉得患者年纪太轻,病灶位置太边上,如果事实上并无转移或扩散,切除病变组织以外的正常肺组织实在觉得可惜。不单并发症发生率增高,也有一定的中转开胸概率,最主要是术后肺功能、生活质量以及后续的职业晋升等都可能受影响,而若楔形切除恢复快、风险小、肺功能几乎无影响,与正常人差别并不大。
结果PET-CT未提示考虑肺门及纵隔淋巴结转移。
手术标本展示:
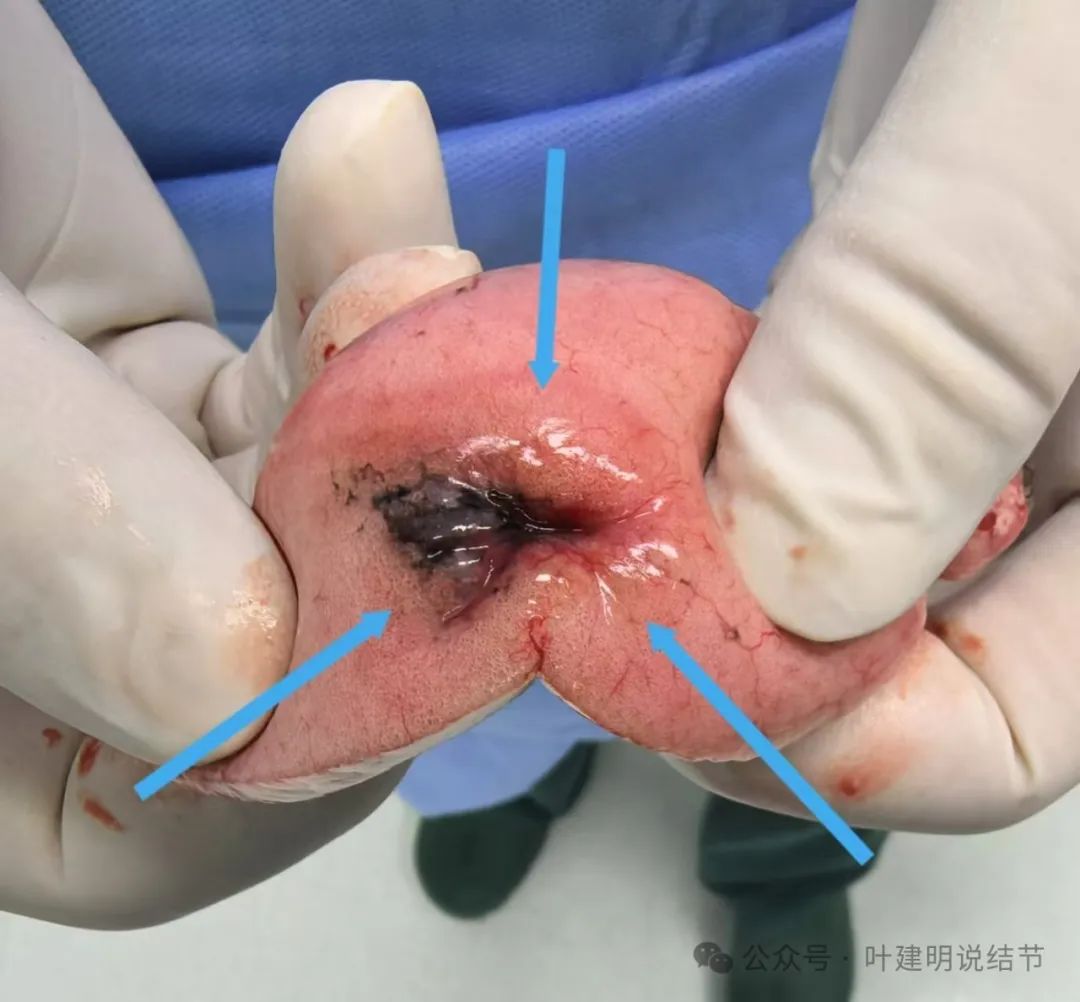
表面胸膜皱缩,质地较硬。
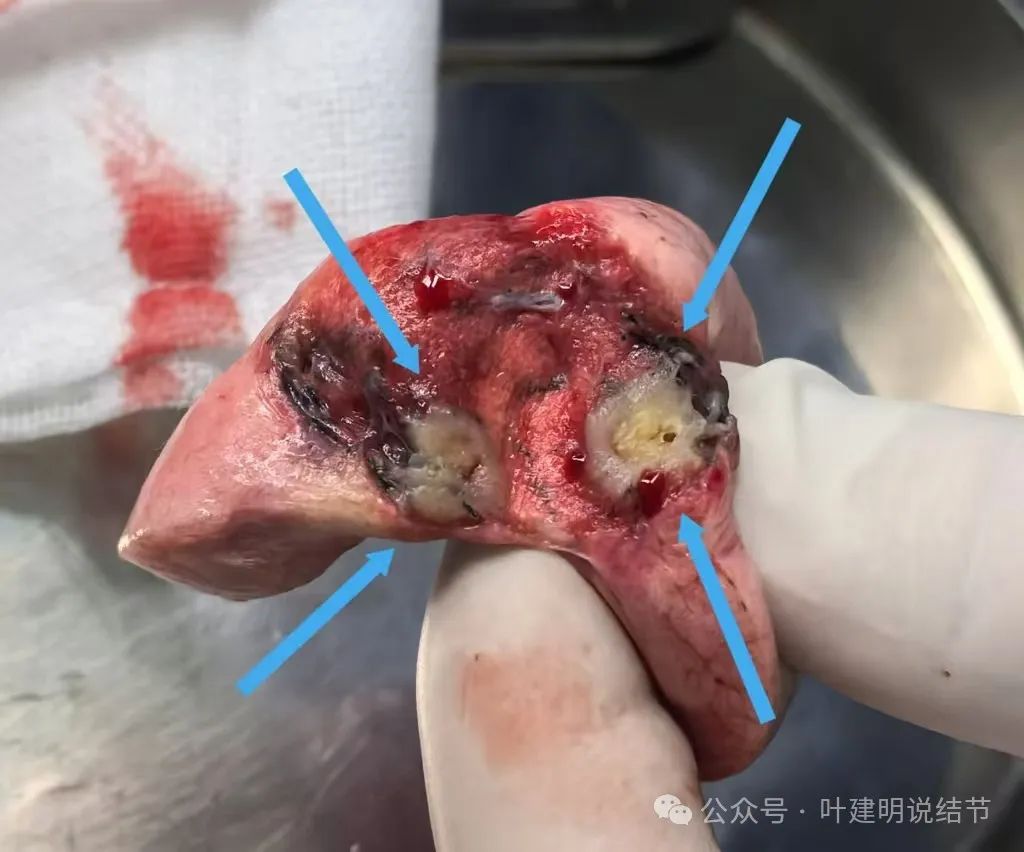
剖面灰白,中间怎么有干酪样坏死成分似的。切除的肺组织很少,当然切缘是阴性的。
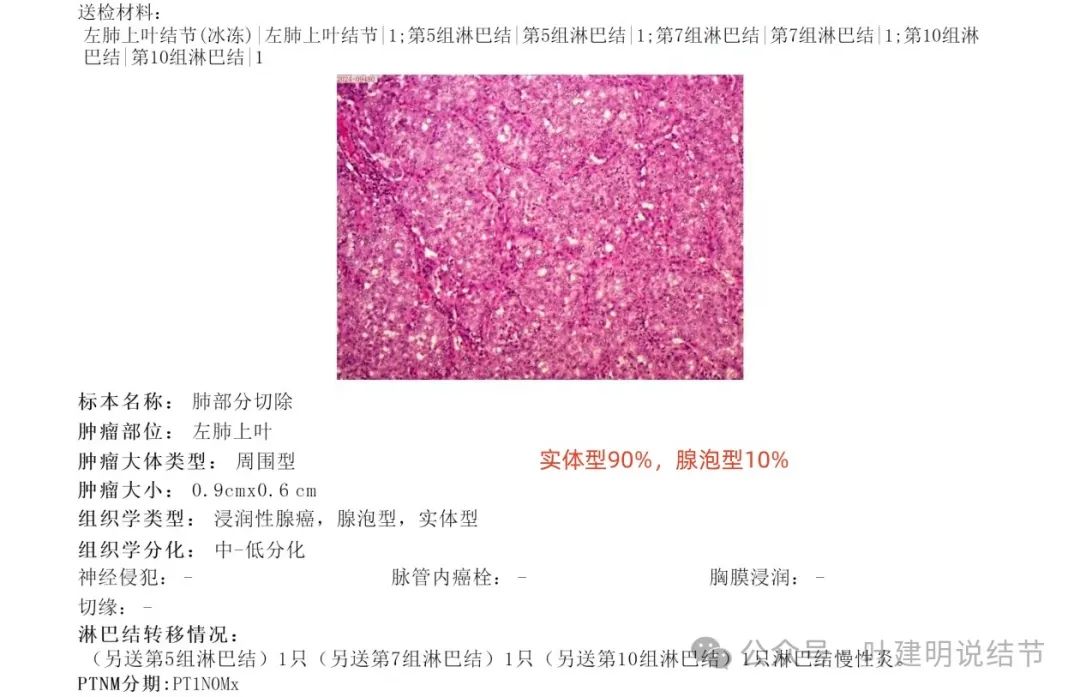
术后病理意外的报浸润性腺癌,实体型占90%,腺泡型占10%!术前我也认为几乎肯定是浸润性腺癌,而且恶性程度不低,因为实性为主,磨玻璃成分过淡,但当时考虑应该乳头型为主,伴少许贴壁,或有少量高危的微乳头或实体型,但真没想到实体型居然占到90%,还没有报含有贴壁亚型。
(六)术后病理低分化,高危亚型占比达90%,需要再次升级切肺叶吗?
我们前面的指南或文献的表述并不区分病理亚型,而是肿瘤大小以及实性成分占比,所以基于之前分析与考虑,其实是不必考虑最后的病理类型的。但毕竟高危亚型总让人感觉不放心。那么从逻辑推理与分析上来看,事实上就是有以下两种情况:
1、事实上存在血行微转移:这种情况下,并不是早期肺癌,而是相当于伴有远处转移的4期患者,只是目前的影像学检查无法查出远处器官的转移灶而已。在随访过程中出现转移灶是必然的,只是时间迟早的问题。若予以升级手术,行肺叶切除显然并不能解决远处微转移的问题;
2、事实上不存在转移:这种情况下,虽然病灶是高危低分化类型,但病灶已经切完整切掉了,就是治愈。术前PET也没有查出有转移灶,再去切除余下部分的左上叶有何用?
当然还有一种情况,肿瘤正好已经转移到第12-14组淋巴结,但它没有入血,也没有往肺外扩散,只是停留在淋巴结内。当然影像或肉眼是看不出来的,那么将整个上叶切了恰好一并切除了。但谁能认为全身的血液淋巴永不停歇的在循环,就这么巧,癌细胞就从淋巴结管到了引流的淋巴结,而又没有顺着淋巴结再往近心端去?这是钻牛角尖的思维方式。所以我的相法是:如果患方觉得不放心,升级行肺叶切除加系统性淋巴结清扫是可行的,但个人觉得意义有限,很可能只是徒增创伤而已。
(七)术后需要辅助治疗吗
我们来看Ⅰ~ⅢB期非小细胞肺癌完全切除术后辅助治疗指南(2021版)的说法:
辅助化疗:是目前应用最为广泛的辅助治疗手段。鉴于化疗药物的副作用较大,而辅助化疗能够带来的生存获益相对有限(5年生存率提高约5% ),NSCLC患者肿瘤完全切除术后进行辅助化疗前需评估患者分期、体能状态、个人意愿、生活质量,并充分评估各脏器功能,包括肺功能、心功能、肝肾功能等,综合评估辅助化疗的收益和风险。
靶向治疗:NSCLC中特定信号通路尤其是酪氨酸激酶的基因突变是肿瘤发生发展的重要因素,针对肿瘤细胞中存在这些驱动基因突变的患者进行相应靶向治疗是晚期肺癌治疗的重要手段,且相比传统的化疗能够显著改善此类患者预后。既往靶向治疗的研究主要聚焦于晚期NSCLC患者,但近年来陆续有研究发现针对EGFR突变的靶向治疗在早中期NSCLC患者肿瘤完全切除术后的辅助治疗中同样具有重要作用。
指南推荐:EGFR突变阳性的ⅠA期NSCLC患者肿瘤完全切除术后定期随访,不推荐进行辅助化疗(1类证据,推荐);EGFR突变阴性的ⅠA期NSCLC患者肿瘤完全切除术后定期随访,不推荐进行辅助化疗(1A类证据,推荐)。
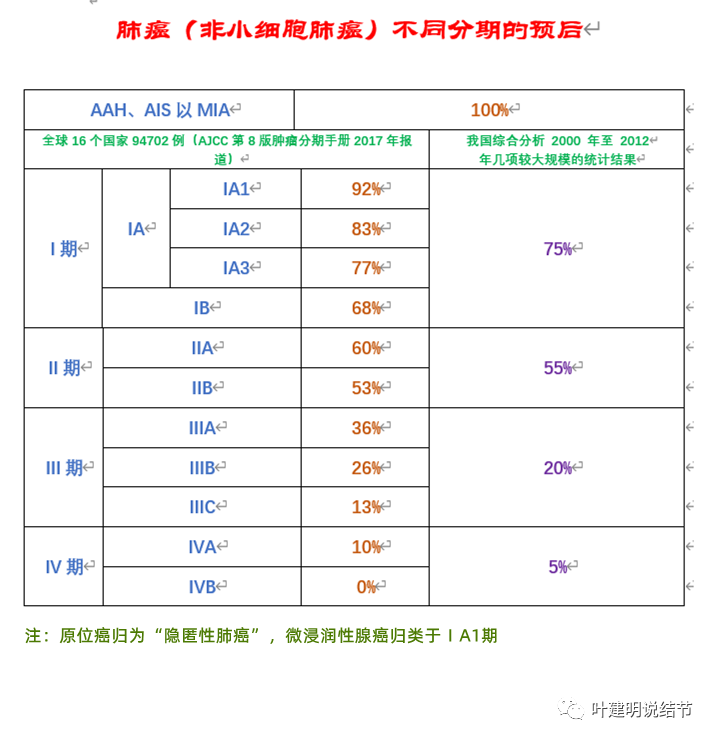
结合此例:其实仍然回到是否存在微转移的关键问题上来,如果事实上没有微转移,它就是真的1A期,当然就不需要术后化疗或辅助靶向治疗;如果事实上存在微转移,它就是“伪”早期,其实是4期,那么术后的辅助治疗,不管化疗或靶向治疗能治愈4期的肺癌吗?显然并不能够!这也是我之前分析的为什么在传统肺癌当中,许多术后分期在Ⅰ期NSCLC患者仍会在后续的随访中出现复发或转移。我们来看2022年版卫健委指南上甚至说我国综合分析2000年至2012年几项较大规模的统计结果:1期肺癌的肺癌5年生存率也才75%!
按理说肿瘤在局部,没有淋巴结与远处转移,又手术完全切除了,切缘阴性。怎么可能再转移呢?癌细胞是从哪里、以什么途径去到全身的呢?因为转移的方式包括:1、直接侵犯:术中并没有侵犯呀;2、淋巴转移:清扫的淋巴结均阴性的呀;3、血行转移:术前全身检查评估都没有转移的呀;4、种植转移:术中胸膜上也没有病灶呀;5、气腔播散:播到同叶,已经被切除,也不可能播到颅内、对侧肺或远处脏器去呀。无法解释得通!到底是为什么术后分期是早期的,却仍会转移或复发?个人一直认为有且只有一种可能:手术时肿瘤已经远处转移了,只是目前的医疗检查手段无法查出来而已!就好像我们路过某块田地,即使庄稼的种子已经撒到里面,当秧苗还没有长出来时,我们无法判断地里是不是有播过种。而下一场雨或天气适合,一夜之间苗就会长出来!我认为这就是早期肺癌会复发转移的秘密。同样的解释可用于术后辅助靶向治疗或化疗为什么对有些早期肺癌有无复发生存的获益,为什么化疗总体只提高5%的五年生存率,因为真正起作用能获益的就是这类“伪早期”的病人呀!所以给予术后辅助治疗后,他们原来是2年要检出转移灶的,结果到了3年或4年才被检出,那不就是表明治疗有效了嘛!其中真正早期,切了就是治愈了,何来获益?
(八)周围型小肺癌实性术后病理高危只楔切,后续怎么办?
今天分享的这个病例,要我确实必无微转移,我当然无法保证。那么再切肺叶不建议,术后辅助治疗又不建议,难道就定期随访?万一出现复发转移怎么办?会不会耽误治疗?就如前面说的,分真早期与伪早期,真早期本来只需随访,伪早期本来就必会迟早出现转移。
可以考虑的后续措施:
1、可以考虑MRD检测:但MRD平均只是可以提前约270天预警肿瘤复发时间。若真要复发或转移,没测MRD,迟点也要出现的。但本例患者如果做MRD检测与监测,阴性时能解除心理上的压力,也是有一定益处的;
2、更个性化的术后随访监测:早期肺癌术后,指南的随访意见比较笼统,我曾经比较过不同指南或共识的不同推荐意见,总结出方便记忆的《叶建明说结节》版随访间隔。
今年上面的表格,此例是浸润性腺癌实性密度或混合密度实性为主,所以前2年是半年胸部CT平扫或增强并肿瘤标记物检查,每年在胸部CT检查与肿瘤标志物基础上,再加上腹部CT或彩超,头颅增强MRI,全身骨扫描或PET检查。而此例鉴于高危亚型为主,所以可以相对综合随访间隔,比较第1年3个月按方案A,6-9个月按方案B复查。但此例术前肿瘤标志物并无异常,所以复查时查这指标其实意义不大的。
3、病理会诊:这个病例实体型占比如此高,但淋巴结没有转移,影像上也不是收缩力非常强或很致密的那种,而且有囊腔,有淡磨玻璃成分,病理上却未报含有贴壁亚型。个人觉得还可以病理会诊一下,会不会有不一样的亚型占比,这也是可以考虑的问题,毕竟病理也是人看的,虽然病理诊断是金标准,但不同病理科医生给出的病理诊断的不一致性是真实存在的。若其实存在贴壁成分,那明显心理上放松多了!
感悟:
临床医生的疾病诊疗,如果都只看指南共识,按教科书上的来生病,那就简单了,谁都能当医生,至少原则上都不会错,甚至非医务人员,结合理论与检查结果也能定方案。其实真正难的就是如何将临床经验、每个个体的临床表现与资料和指南、共识、文献报道、教科书等结合起来,用心做到个体化、个性化的诊疗,并站在患者为中心的立场,权衡不同措施与方案的利弊,从而采取不同的治疗手段。我无法说自己的选择是最为正确与科学的,但至少我们考虑的出发点是希望对患者最为有利的,而且将不同选择的利弊与可能的后果与患方充分沟通,由患者与家属自主选择何种治疗方案。今天的这篇病例分析文章花了很多时间来码字,肩膀酸胀,眼睛模糊,但我觉得是非常有意义的一篇探讨文章,值得大家仔细阅读与分享给更多结友或同道,也感谢大家为肺癌诊疗与科普宣传做出的努力。
猜你喜欢
- Neuron:上科大生命学院胡霁组与合作者揭示痛痒分离表征与调控的新机制
- Eur Urol Oncol:膀胱内VPM1002BC治疗常规BCG治疗后的非肌层浸润性膀胱癌(NMIBC)复发
- 豆角煎鸡蛋的做法-家常味煎菜谱
- 关于儿童鼻窦炎的诊疗,这篇讲的很全面!
- 庆阳市人民医院医用吊塔等医疗设备(二包)第三次招标公告
- 喝茶减肥需要注意什么?春季喝茶减肥的禁忌
- 【会诊回顾】兰州中研专家会诊解祛白难题,名医讲堂传递康复新方式
- 刺老芽的作用与功效 吃刺老芽的好处有哪些
- 莲藕的功效与作用,这五个女人吃莲藕的好处
- 【论著】| 局部晚期食管鳞状细胞癌患者新辅助免疫治疗联合化疗后行根治性手术的术后病理学缓解程度及影响因素分析
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)