首页 > 医疗资讯/ 正文
介绍
负压性肺水肿(NPPE)是由胸腔内负压迅速升高引起的非心源性肺水肿,可因急性或慢性上气道梗阻而发生,可导致危及生命的低氧血症;上气道梗阻可由多种潜在因素引起,包括喉痉挛、异物及气管插管等,导致呼吸困难,当患者呼吸时,毛细血管产生负压,肺毛细血管液体渗入肺泡和间质,导致肺泡和间质水肿。
病因学
急性气道梗阻 在成人患者中,导致NPPE的气道梗阻最常发生于拔管后喉痉挛,大多数儿童病例是由声门、急性传染性喉头炎或会厌炎引起的声门下梗阻,在这些儿科病例中,由于声门或声门上梗阻,伴长喘鸣和肺水肿而出现呼吸衰竭,通常在机械通气后才确诊。 慢性气道梗阻 慢性上气道梗阻,在具有多种潜在因素的患者中很常见,包括肥胖、梗阻性睡眠呼吸暂停、扁桃体或腺体肥大、上气道肿瘤、纵隔肿瘤、鼻咽肿块、甲状腺肿和肢端肥大症。
发病机制及病理生理特征
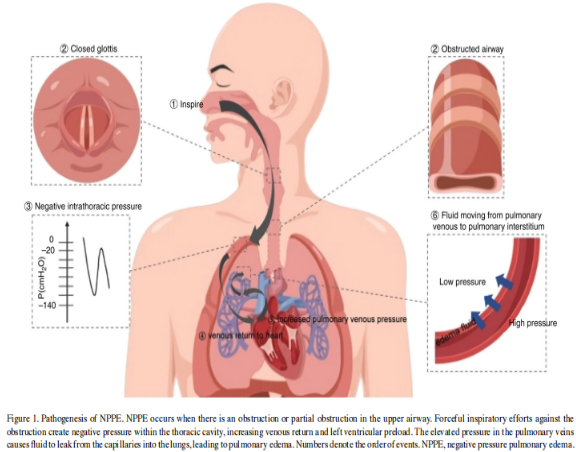
发病机制主要有两种,静水压型肺水肿和通透性增加型肺水肿。
-
静水压型肺水肿:NPPE是由胸腔内压力变化引发的液体明显转移引起的(图)。
-
通透性增加型肺水肿:严重机械应力引起肺泡上皮和肺泡微血管膜破坏,导致肺毛细血管通透性增加和富含蛋白的肺水肿。
区分:急性肺损伤患者的肺泡上皮屏障,过滤肺泡水肿液体的能力通常会受损,而静水压性肺水肿则不会,因此测定肺水肿液体/血浆蛋白比值,区分这两种肺水肿 Starling理论 Starling理论是描述液体通过肺毛细血管内皮-肺泡壁屏障这一过程的重要理论。生理条件下,当流体静水压处于平衡状态时,从毛细血管流向肺间质的初级血浆液量很少,然后液体被淋巴管再吸收,然而当组织间液生成多于再吸收时,即形成水肿。 Müller试验 Müller试验是在声门关闭后尝试强迫吸气,这一行为可显著增加胸腔负压,肺血管周围和肺间质内压力也可通过周围结构压力传递而显著降低。 心室前负荷和后负荷 胸腔内压力的降低传递到肺间质,最终导致回流到右心房的静脉血流量增加。右心负荷增加导致肺血容量、肺毛细血管静水压和毛细血管静水压力梯度的增加,促进了肺水肿形成。相比之下,胸腔内压力的降低会增加左心室后负荷,增加左心室舒张末期容积和压力。降低了左室射血量和射血分数,最终导致肺微血管压升高。
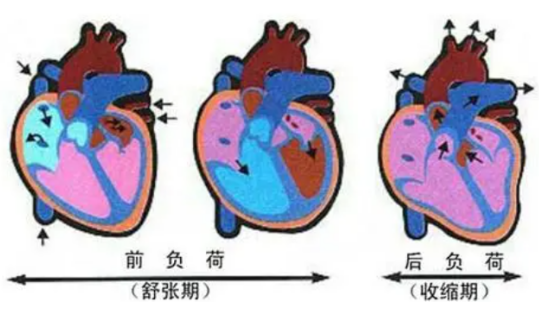
心室间依赖 静脉回流增加导致右心室充盈增加,将室间隔挤向左心室,导致左室容量和顺应性下降(“心室间依赖性”),最终导致左室舒张末压升高。胸内负压增加了左心室和主动脉之间的压力梯度,从而增加了左室后负荷。
肺毛细血管通透性 在胸腔负压情况下,肺毛细血管通透性增加,一般当肺血管顺应性较低时,肺血容量增加会改变膜的通透性,甚至破坏膜的完整性,最终导致体液和血细胞渗入肺泡。
低氧血症和高肾上腺素能状态 伴随上气道梗阻的低氧血症和高肾上腺素能状态可导致肺水肿。缺氧和代谢性酸中毒(发生在缺氧时,由于无氧代谢、循环受损或氧利用受损)导致肺微循环血管收缩,增加肺循环阻力,从而改变肺毛细血管渗透能力,抑制心肌功能。 交感神经系统兴奋性的增加导致循环集中和全身血液向肺循环运动,从而增加肺微血管压。高肾上腺素能状态也能改变肺毛细血管壁的完整性。肾上腺髓质儿茶酚胺的强烈释放,导致肺毛细血管膜通透性和肺微血管压力增加,目前认为是肺水肿的主要致病机制。
临床表现
症状
-
上气道梗阻症状包括喘鸣、呼吸窘迫、胸部反常运动和呼吸时辅助呼吸肌的参与。
-
急性肺水肿的临床表现包括呼吸困难、呼吸急促、发绀、哮喘和产生大量粉红色泡沫状痰。
疾病进展 延迟起病的病例很少见,但有报道在上气道梗阻后1~6小时发生肺水肿,由于临床表现严重程度的多样性,一些轻微的病例可能未能识别,病情严重程度与梗阻持续时间和肺毛细血管损伤的程度有关。 症状消退 一旦气道得到保护,气道负压就可通过正压机械通气缓解,肺泡或间质水肿的影像学分析表明,NPPE通常在12~24小时内消退。有时NPPE消退需要更长时间,这与肺微血管损伤的程度有关,多数情况下NPPE会在12~24小时内缓解。 NPPE的后果 部分NPPE患者可能出现长期并发症,如心肌梗死、短暂性脑缺血发作、非ST段抬高型心肌梗死、低氧性脑损伤和肺出血,少数可能死于感染性休克和心脏骤停等。 (
鉴别诊断
(NPPE应区别于下面疾病,治疗方法与NPPE不同。
-
胃内容物误吸:如果排除NPPE,首先应考虑胃内容物误吸和继发肺炎。
-
急性呼吸窘迫综合征(ARDS):根据患者危险因素,必须排除ARDS。ARDS主要由肺泡和肺组织的炎症和损伤引起,导致肺血管通透性增加,液体渗漏到肺泡中。NPPE是由于上气道梗阻导致肺部负压,导致液体积聚和肺水肿,快速的临床改善也有助于确认梗阻后NPPE的诊断。
-
高血容量:可以测量中心静脉压和肺毛细血管楔压,来解释循环高容量的可能性,治疗方法包括限制液体量(确保减少液体摄入,或与液体出量平衡)、扩张血管和使用利尿剂。
-
心脏功能异常:必须排除心脏功能不全的诊断,特别是对于既往有心脏病史或有显著心脏危险因素(如高血压、糖尿病、肥胖和年龄)的患者,NPPE常显示明显的双侧肺门周围肺泡浸润,心源性肺水肿浸润更倾向于间质性,典型表现为明显的肺血流分流。
治疗方法
通气支持
-
治疗NPPE的主要方法是保持气道通畅和氧气支持。
-
通常需要气管插管开放气道和机械通气支持,严重肺水肿通常需要在手术室或麻醉后监护室再插管。
-
多数机械通气患者在24小时内肺水肿得以缓解并拔管,机械通气PEEP可改善氧合,降低所需氧浓度。
液体管理 心源性肺水肿的治疗中,利尿剂和类固醇常作为辅助药物,以促进液体清除。

预防
拔管前应彻底抽吸患者口咽分泌物,因为带血的分泌物可引起喉痉挛;拔管前可使用5 mg地塞米松,以减少多次插管引起的喉部水肿。有报道称气管拔管前5分钟使用1~2 mg/kg利多卡因可减少喉痉挛,拔管前60秒给予0.5 mg/kg剂量的异丙酚也能有效降低喉痉挛的发生率。气囊漏气测试可以帮助预防拔管后水肿的风险。 (
结论
NPPE是上气道梗阻的一种罕见但可致命的并发症,症状不典型者常被误诊。在排除其他因素后,出现上气道梗阻后肺水肿症状应考虑NPPE,治疗包括密切监测、及时缓解气道梗阻、给予氧疗并在必要时辅助通气。由于个体间差异,NPPE的流行病学、病因学和病理生理过程一直是争议话题,一直存在挑战。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)