首页 > 医疗资讯/ 正文
NCCN肝细胞癌指南2024V2更新
NCCN肝细胞癌指南2024V2于2024年7月2日发布,对比NCCN肝细胞癌指南2024V1更新了全身疗法部分。


全身治疗原则

更新部分:
1.一线全身治疗方案更新
(1)在“其他推荐方案(Other Recommended Regimens)”栏中,新增:1类推荐药物:替雷利珠单抗(Tislelizumab)[1];
(2)在“在某些情况下有用(Useful in Certain Circumstances)”栏中,新增:瑞普替尼(Repotrectinib)为NTRK基因融合阳性肿瘤的2B类推荐[2];
2. 疾病进展的后续治疗
在“其他推荐方案中”栏中,新增“纳武利尤单抗+伊匹木单抗”参考文献依据[3]。
一、替雷利珠单抗(Tislelizumab)的推荐基于RATIONALE-301研究结果
RATIONALE-301是一项随机、开放标签、多中心3期研究,旨在比较替雷利珠单抗与索拉非尼作为不可切除肝细胞癌患者一线治疗的疗效和安全性
参与者
关键纳入标准:
1.肝细胞癌的组织学确诊
2.巴塞罗那(BCLC)B期或C期肝癌不适合局部区域治疗或在局部区域治疗后进展,也不适合根治性治疗方法
3.既往未接受过HCC全身治疗(参加安全磨合子研究[仅限日本]的HCC参与者除外)
4.可测量的疾病
5.Child-Pugh评分A
6.东部肿瘤协作组(ECOG)评分≤1
7.器官功能正常
关键排除标准:
1.已知的纤维板层型肝癌、肉瘤样肝细胞癌或混合型胆管细胞-肝细胞癌的组织学
2.肿瘤血栓累及门静脉主干或下腔静脉
3.随机分组前28天内对肝脏进行了局部区域治疗
4.有筛选时或随机分组前6个月内有门静脉高压症伴食管出血或胃静脉曲张出血的临床证据
5.在筛选期间或在随机分组/入组前6个月内,存在任何出血或血栓性疾病,或正在服用需要治疗性国际标准化比值监测的任何处方抗凝药物(如华法林或类似药物)
6.筛选时存在活动性免疫缺陷或自身免疫性疾病和/或既往有任何可能复发的免疫缺陷或自身免疫性疾病的病史
7.参与者在随机分组前14天内需要使用系统性治疗的任何情况,包括使用皮质类固醇(每日超过10mg的泼尼松或等效药物剂量)或其他免疫抑制药物
8.既往有间质性肺病或非感染性肺炎的病史,除非是由放射治疗引起的
9.筛选时心率(QTc)校正的QT间期(通过Fridericia方法校正)>450毫秒
研究方法
患者按1:1的比例随机分配接受替雷利珠单抗,200 mg,每3周一次静脉注射,或甲苯磺酸索拉非尼,400 mg,口服,每日两次。
研究终点
主要终点是总生存期(OS);次要终点包括客观缓解率(ORR)、无进展生存期(PFS)、缓解持续时间(DOR)和安全性。
研究结果
共纳入674例患者(570名男性[84.6%];中位年龄61岁[范围,23-86岁])。截至2022年7月11日,最短研究随访时间为33个月。在意向性治疗人群(n=674)中,替雷利珠单抗和索拉非尼的中位总生存期分别为15.9个月(95%CI,13.2-19.7)和14.1个月(95%CI,12.6-17.4),达到了非劣效性终点标准(风险比[HR],0.85[95.003%CI,0.71-1.02])。替雷利珠单抗组的客观缓解率为14.3%(n=49),索拉非尼组为5.4%(n=18),中位缓解持续时间分别为36.1个月(95%CI,16.8至不可评估)和11.0个月(95%CI,6.2-14.7)。替雷利珠单抗组与索拉非尼组的中位无进展生存期为2.1个月(95%CI,2.1-3.5)个月vs 3.4个月(95%CI,2.2-4.1)个月(HR,1.11[95%CI,0.92-1.33])。
安全性方面,替雷利珠单抗的治疗中出现的不良事件(AE)发生率为96.2%(338名患者中有325名),索拉非尼为100%(n=324)。75例接受替雷利珠单抗治疗的患者(22.2%)和173例(53.4%)接受索拉非尼治疗的患者报告了3级或更高级别的治疗相关AE。替雷利珠单抗与索拉非尼组导致停药(21[6.2%]vs 33[10.2%])和药物调整(68[20.1%]vs 187[57.7%])的治疗相关AE发生率较低。
研究结论
在RATIONALE-301中,与索拉非尼相比,替雷利珠单抗的OS获益不劣于索拉非尼,具有更高的客观缓解率和更持久的缓解效果,而索拉非尼组的中位无进展生存期更长。与索拉非尼相比,替雷利珠单抗表现出良好的安全性。
二、瑞普替尼的推荐是基于TRIDENT-1研究结果
NTRK基因编码三种不同的酪氨酸激酶受体蛋白:TRKA、TRKB和TRKC,这些受体蛋白在神经系统发育和功能中起重要作用。因此NTRK基因的异常融合或突变可导致这些受体蛋白的异常激活,从而促进肿瘤的发生和发展,主要见于实体瘤,如甲状腺癌、肺癌、结直肠癌、胶质瘤等。因此,NTRK融合被认为是一种重要的肿瘤驱动基因变异,识别NTRK融合是一种重要的肿瘤分子分型手段,也为这些肿瘤患者提供了一种新的靶向治疗选择,如恩曲替尼和拉罗替尼。
瑞普替尼(Repotrectinib)是新一代ROS1和TRK酪氨酸激酶抑制剂(TKI),在关键的1/2期TRIDENT-1试验(NCT03093116)中,已显示出在ROS1+NSCLC或NTRK+局部晚期/转移性实体瘤患者中的临床活性和可控的安全性。这是首次通过盲法独立中央审查(BICR)报告repotrectinib在TKI初治和预治疗的NTRK+实体瘤(包括NSCLC)患者中的疗效(最短随访时间为8.7个月)以及所有接受推荐二期剂量(RP2D)治疗的患者中的安全性。

FDA加速批准repotrectinib用于NTRK基因融合阳性
实体瘤成人和儿童患者
repotrectinib来自百时美施贵宝2022年41亿美元收购的Turning Point Therapeutics,Inc.。2023年11月repotrectinib首次获得FDA的批准,用于治疗ROS1阳性的NSCLC。2024年6月13日,美国食品药品监督管理局(FDA)加速批准repotrectinib(AUGTYRO,百时美施贵宝公司)用于12岁及以上患有神经营养性酪氨酸受体激酶(NTRK)基因融合的实体瘤、局部晚期或转移性或手术切除可能导致严重并发症,并且在治疗后进展或没有令人满意的替代疗法的成人和儿童患者,是目前FDA批准用于治疗NTRK阳性实体瘤的唯一疗法。本次指南更新中,Repotrectinib(2B类)是一种NTRK基因融合阳性HCC患者的治疗选择,且该患者在之前接受NTRK靶向治疗后病情出现进展。
TRIDENT-1是一项多中心、单臂、开放标签、多队列试验
研究方法
患有NTRK+实体瘤的患者被纳入TKI初治和预治疗队列。RP2D为160 mg QD 14天,然后是160 mg BID。
结局指标
根据RECIST v1.1,主要疗效结局指标是总体缓解率(ORR)和缓解持续时间(DOR),由盲法独立中央审查评估。
研究结果
在数据截止(2022年12月19日)时,TKI初治队列(n=40)的中位随访时间为17.8个月,TKI预治队列的中位随访时间为20.1个月(n=48)。
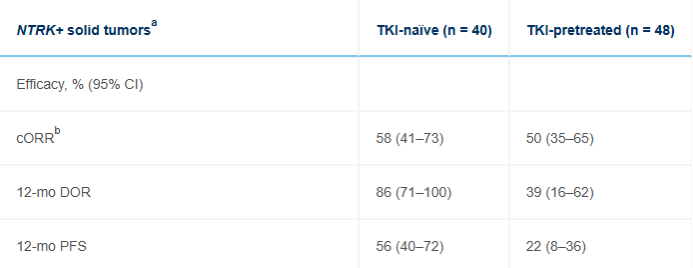

该表显示了在NTRK+实体瘤各亚组患者中的疗效。肿瘤包括非小细胞肺癌(52%未接受过TKI治疗;29%TKI预治疗)、唾液腺癌(8%;17%)、甲状腺癌(12%;8%)、软组织肉瘤(8%;12%);其他各<10%。NSCLC是最常见的肿瘤(TKI初治,52%;TKI预处理,29%)。在TKI初治NTRK+NSCLC中,cORR为62%(95%CI,38-82),估计在12个月时有92%的患者仍然维持缓解状态,64%的患者未出现疾病进展。在TKI预处理的NTRK+NSCLC中,cORR为42%,估计的12个月DOR和PFS分别为44%和23%。
在TKI初治NTRK+中,cORR为58%,估计在12个月时有86%的患者仍然维持缓解状态,有56%的患者未出现疾病进展。在TKI预治疗的NTRK+NSCLC中,cORR为500%,估计的12个月DOR和PFS分别为39%和22%。
安全性方面,在TRIDENT-1的RP2D治疗的所有pts中(n=426),头晕(62%;≥3级,3%)是最常见的治疗中出现的不良事件(TEAE),51%的pts(29%治疗相关AE)发生≥3级TEAE,TEAE导致的治疗停止率为7%(由于治疗相关的AE为3%)。
研究结论
在TRIDENT-1中,在至少8.7个月的随访中,repotrectinib在TKI初治和预处理的NTRK+实体瘤(包括NSCLC)的pts中都显示出稳健的反应和持久的临床活性。RP2D的Repotrectinib安全性可控,与先前的报告一致。
三、纳武利尤单抗+伊匹木单抗增添了参考文献依据
伊匹木单抗和纳武利尤单抗在既往免疫检查点抑制剂为基础的联合疗法失败后治疗晚期肝细胞癌:一项多中心回顾性研究
研究方法
评估了在既往基于ICI的联合治疗后接受ipilimumab和nivolumab联合治疗的晚期HCC患者的临床病程。
研究终点
分析了RECIST v1.1和mRECIST的无进展生存期(PFS)、总缓解率(ORR)和疾病控制率(DCR)、总生存期(OS)和安全性。
研究结果
在接受阿替利珠单抗和贝伐珠单抗或其他基于ICI的联合治疗的109名患者中,有10名患者接受了伊匹木单抗和纳武利尤单抗的后续治疗。大多数患者患有巴塞罗那(BCLC)C期HCC(80%)和Child-Pugh A级的肝脏储备功能(80%)。中位随访时间为15.3个月,伊匹木单抗和纳武利尤单抗的ORR为30%,DCR为40%。中位PFS为2.9个月,中位OS为7.4个月。
研究结论
这项回顾性研究表明,在既往基于ICI的联合治疗后,ipilimumab和nivolumab联合治疗是有效且可耐受的,并为该治疗顺序的前瞻性临床评估提供了基本原理。
参考文献:
[1] Qin S,Kudo M,Meyer T,et al.Tislelizumab vs sorafenib as irst-Line treatment for unresectable hepatocellular carcinoma:A phase 3 randomized clinical trial.JAMA Oncol 2023;9:1651-1659.
[2] Solomon BJ,Drilon A,Lin JJ,et al.Repotrectinib in patients with NTRK fusion-positive advanced solid tumors,including non-small cell lung cancer:Update from the phase 1/2 TRIDENT-1 trial[abstract].Ann Oncol 2023;34:Abstract 1372P.
[3] Roessler D,Öcal O,Philipp AB,et al.Ipilimumab and nivolumab in advanced hepatocellular carcinoma after failure of prior immune checkpoint inhibitor-based combination therapies:A multicenter retrospective study.J Cancer Res Clin Oncol 2023;149:3065-3073.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)