首页 > 医疗资讯/ 正文
t(14;16)
多发性骨髓瘤(MM)是一种异质性且复杂的疾病,无论是突变生物学还是临床表现均是如此。虽然个性化和生物标志物靶向治疗(例如BCL2抑制剂治疗t[11;14])仍是以患者为中心的治疗的直接目标,但MM的现有治疗方法在很大程度上仍较为统一。
t(14;16)易位是一种罕见的原发性遗传事件,只有不到5%的新诊断MM患者携带该易位,但具有重要的预后价值和治疗影响。《American Journal of Hematology》近日发表综述,概述了t(14;16)的生物学、流行病学、临床表现、预后影响,并讨论了针对这一罕见但高危群体的未来临床和治疗策略,旨在优化患者预后。

t(14;16)多发性骨髓瘤的生物学
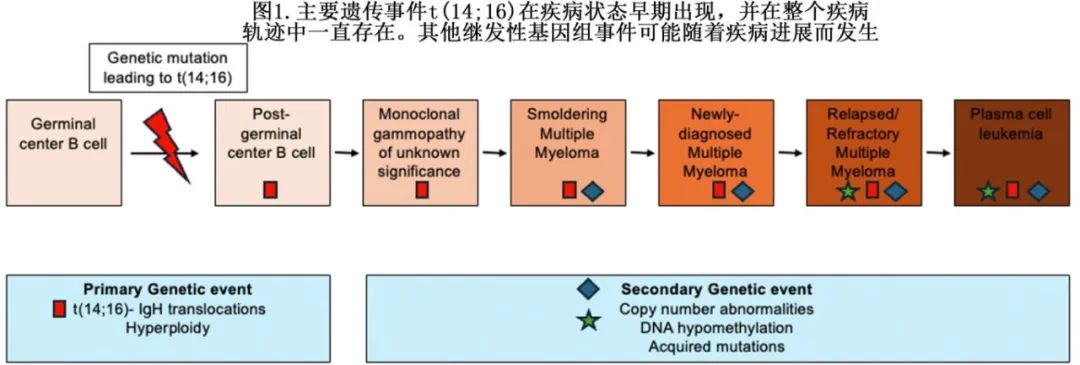
MM遗传异常包括原发性(免疫球蛋白重链[IgH]易位和导致高二倍体的三体)或继发性(单体/缺失和扩增)。原发性遗传异常通过增殖而存在于所有肿瘤细胞中,从意义未明单克隆免疫球蛋白血症(MGUS)到冒烟型MM (SMM)、明显症状性MM和复发/难治MM。原发性易位事件有伴侣位点,包括IgH、IgK (kappa位点)和IgL (lamda位点)免疫球蛋白位点,以及染色体11q13 (CCND1)、6p21 (CCND3)、4p16 (FGFR3/NSD2)、 16q23 (c-肌腱神经纤维肉瘤[cMAF])和20q12 (MAFB) 上的一个复发癌基因位点。MAF易位组包括t(14;16)和t(14;20),两者在MM中都不常见,但可能具有重要的预后作用;这些易位导致强IgH增强子与MM癌基因并置,驱动其病理性过表达。通过物理易位,一种特定癌基因的病理性过表达为固有,将骨髓瘤细分为不同的生物学亚群,在整个疾病过程中仍具有临床意义(图1)。
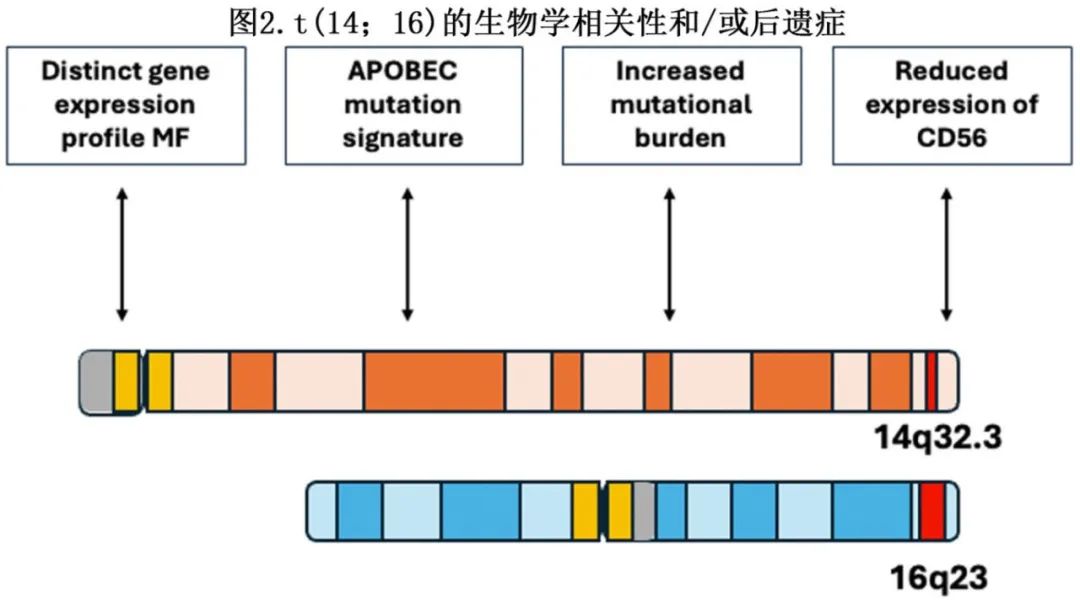
t(14;16)易位影响14号染色体上的IgH和16号染色体上的致癌基因,可导致致癌性转录因子c-MAF的病理性过表达。c-MAF致癌基因编码一种基本亮氨酸拉链转录因子,该转录因子随后由于易位而被转录激活(14;16)。病理性c-MAF过表达的分子后遗症包括特定基因信号的上调,包括细胞周期蛋白D2、整合素β7、CC趋化因子受体1和ampk相关蛋白激酶5的转录,这些蛋白激酶可刺激细胞周期进程和骨髓微环境相互作用。具体而言,整合素β7与基质细胞表面的E-catherine结合,增加血管内皮生长因子的产生,可能导致骨髓血管生成和MM细胞迁移增加。
t(14;16)与载脂蛋白B mRNA编辑催化多肽样(APOBEC)突变特征有关。在大型UK Myeloma XI研究中,463例MM患者进行了全外显子组测序。与队列中的其他易位组相比,MAF易位患者(包括t[14;16]和t[14;20])的突变数量增加,包括特异性特征B (APOBEC)相关突变富集。这些APOBEC蛋白家族对健康和癌症的发展具有重要意义。虽然这些酶可能通过突变病原体的基因组来保护病原体,但也会导致基因组不稳定,导致更多样化和侵袭性的癌症基因组,包括MM。
t(14;16)及其相关的生物学后遗症也可能影响对不同治疗的反应。糖皮质激素早已确定为c-MAF和c-MAF依赖性细胞周期蛋白D2转激活的抑制剂。在硼替佐米为基础的诱导、巩固和维持治疗中,其他高危亚组(包括t[4;14])均有改善,但MAF/MAFB分子亚组患者的预后仍较差。暴露于蛋白酶体抑制剂可消除糖原合成酶激酶3β (GSK3β)介导的MAF蛋白降解,反过来导致其稳定性增加和随后的化学耐药性,可能导致对蛋白酶体抑制剂先天耐药。
总之,与原发性易位事件相关的生物学机制t(14;16) 赋予其侵袭性表型,随后存在于肿瘤的每个单细胞中,并在病程中发生后续细胞分裂。c-MAF可促进 MM 细胞增殖、进展和存活。此外,这些生物学机制可能影响对潜在新型治疗的反应和耐药性。t(14;16)的生物学相关性/后遗症见图2。在某些情况下,这种基因组不稳定性的增加是否会最终成为其弱点性,仍有待观察,或可用于治疗药物开发,以获得亚组患者更好的结局。
流行病学
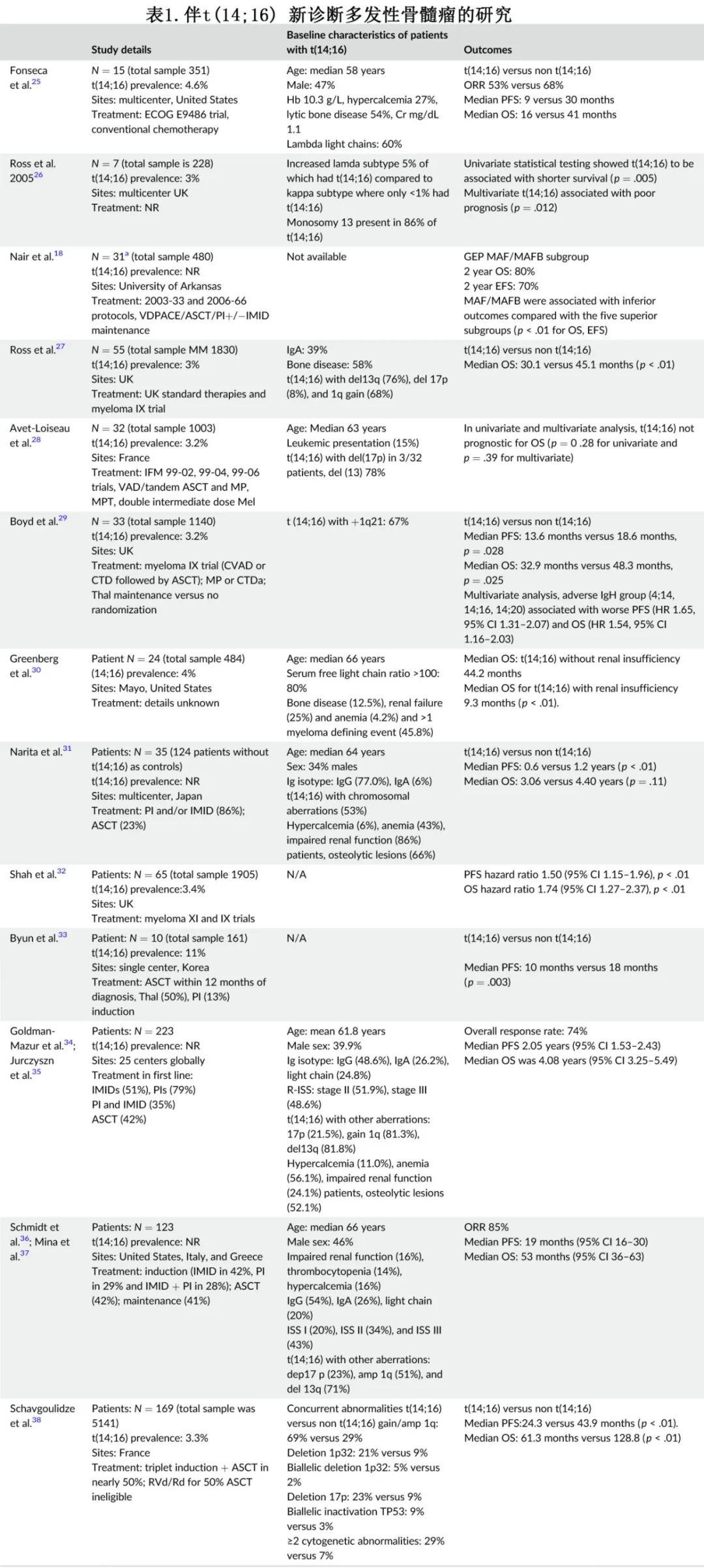
t(14;16)可存在于前驱状态中,包括MGUS、SMM以及MM。在梅奥诊所发表的一系列研究中,t(14;16)存在于3%-5%的MGUS或SMM患者中。同样,在2002年法国研究组发表的一项研究中,t(14;16)存在于1/186 (<1%)的MGUS/SMM病例、14/669 (2%)的MM病例和5/46(11%)的原发性浆细胞白血病(PCL)病例中。t(14;16)也存在于其他罕见浆细胞病变中,包括AL型淀粉样蛋白。表1显示了新诊断MM患者中t(14;16)的频率。大多数研究报告的患病率为3%-4%;但两个多中心英国临床试验中为3%,而在东亚单中心队列中为11%。
t(14;16)的检测
FISH是检测t(14;16)和/或t(14;20)的适当方法,经常用于当前的常规临床实践,但它会固有地错过对轻链免疫球蛋白位点的罕见易位。如果可行,合适的二代测序 (NGS) panel、全基因组测序或基因表达谱(GEP)是首选检测方法,因为它们能够检测到FISH可能无法检测到的额外Ig易位。
临床表现
正如表1所示,t(14;16)患者相对于不携带t(14;16)的患者,整体临床表现倾向于更侵袭性,例如:终末器官损伤率更高,贫血、血小板减少、肾功能不全、浆细胞负荷加重和ISS III期比例更高,血清游离轻链和肾衰(25%)比例更高,髓外病变(EMD)和原发性PCL比例更高,CD56表达较低(其在原发性PCL中也表达较低,可导致MAF易位患者循环浆细胞数量增加)。
t(14;16)的预后
关于t(14;16)在MM中预后价值的研究结果有所不同,且很多t(14;16)患者会合并附加高危细胞遗传学异常。虽然传统上一般纳入t(14;16)到预后模型的高危因素中,例如R-ISS、m-SMART、IMWG 2016共识等,但并未纳入R2-ISS中。在该分析中,t(14:16)相对于不携带t(14:16)的患者,在PFS(HR 1.15,p=0.13)和OS (1.34,p<0.01)的多变量模型中保持其独立预后影响,但只有显著影响OS和PFS的顶级预测因子纳入加性评分模型,t(14;16)未被纳入最终模型。
考虑到大量关于t(14;16)的预后意义的证据,以及对非常罕见的t(14;20)的合理推断,它们都应该继续常规地纳入确定高危亚组的研究中。t(14;16)不仅具有预后信息,而且还可能具有未来治疗药物的预测信息。
t(14;16)的治疗启示
由于MM的生物学和临床异质性,个性化治疗选择仍难以探索,目前唯一被评估的靶向治疗是为BCL-2抑制剂治疗t (11;14)。鉴于t(14;16)的独特机制,致癌转录因子c-MAF或可作为MM的潜在治疗靶点,可以通过参与调节c-MAF表达或稳定性的多种信号通路来实现,包括:(1)GSK3β, janus激酶/信号转导和转录激活因子3 (JAK/STAT3),成纤维细胞生长因子受体3/多发性骨髓瘤SET结构域(FGFR3/MMSET),蛋白激酶 B/雷帕霉素机制靶点 (AKT/mTOR) 通路;(2)c-MAF泛素化系统。例如,Otub1/c-MAF轴是有希望的治疗靶点,Otub1在促进c-MAF上的去泛素化和促进c-MAF致癌转录方面具有潜在作用。进一步的研究正在进行中,以确定现有的肿瘤药物可能抑制c-MAF依赖性转录活性的影响。但是到目前为止,这些分子都在开发中,目前还没有在临床试验中进行评估。
总结
约3%-4%的新诊断MM患者存在t(14;16),它仍是MM的高危特征。作为原发性易位事件,它存在于前驱疾病患者中,包括MGUS和SMM。具有这种易位的新诊断MM患者具有更具侵袭性的生物学表型,包括明显的APOBEC突变特征,以及更具侵袭性的临床表型,包括更高的肾衰竭、EMD和浆细胞白血病发生率。出现t(14:16)的患者通常同时伴有高危细胞遗传学异常,表明整体基因组不稳定。鉴于其独特的生物学和侵袭性临床表型,t(14;16)应在诊断时进行分析。对于MM合并t(14;16)这一罕见但高危异常的群体,仍需要进一步开发个性化方案和优化患者预后。
参考文献
Mian H, Kaiser M, Fonseca R. Still high risk? A review of translocation t(14;16) in multiple myeloma. Am J Hematol. 2024;1‐9. doi:10.1002/ajh.27419
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)