首页 > 医疗资讯/ 正文
肥厚型心肌病(Hypertrophic cardiomyopathy, HCM)是一种常见的遗传性心肌病,发病率约1/200,常导致心律紊乱和猝死,最终可发展为心衰。肌节基因MYH7上的杂合性单碱基突变(SNV)是导致HCM的常见原因,选择性敲除或敲低突变的MYH7等位基因被认为能够有效治疗此类疾病,但目前尚缺乏更精准、有效的工具。
2024年5月16日,上海交通大学张冰教授课题组在Circulation期刊发表题为“Allele-Specific Suppression of Variant MHC With High-Precision RNA Nuclease CRISPR-Cas13d Prevents Hypertrophic Cardiomyopathy”的研究成果,首次开发出高精准高保真的Cas13d编辑器hpCas13d,并在两种HCM小鼠模型中实现了对单碱基突变的Myh6(与人MYH7同源)地特异性敲低,成功阻滞了HCM相关病理表型,为临床治疗肥厚型心肌病提供了新的思路。

约80%的MYH7致病突变为杂合性SNV产生的错义突变,会导致肌球蛋白的收缩功能增加,进而发展为心肌细胞肥大、纤维化、心电异常和左心室肥厚等疾病特征。有研究表明,选择性敲低突变的MYH7转录本可阻滞HCM的发展,然而shRNA不具备单碱基识别能力,需在突变位点附近引入其它SNP位点方可实现选择性等位基因敲低。单碱基编辑器(Base editor)能从DNA层面纠正单碱基突变,然而经典的单碱基编辑器只能实现A:T到G:C或C:G到T:A的突变,仍有约30%的单碱基突变无法被高效编辑。CRISPR-Cas13d是近年发现的可高效切割RNA的编辑工具,属于VI型CRISPR-Cas家族,可在向导RNA (gRNA)的引导下特异性切割RNA,且不受PAM或PFS序列限制。RfxCas13d体积小,RNA编辑活性高,在体内已被证明可治疗多种神经系统疾病。然而,Cas13d是否可识别单碱基突变以及在HCM治疗中的应用潜力还不清楚。
作者首先建立了双荧光报告系统用于筛选可区分单碱基突变RNA和野生型RNA的Cas13d突变体。细胞学实验表明,野生型Cas13d无法区分单碱基突变的等位基因,只能无差别的切割突变基因和野生型基因。接着,作者以同源蛋白EsCas13d的结构为模板,重建了RfxCas13d-crRNA-靶RNA的三维结构。通过突变RfxCas13d与crRNA-靶RNA二复合体结合位点,筛选到四个可提高特异性的点突变,将这四个点突变进一步组合,得到了TNR突变体(即hpCas13d),并证实了该突变体在细胞中可显著降低对wtMyh6的切割,但不影响对muMyh6的切割。
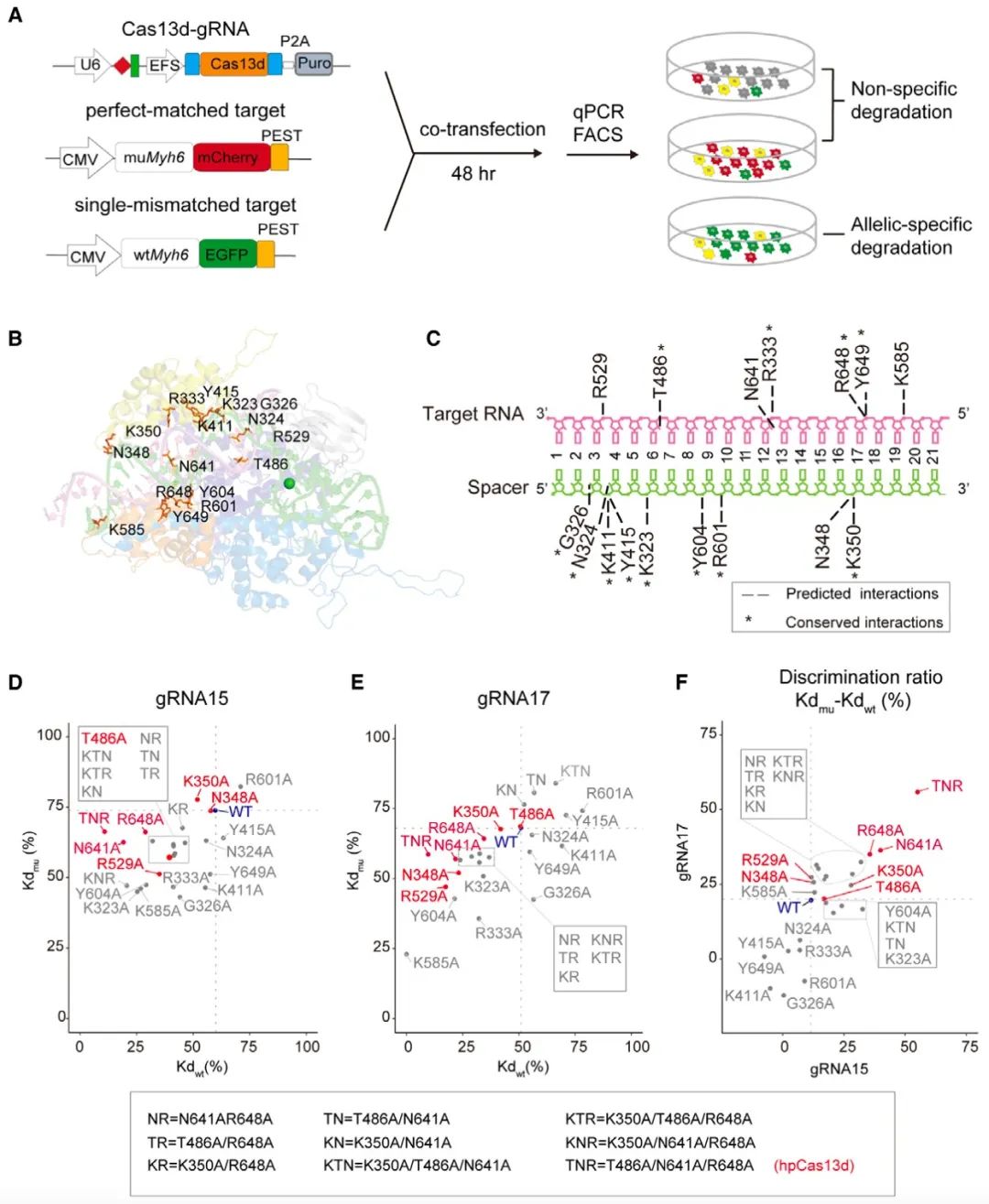
图1. 在等位基因荧光报告细胞中筛选出提高单碱基突变识别特异性的hpCas13d
体外切割实验也表明,不同浓度的hpCas13d均减少了对野生型Myh6的切割,且对单碱基错配底物(wtMyh6)的切割速度更慢,而对完全匹配底物即突变型Myh6的切割动态学与wtCas13d无差异。分子动态学模拟和gRNA阵列实验表明,对比wtCas13d,hpCas13d显著提高了向导RNA与靶RNA匹配的3’端部分(15-21 nt位置)的结合不稳定性和特异性,该部分在结构学上符合经典的“种子区域”特征。
野生型Cas13d在被靶RNA激活后,还可切割活性位点附近的旁观RNA,这称为旁切活性。相比wtCas13d,hpCas13d减少了对非特异性RNA的切割,旁切活性与近期报道的高保真变体hfCas13d (Tong, Huawei et al. Nature biotechnology vol. 41,1 (2023): 108-119)相当,表明hpCas13d不仅提高了单碱基识别的精准性,还降低了旁切活性。
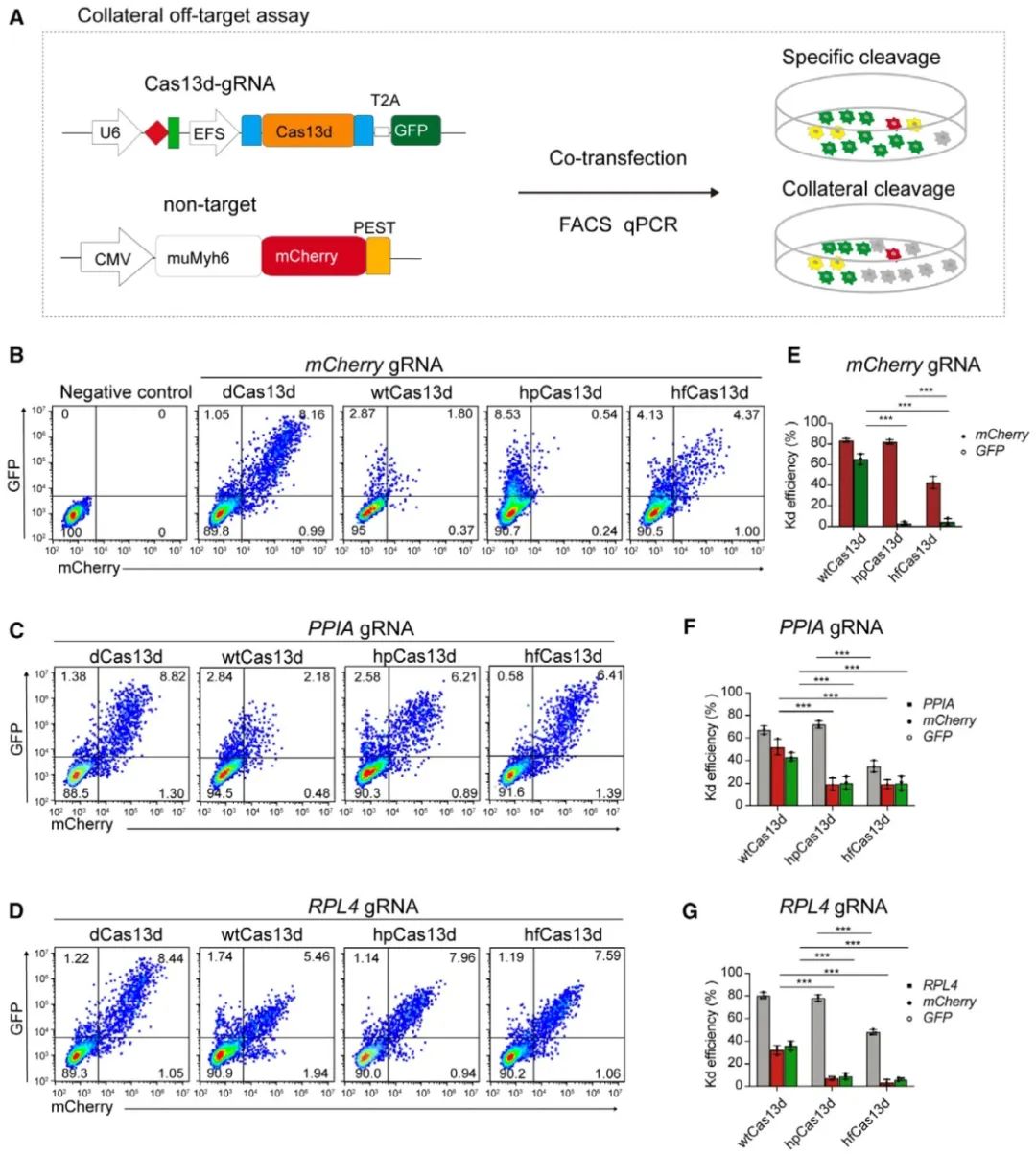
图2. hpCas13d显著减少旁切活性
为了研究hpCas13d在肥厚型心肌病中的治疗作用,作者进一步构建了Myh6 R872H (Myh6RH,与人MYH7 R870H同源)点突变小鼠,该点突变在成人和儿童HCM患者中均有报道,然而致病性未被研究。动物研究表明,Myh6RH/+小鼠在12月龄可发展为轻微地左心室肥厚但无心脏纤维化,在5-8周龄采用环孢霉素A (CsA)诱导可加速HCM的发展。将AAV-hpCas13d[RH]递送至新生小鼠的心肌细胞,可特异性敲低突变的Myh6RH转录本而不影响野生型Myh6WT转录本,并可在CsA诱导的Myh6RH/+小鼠中阻滞左心室肥厚和心电紊乱的发展。而将hpCas13d[RH]递送至未经CsA诱导的、无病理症状的Myh6RH/+小鼠,不影响其正常的心功能,这说明hpCas13d在体内具有较高的安全性。
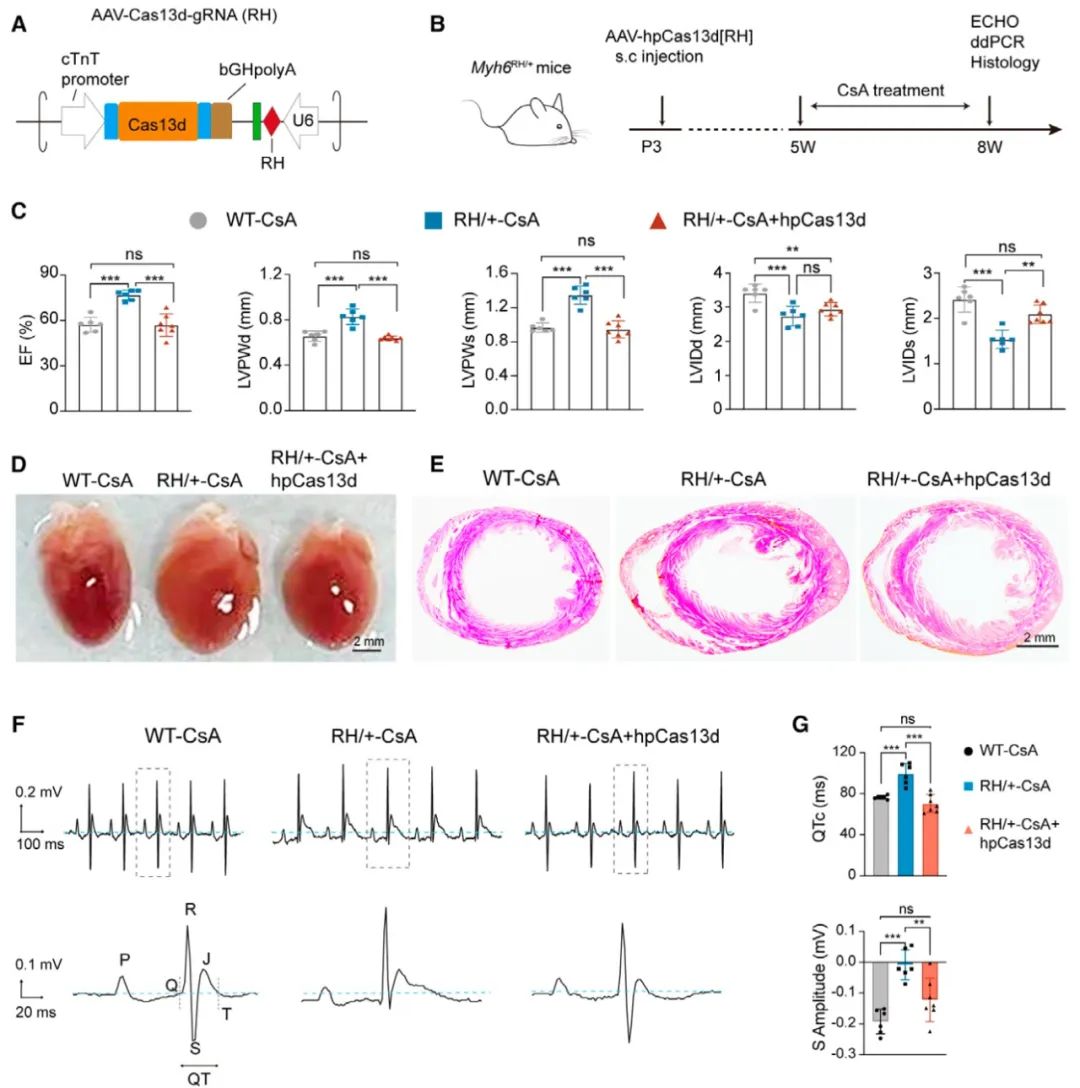
图3. hpCas13d[RH]可在CsA诱导的Myh6RH/+小鼠中阻滞左心室肥厚和心电紊乱的发展
心肌病通常具备剂量效应,即多基因突变或单基因多点突变可加速疾病发展、加重疾病表型,这类患者具有更高的猝死风险。MYH7 R870H突变也曾在严重的儿童型心肌病患者中被报道,与其它MYH7点突变的组合突变可能是导致该病变的潜在原因。因此,作者通过将Myh6RH/RH小鼠与Myh6 R404Q杂合突变(Myh6RQ/+)小鼠杂交,获得Myh6双点杂合突变(Myh6RH/RQ)小鼠。连续地心脏超声检测表明,Myh6RH/RQ小鼠在2月龄就表现为左心室肥厚、射血分数增加,到4月龄进展至高峰,而此时两种单点杂合突变小鼠(Myh6RH/+小鼠和Myh6RQ/+小鼠)心功能均无明显异常。在新生期Myh6RH/RQ小鼠中,利用AAV-hpCas13d[RQ]特异性敲低严重致病突变Myh6RQ而保留较轻微致病突变Myh6RH,可成功阻滞严重型HCM的发展,包括阻滞左心室肥厚、射血分数升高、心电异常、成纤维化、细胞凋亡等病理表型。不仅如此,在已有心室肥厚的2月龄Myh6RH/RQ小鼠中注射AAV-hpCas13d[RQ]同样可抑制疾病的进展。上述所有治疗小鼠均活到了实验的终点(6月龄),这说明hpCas13d可有效治疗单碱基突变疾病,同时还具备较高的安全性。
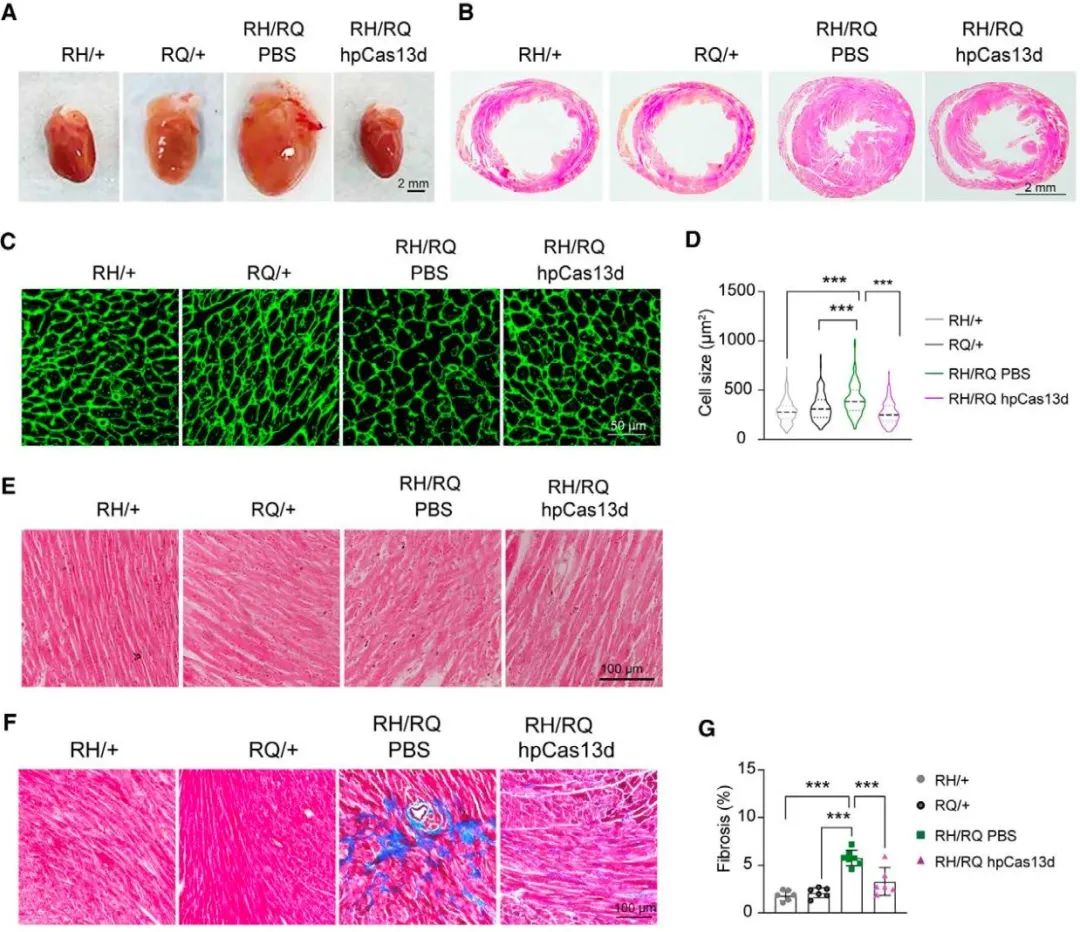
图4. hpCas13d[RQ]可在Myh6RH/RQ小鼠中阻滞严重型肥厚型心肌病的发展
最后,作者构建了包含人类45种MYH7致病点突变的等位基因报告系统,在该系统中分别导入不同的wtCas13d/gRNA或hpCas13d/gRNA,研究hpCas13d区分不同突变方向SNV的能力。结果表明,相比wtCas13d,hpCas13d显著提高了单碱基突变区分能力,且在经典的碱基编辑器不能编辑的SNV位点也表现出特异性区分能力。
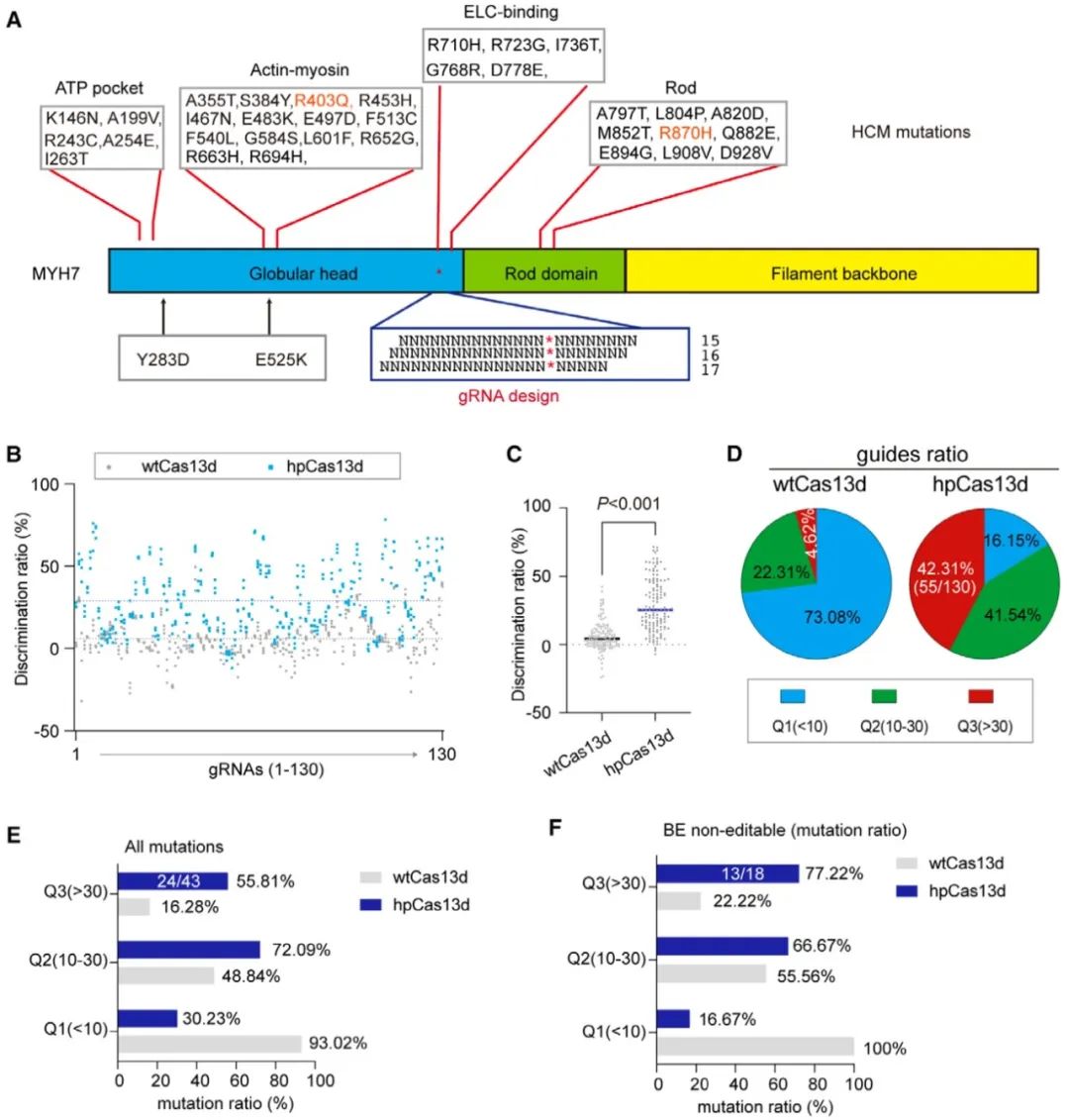
图5. hpCas13d可分辨多种MYH7 SNV致病突变
综上,本研究首次开发了具备单碱基区分能力的精准性Cas13d,并在细胞和动物水平证明其区分单碱基突变等位基因的能力,在两种HCM动物模型中评估了hpCas13d治疗HCM的有效性和安全性,为hpCas13d的临床转化和应用提供了依据。同时,该研究还表明在多点杂合突变的疾病中,靶向其中一种突变即可有效缓解疾病,为多基因遗传病的治疗提供了新思路。
本研究得到了国家自然科学基金、上海市教育部、上海市科委、上海交通大学“星计划”等项目的支持。上海交通大学张冰教授、孙琨教授和张岩教授为该文共同通讯作者,助理研究员杨平、博士生娄应梅、博士生耿子龙、博士生郭志钊为该文共同第一作者。该工作得到了上海交通大学系统生物医学研究院达林泰教授、上海交通大学生命科学与生物技术学院石婷副教授、上海交通大学附属新华医院陈丰原教授、华东师范大学李大力、哈佛大学Willam T. Pu教授的合作支持。
https://doi.org/10.1161/CIRCULATIONAHA.123.067890
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)