首页 > 医疗资讯/ 正文
胸腺上皮肿瘤(TET)是一种罕见的肿瘤,因此很难进行大规模的分子研究。然而,机构病例系列研究和较少的多机构研究发现了TET中许多值得探索的分子变异,包括部分肿瘤中的基因融合。这些基因融合可能有助于疑难病例的诊断,揭示部分肿瘤的发病机制,并可能为患者提供接受靶向治疗或参与临床试验的机会。在TET中已发现的基因融合包括发生于50%-56%的粘液表皮样癌(MAML2::CRTC1)、77%-100%的化生性胸腺瘤(YAP1::MAML2)以及6%的B2和B3胸腺瘤(MAML2::KMT2A)的MAML2重排;发生于NUT癌的NUTM1重排(最常见的是BRD4::NUTM1);发生于玻璃样变透明细胞癌的EWSR1基因重排(EWSR1::ATF1);以及发生于胸腺瘤的NTRK重排(EIF4B::NTRK3)。本综述重点关注已鉴定出这些融合基因的TET,以及其形态学、免疫表型和临床特征,并讨论了融合基因的潜在临床意义。为了优化患者管理,为患者提供接受靶向治疗和参与临床试验的机会,并阐明这些肿瘤的发病机制,需要更大的、多机构的、全球性的研究来进一步阐明这些罕见但有时非常侵袭性的肿瘤的分子特征。
研究背景
随着分子检测越来越容易获得和负担得起,包括基因融合在内的基因变异越来越多地在胸腺瘤和胸腺癌中被发现。基因融合的存在有助于肿瘤的诊断,为这些肿瘤的发病机制提供更多的见解,并可能有助于个体化治疗和靶向治疗。鉴于胸腺上皮肿瘤(TET)的罕见,尽管已经完成了关于这些肿瘤分子变异的多机构研究,但开展大型研究仍具有挑战性。
在TET中,已经发现频繁出现的基因融合,涉及MAML2、EWSR1、NUTM1和NTRK。MAML2基因重排已在粘液表皮样癌、化生性胸腺瘤以及偶尔的B2和B3胸腺瘤中检测到。值得注意的是,MAML2的融合伴侣取决于TET的亚型。在粘液表皮样癌中CRCT1与MAML2融合,和身体其他部位的粘液表皮样癌一样,在化生性胸腺瘤中YAP1与MAML2融合,在B2型和B3型胸腺瘤中KMT2A与MAML2融合。EWSR1基因重排存在于玻璃样变透明细胞癌中,类似于头颈部和肺的玻璃样变透明细胞癌。涉及NUTM1基因的基因融合也存在于胸腺肿瘤中,特别是NUT癌,被认为是胸腺癌的一种亚型。在胸腺瘤中,除了这些反复出现的和公认的基因融合外,NTRK融合也有罕见的报道。在胸腺神经内分泌肿瘤中没有重复出现的融合基因的报道。
本文就TET的基因融合及其在诊断和发病机制中的重要性进行综述。虽然目前它们没有被用作治疗的靶点,但对潜在的治疗选择和调查研究进行了讨论。表1总结了所有已鉴定出基因融合的TET,包括基因融合的频率、肿瘤的形态学特征和其他诊断特征。
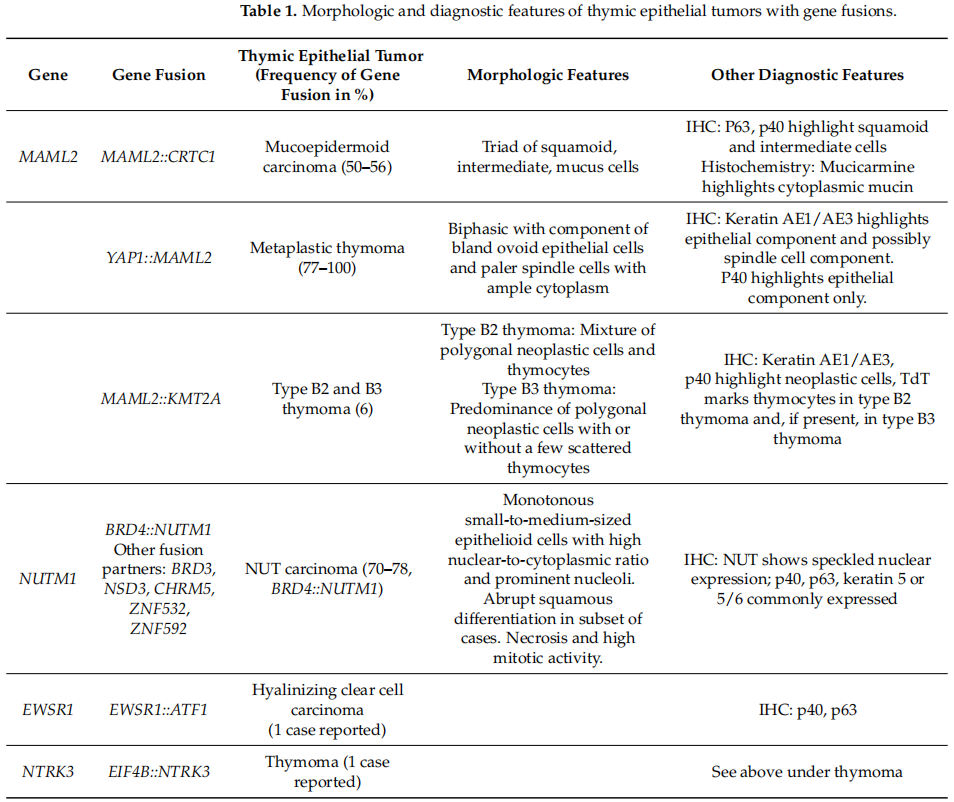
表1
MAML2重排
在胸腺中,MAML2重排首先在粘液表皮样癌中被发现。随后,在化生性胸腺瘤和罕见的B2和B3胸腺瘤中也发现了MAML2重排。尽管有常见的MAML2融合伴侣,但相应的融合基因因其发生的肿瘤亚型而异。例如,在粘液表皮样癌中,已报道的融合伴侣是CRTC1,导致MAML2::CRTC1融合。在化生性胸腺瘤中,融合伴侣是YAP1,导致YAP1::MAML2融合。在B2和B3胸腺瘤亚群中,融合伴侣是KMT2A,导致KMT2A::MAML2融合。虽然这些肿瘤有共同的融合基因MAML2,但它们在形态学和病理学上存在差异。
粘液表皮样癌:
粘液表皮样癌的特征是由鳞状细胞、中间细胞和粘液细胞组成的三联征(图1A-E)。其形态学、免疫表型和分子特征与头颈部、肺或乳腺等其他部位的粘液表皮样癌基本相同。在胸腺中,粘液表皮样癌被认为是胸腺癌的一种亚型。它们也可以出现在囊肿中。50%-56%的胸腺粘液表皮样癌存在MAML2重排。MAML2重排的存在有助于诊断,特别是在高级别的粘液表皮样癌中,并可用于区分粘液表皮样癌与胸腺鳞癌和鳞状细胞癌,因为后者不存在MAML2重排。在一项20例胸腺粘液表皮样癌的研究中,56%存在t(11;19) (q21;p13) CRTC1::MAML2基因融合。CRTC3::MAML2或EWSR1::POU5F1基因融合已在一些头颈部粘液表皮样癌中发现,但在胸腺粘液表皮样癌中未见报道。此外,YAP1和KMT2A在胸腺粘液表皮样癌中也未被鉴定为融合伴侣。值得注意的是,在胸腺粘液表皮样癌中存在CRTC1::MAML2基因融合与经典的肿瘤组织学、较低的pT和TNM分期以及较好的总生存期相关。
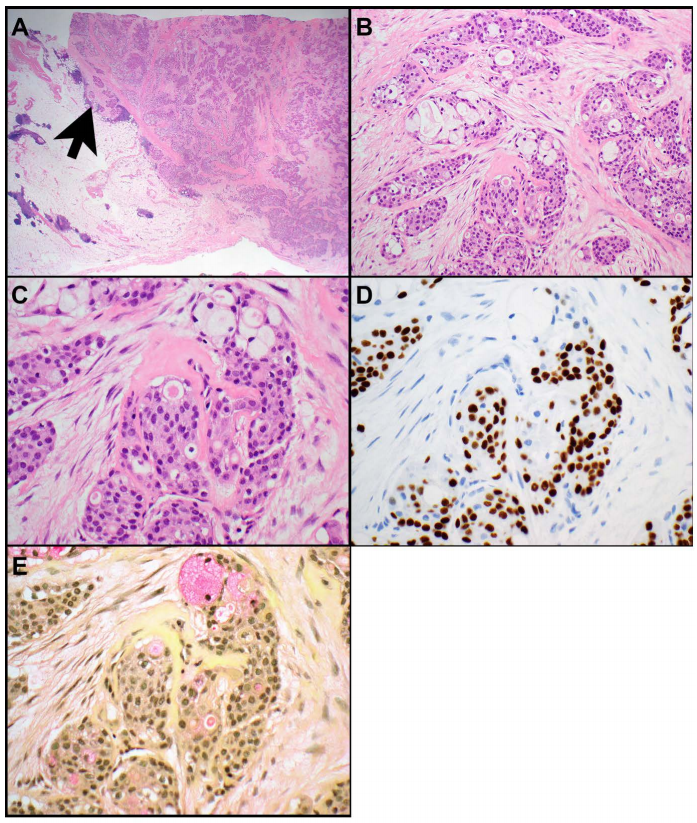

图1
一项包含来自24项研究的41例胸腺粘液表皮样癌的荟萃分析显示,患者平均年龄49.8岁(范围:8-87岁),无明显的性别偏好。平均肿瘤直径为7.6 cm(范围:1.5-20 cm)。患者最常表现为呼吸困难和/或/胸痛;约1/3的患者无症状,肿瘤是偶然发现的。关于粘液表皮样癌的不同分级系统已有报道。对于胸腺,WHO不推荐任何特定的分级系统;而在肺部,这些肿瘤根据WHO分为低级别和高级别肿瘤。在上述荟萃分析中,大多数患者(67%)具有低级别形态学特征,只有27%的患者表现为高级别特征。据报道,5年和10年生存率分别为69%和43%。分别有25%和45%的患者死于疾病,中位生存期分别为40个月和12个月。较差的总生存期与较高的pT分期、较高的TNM分期、残留肿瘤、较大的肿瘤大小、高级别肿瘤组织学和缺乏CRTC1::MAML2融合相关。推荐淋巴结取样,并将组织学分级和肿瘤分期/可切除性作为主要预后指标。建议对所有TET的切除标本进行淋巴结取样;此外,在胸腺癌(包括粘液表皮样癌)中,外科医生应采集胸深淋巴结(N2)样本。
胸腺粘液表皮样癌的鉴别诊断包括多房性胸腺囊肿、腺癌和腺鳞癌。这些实体没有MAML2重排。然而,由于仅在约一半的粘液表皮样癌中发现MAML2重排,因此在无MAML2重排的情况下必须谨慎。腺体和上皮样细胞的侵袭性生长模式不支持多房性胸腺囊肿。p63或p40阳性肿瘤细胞的存在不支持腺癌。
化生性胸腺瘤:
化生性胸腺瘤是非常罕见的肿瘤,只发生在胸腺。它们的特征是双相形态,包括具有不明显核仁的卵圆形淡色上皮细胞的深色成分和具有丰富浅色细胞质的成纤维细胞样梭形细胞的浅色成分(图2A、B)。这两个成分要么被清晰地分离,要么被合并。有丝分裂活性没有增加,也没有发现坏死。诊断一般基于形态学。角蛋白AE1/AE3突出上皮成分,可能染色也可能不染色梭形细胞成分。P40仅标记上皮成分,在梭形细胞成分中呈阴性。在77%-100%的肿瘤中发现了MAML2重排(图2C、D)。在化生性胸腺瘤中,融合伴侣是YAP1,导致YAP1上的第1或第1-5号外显子和MAML2上的第2-5号外显子融合,产生YAP1::MAML2融合基因。然而,MAML2基因重排的荧光原位杂交(FISH)检测通常不是确诊的必要条件。此外,在使用断裂探针FISH检测YAP1::MAML2融合时,由11号染色体内倒位引起的分裂信号可能是微妙的,可能会被遗漏。最近,在其他TET(包括 A、AB、B1、B2 和 B3 型胸腺瘤和胸腺癌)的背景下进行评估时,免疫组织化学显示YAP1-C末端的表达对化生性胸腺瘤具有高度敏感性和特异性。
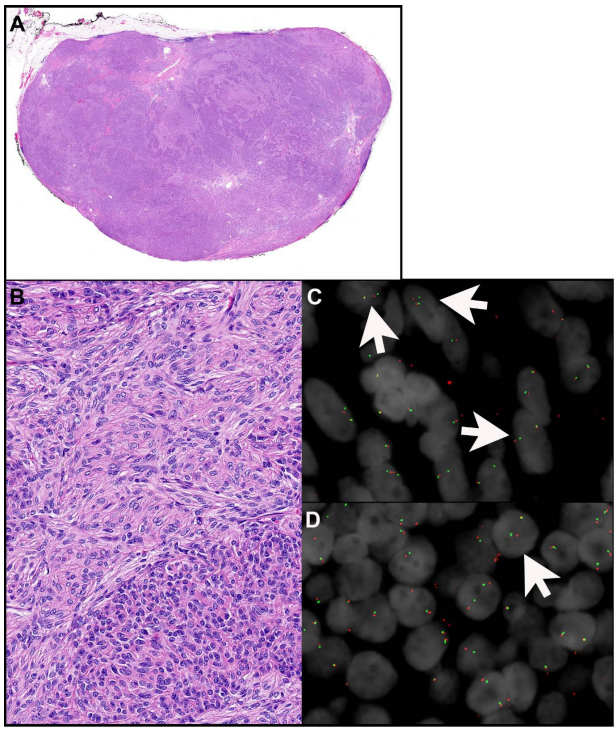

图2
尽管缺乏分子证据,但至少有一些作者认为化生性胸腺瘤的上皮和梭形细胞成分都具有肿瘤性质。最近,在上皮细胞和梭形细胞成分中均观察到MAML2重排(图2C、D),提示这两种成分至少是克隆性的,并且可能是肿瘤性。POLE、HRAS、ALK、CDK4、PTEN和BRAF的突变也在一些化生性胸腺瘤中被发现。在这些肿瘤中未发现其他基因变异,包括GTF2I突变。
化生性胸腺瘤是一种惰性肿瘤,中位发病年龄为50岁(范围:28-71岁),女性略多见。肉瘤样癌起源于化生性胸腺瘤的报道表明,这些肿瘤中的一小部分可能发展为高级别肿瘤。大多数患者不会发生转移、复发或死亡。据报道,只有1例患者在原发肿瘤切除后14个月出现复发和胸膜转移。
化生性胸腺瘤的鉴别诊断包括A型胸腺瘤。A型胸腺瘤缺乏双相外观,仅由淡色的卵圆形或轻微梭形细胞组成,无梭形细胞成分。鉴别诊断通常不需要其他检查。然而,大多数(82%-100%)A型胸腺瘤携带GTF2I突变,而在化生性胸腺瘤中不存在GTF2I突变。相比之下,YAP1::MAML2融合在A型胸腺瘤或伴有淋巴样间质的微结节性胸腺瘤(另一种可能被纳入化生性胸腺瘤鉴别诊断的实体)中未被发现。此外,至少有一部分A型胸腺瘤中存在散在的胸腺细胞,而化生性胸腺瘤中也不存在胸腺细胞。肉瘤样癌也可以类似化生性胸腺瘤。然而,肉瘤样癌或癌肉瘤具有高级别形态学,通常显示容易识别的有丝分裂活性和坏死。
最近,报道了另外2例伴YAP1::MAML2重排的纵隔肿瘤患者,他们的临床病程更具有侵袭性。1例患者出现9.8 cm肿块,侵犯心包、右肺及肺动脉、肺静脉。活检诊断为梭形肉瘤,患者接受了新辅助化疗,随后切除了胸腺肿瘤和双肺转移灶。镜下肿瘤呈双相性,由上皮样和梭形细胞组成;上皮样成分表达角蛋白和p63,梭形细胞仅局部角蛋白阳性。靶向DNA/RNA测序不仅揭示了YAP1::MAML2融合,而且还揭示了TERT启动子突变。第二例患者偶然发现纵隔肿物,活检诊断为横纹肌肉瘤。切除标本显示低分化癌区表达p63和角蛋白,横纹肌肉瘤区表达结蛋白。诊断为癌肉瘤。肿瘤已经转移到颈部淋巴结和肺部。测序结果显示两种成分中均有YAP1::MAML2融合,在癌成分中有TP53突变,在肉瘤成分中有CDKN2A和CDKN2B深度缺失。这两例病例提示YAP1::MAML2重排不仅可能存在于单纯化生性胸腺瘤,也可能存在于侵袭性更强的双相纵隔肿瘤中。
胸腺瘤:
胸腺瘤是发生在血管前纵隔的恶性肿瘤,一般比胸腺癌预后好。GTF2I突变是胸腺瘤中最常见的基因变异,最常见于A型和AB型胸腺瘤。6%的B2和B3胸腺瘤中发现了MAML2重排,但在其他胸腺瘤中未发现。在这些肿瘤中,位于外显子8-11的KMT2A与位于外显子2的MAML2融合。除1例也显示胸腺癌病灶外,其余均具有典型的B2或B3胸腺瘤形态。值得注意的是,在与A型胸腺瘤同时发生的胸腺乳头状腺癌中也发现了KMT2A突变。患者女,53岁,因胸部3个结节就诊:前上纵隔3 cm乳头状腺癌,前纵隔心包旁4 cm A型胸腺瘤和右肺上叶微浸润腺癌。在其他分子变异中,胸腺癌携带KMT2A基因c.2155A>C(p.S719R)突变,而A型胸腺瘤携带不同的KMT2A基因c.5343del(p.V178Yfs*38)突变。
在胸腺肿瘤中,MAML2基因重排有助于诊断,特别是粘液表皮样癌。这些重排可能在发病机制中起作用,至少在部分TET中是这样。小鼠研究已经证实CRTC1::MAML2是粘液表皮样癌发展和维持的致癌驱动因子。虽然MAML2重排目前还不能作为治疗靶点,但这些研究也揭示了EGFR和CDK4/6抑制剂是这些肿瘤的潜在治疗选择。
NUTM1重排
在纵隔中,NUTM1重排主要见于NUT癌。最近,这些重排也在其他小圆蓝色细胞肿瘤中被描述,尽管这些肿瘤似乎更罕见,特别是在胸部。
胸部睾丸核蛋白(NUT)癌:
胸部睾丸核蛋白(NUT)癌罕见。这些肿瘤被认为是鳞状细胞癌的一个侵袭性亚型。它们由小到中等大小的上皮样细胞组成,具有高的核质比,单一的、圆形到卵圆形的细胞核和显著的核仁(图3A-E和图4A-E)。NUT癌表现为高核分裂象和坏死。在NUT癌的一个亚型中,可以看到大量中性粒细胞与肿瘤细胞混合(图4A)。突发性鳞状分化是NUT癌的典型表现(图3B),但并不总是可见。NUT蛋白的免疫组化显示肿瘤细胞中有特征性的斑点状核染色(图3E和图4D)。NUT癌也经常表达鳞状分化标志物,包括p40(图3C)、p63和角蛋白5或5/6。部分肿瘤表达角蛋白,如AE1/AE3和/或CAM5.2;和TTF-1(图3D和图4B)、CD34或突触素(图4C)也可见于其中一些肿瘤中。在NUT癌中很少有CD30、PLAP和/或SALL4表达的报道。
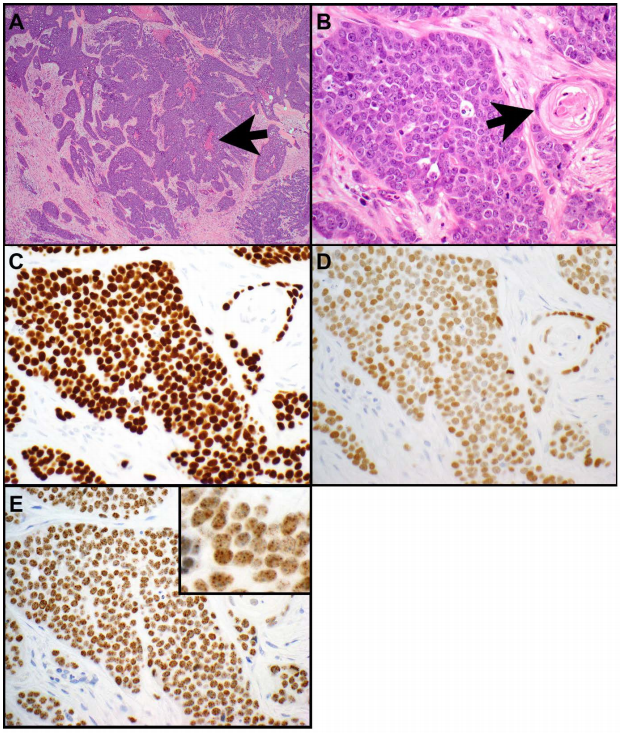

图3
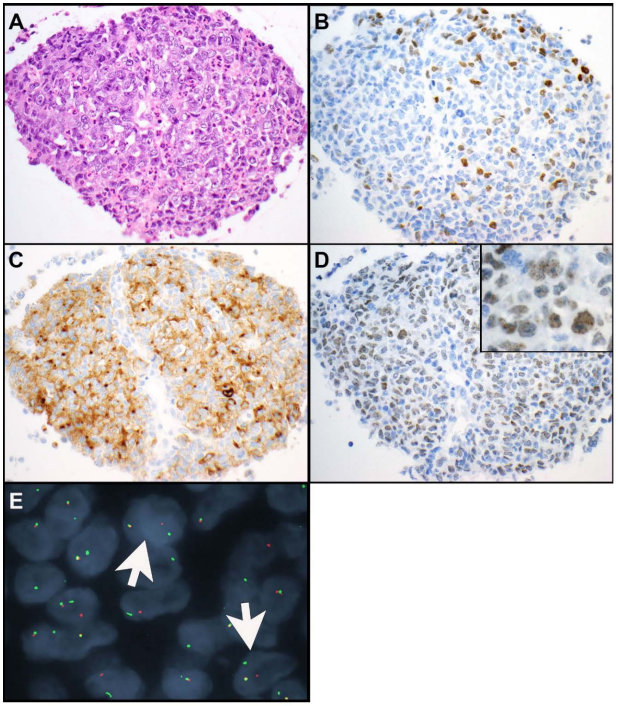

图4
NUT蛋白由NUTM1编码。在70%-78%的所有NUT癌中发现的最常见的分子变异是 t(15;19)(q14;p13.1 )易位,导致BRD4::NUTM1融合癌基因。BRD4是一种含双溴结构域的基因,参与调控细胞周期进程。较少见的易位包括BRD3::NUTM1和NSD3::NUTM1。NUTM1的其他融合伴侣还有CHRM5、ZNF532和ZNF592。NUTM1重排导致NUT蛋白的表达,而NUT蛋白通常只在精子细胞中表达。NUT的免疫组化显示了上述核斑点染色模式,在非生殖细胞肿瘤中,NUT癌的特异性为100%,敏感性为87%。诊断不需要确认性辅助检测。但NUT免疫组化偶呈阴性。如果有疑问,应进行其他分子或细胞遗传学检查,如二代测序(NGS)、针对NUTM1::BRD4的逆转录聚合酶链反应(RT-PCR)、针对NUTM1重排的荧光原位杂交(FISH)(图4E)或核型分析。NUT癌的核型通常简单,唯一的异常是涉及NUTM1基因的重排。除了NUTM1重排,在NUT癌中没有其他分子变异的报道。
NUT癌是高度侵袭性肿瘤。它们最常见于胸部(51%-55%),特别是纵隔,其次是头颈部(40%-41%)和其他部位。在世界卫生组织中,发生在纵隔的NUT癌被认为是胸腺癌的一个亚型。患者中位年龄16-50岁(范围:0.1-78岁)。没有明显的性别偏好。大多数患者(51%-77%)在就诊时就有转移性疾病,其中68%的患者有区域淋巴结转移。
NUT癌预后差,中位总生存期仅为6.5-7个月,通常是致命的。有证据表明,预后可能与原发肿瘤部位和分子变异有关。Chau NG等人表明,伴有BRD3::NUTM1或NSD3::NUTM1融合的原发性非胸部NUT癌有最佳的总生存期,为36.5个月,相比之下,伴有BRD4::NUTM1融合的原发性非胸部NUT癌的中位总生存期为10个月,而原发性胸部NUT癌的中位总生存期仅为4.4个月。长期生存(3年)仅在前两组中有发现。Virarkar M等人还发现,原发性头颈部NUT癌患者的总生存期(16个月)优于肺或其他原发性NUT癌患者(6个月)。
对于不可切除或转移性肿瘤,推荐化疗,然后进行局部治疗。如果肿瘤是局限性的,完全切除后进行放疗(可能同时进行化疗)似乎与较好的预后相关。然而,许多NUT癌患者存在转移性疾病,因此不适合手术。目前注册登记了使用BET抑制剂与常规化疗相结合的临床试验(NCT05019716;NCT05372640)。
NUT癌的鉴别诊断包括低分化鳞状细胞癌、小细胞癌、大细胞神经内分泌癌、淋巴瘤和SMARCA4缺陷型未分化肿瘤(DUT)以及其他小圆形蓝细胞肿瘤。如前所述,其他免疫组化检测如角蛋白、鳞状标记物、TTF-1或突触素的表达可能缺乏或存在缺陷,因此应进行NUT免疫组化检测。此外,特别是在小活检中,如果存在挤压伪影,许多免疫组化检测可能为阴性,因此必须小心,不要将肿瘤误诊为小细胞癌。同样,在这些情况下应进行NUT免疫染色。鉴于NUT通常在精子细胞中表达,因此NUT可能在一些生殖细胞肿瘤中表达并不奇怪,包括100%的精母细胞性精原细胞瘤、74%的精原细胞瘤、100%的肝样细胞瘤和7%的非肝样卵黄囊瘤。然而,据报道,只有71%的精母细胞性精原细胞瘤中NUT强而弥漫表达。NUT在胚胎癌中呈阴性。作者没有评论NUT在生殖细胞肿瘤中的染色是否可能在细胞核中更均匀,而不是在NUT癌中看到的斑点。然而,NUT癌的形态学和免疫表型特征应有助于与生殖细胞肿瘤,尤其是精原细胞瘤的鉴别,精原细胞瘤可发生于血管前纵隔,可能纳入NUT癌的鉴别诊断。
伴有NUTM1重排的小圆形蓝细胞肿瘤(即NUTM1重排肉瘤):
伴有NUTM1重排的小圆形蓝细胞肿瘤(即NUTM1重排肉瘤)也有报道。这些肿瘤有不同于NUT癌的融合伴侣,如CIC、ATXN1、BCORL1、MXD1和MX11。具有骨外粘液样软骨肉瘤特征和实性结构中含有X::NUTM1重排的NUT肉瘤,具有粘液样软骨肉瘤特征并伴有MGA::NUTM1重排的NUT肉瘤,以及局灶性致密纤维基质并伴有MXD4::NUTM1重排的高级别小圆/上皮样细胞肿瘤。这些肿瘤分别发生于足部(4年后发生肺转移)、肺(就诊时发生肝转移)或胸部/胸膜。对这些肿瘤的认识结合NUT免疫组织化学染色和NGS有助于诊断。
EWSR1重排
伴有EWSR1重排的透明细胞癌(HCCC):
伴有EWSR1重排的透明细胞癌(HCCC)可发生于胸腺,已被纳入2021年WHO分类。这些肿瘤最早见于头颈部,后来也见于肺。对于原发性胸腺HCCC,2021年WHO分类提示无EWSR1重排的透明细胞癌可能代表或可能不代表真正的胸腺透明细胞癌。HCCC的特征是条索状、小梁状和中小细胞巢状上皮样细胞。肿瘤细胞胞质透明或嗜酸性,无明显有丝分裂活性。细胞处于玻璃样纤维化或粘液透明的基质背景中。可能存在粘蛋白池或带有粘蛋白的腺结构。病灶边缘或病灶内部可见淋巴细胞浸润和生发中心。HCCC表达p40和p63,有1例报道p63阴性。其他肌上皮标志物、TTF-1、napsin A、神经内分泌标志物和CD117均为阴性。报道的2例胸腺型HCCC均存在EWSR1基因重排,其中1例存在EWSR1基因第13号外显子与ATF1基因第6号外显子融合。事实上,在其他器官HCCC中,ATF1已被报道为EWSR1最常见的融合伴侣,只有罕见的CREM伴或不伴IRF2::NTRK3被报道。
在肺部,HCCC多表现为惰性。胸腺型HCCC无死亡病例报道,但报道病例数较少。报道的2例胸腺型HCCC患者中,1例为Masaoka Koga分期IIB期,因切缘阳性接受辅助放疗,术后12个月出现肺转移,确诊后22个月出现胸膜和心包转移,确诊后40个月部分缓解。报告的另1例患者无临床信息。
NTRK重排
NTRK的染色体重排仅在0.3%的实体瘤中被发现。重要的是,TRK抑制剂已被证明可使肿瘤反应。已报道一例罕见的携带NTRK融合的胸腺瘤病例。患者男,50岁,右侧胸膜多发肿块,右侧膈外侧5.8 cm肿块,前纵隔多发肿块。肺肿块活检诊断为胸腺瘤,提示B3型。该患者临床分期为IV期。化疗2个周期后,不良反应无法耐受,行NGS。NGS结果显示除了高肿瘤突变负荷(31 mut/Mb)、TP53变异和FGFR1拷贝数增加之外,还存在EIF4B::NTRK3重排。随后患者接受恩曲替尼治疗,恩曲替尼是一种选择性靶向TRKA、B、C,ALK和ROS1的酪氨酸激酶抑制剂,已被美国食品药品监督管理局批准可同时靶向NTRK和ROS1。然而,开始治疗10个月后,患者出现肌无力危象,期间治疗停止。当时的影像学检查显示,根据RECIST 1.1标准,患者达到了部分缓解,最长直径总和减少了35%。
在多种TET中已发现重复的基因重排。这些基因重排都不能定义疾病,因为它们可以发生在胸腺的各种肿瘤中。此外,这些融合对TET并无特异性,也已在其他部位的疾病对应体中发现。尽管如此,在正确的形态学和免疫表型背景下,其中一些重排可帮助诊断。其他一些重排,尽管只是在非常罕见的情况下,但可能提供靶向治疗的机会。对于某些肿瘤,这些基因重排可能为未来的靶向治疗提供机会。这些肿瘤的诊断很重要,因为其中一些肿瘤非常具有侵袭性,正确的诊断为患者提供了参与临床试验的机会。此外,这些发现可能在部分胸腺肿瘤的发病机制中起作用。参与这些重排的一些基因在各种肿瘤亚型中重复出现,这一事实可能提示相似的发病机制。
需要在多机构的全球研究中扩大对这些罕见肿瘤的分子研究,以便为这些有时相当侵袭性的肿瘤患者提供个体化靶向治疗和管理。
参考文献:
Roden AC. The Role of Gene Fusions in Thymic Epithelial Tumors. Cancers. 2023; 15(23):5596. https://doi.org/10.3390/cancers15235596

猜你喜欢
- 事后保健有讲究!排尿洗澡都要注意
- 运动减肥瘦身的方法有什么?如何运动减肥?
- 脂肪酸氧化作用缺陷
- ERJ:MRI 肺动脉血流可检测患有肺部疾病的早产儿的肺血管病理
- NNN: 多发性硬化悄悄恶化?大脑"电线"的退化才是真凶!
- Neurology:服用左乙拉西坦或奥卡西平患者,发生心源性猝死或室性心律失常的风险有多大?
- J Oral Biol Craniofac Res:吸烟对牙周炎患者非手术治疗前后口腔中性粒细胞和基质金属蛋白酶-8的影响
- 跑步岔气更快的解决方案,怎么快速修复
- 皮肤莫名其妙变黄?小心“胡萝卜素血症”
- Eur Urol Oncol:不同卡介苗菌株在中高危非肌层浸润性膀胱癌患者中的使用剂量和疗效调查
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)