首页 > 医疗资讯/ 正文
多发性骨髓瘤(MM)是美国第二大常见血液肿瘤,占所有癌症的1.8%和所有血液肿瘤的17%,对于经主要抗骨髓瘤疗法如蛋白酶抑制剂、免疫调节剂和抗CD38抗体治疗后复发或难治的多发性骨髓瘤患者,现有的挽救疗法效果不佳,生存期较短,因此需要新的治疗方法,西达基奥仑赛是一种基因改造的T细胞产品,通过慢病毒载体表达靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR),2022年2月,美国FDA批准西达基奥仑赛用于治疗经过至少4线治疗(包括免疫调节剂、蛋白酶抑制剂和抗CD38抗体)后复发或难治的多发性骨髓瘤成人患者,支持该批准的主要依据是CARTITUDE-1研究,这是一项单臂、开放标签、多中心的II期临床试验,FDA认为西达基奥仑赛在该适应症患者中的获益大于风险,因此批准其上市。

方法
该研究是一项单臂、开放标签、多中心II期临床试验,纳入包括接受至少3线以上治疗(包括免疫调节剂、蛋白酶抑制剂和抗CD38抗体),并在最后一线治疗后12个月内出现疾病进展的成年复发/难治多发性骨髓瘤患者,共纳入113例患者,其中97例可评估疗效,首先进行淋巴细胞耗竭化疗(环磷酰胺+氟达拉滨),3天后进行CAR-T细胞输注(0.5-1.0 x 10^6/kg体重),研究的主要终点为独立审查委员会根据国际骨髓瘤工作组(IMWG)2016年标准评估总体反应率(ORR)。
研究结果
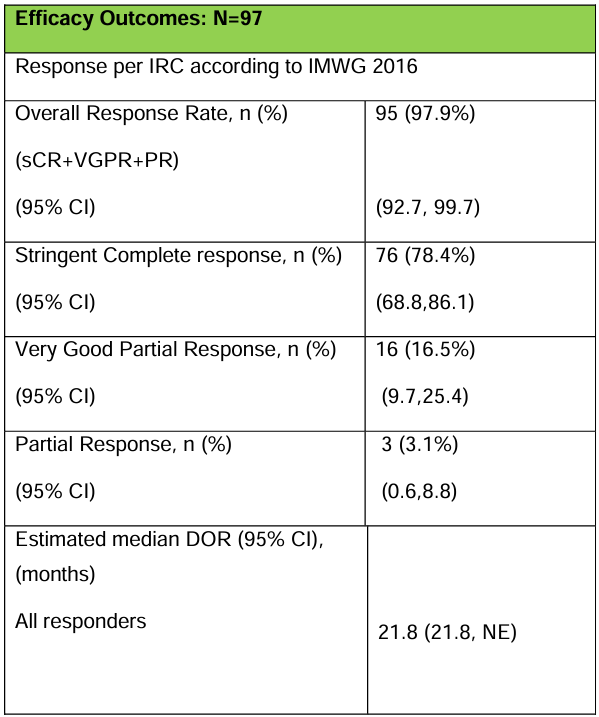
在可评估疗效的97例患者中,ORR达到97.9%,95%置信区间为92.7-99.7%,在可评估疗效的97例患者中,sCR达到78.4%,95%置信区间为68.8-86.1%,在所有95例反应患者中,中位反应持续时间为21.8个月,95%置信区间为21.8个月-无法估计。
安全性分析
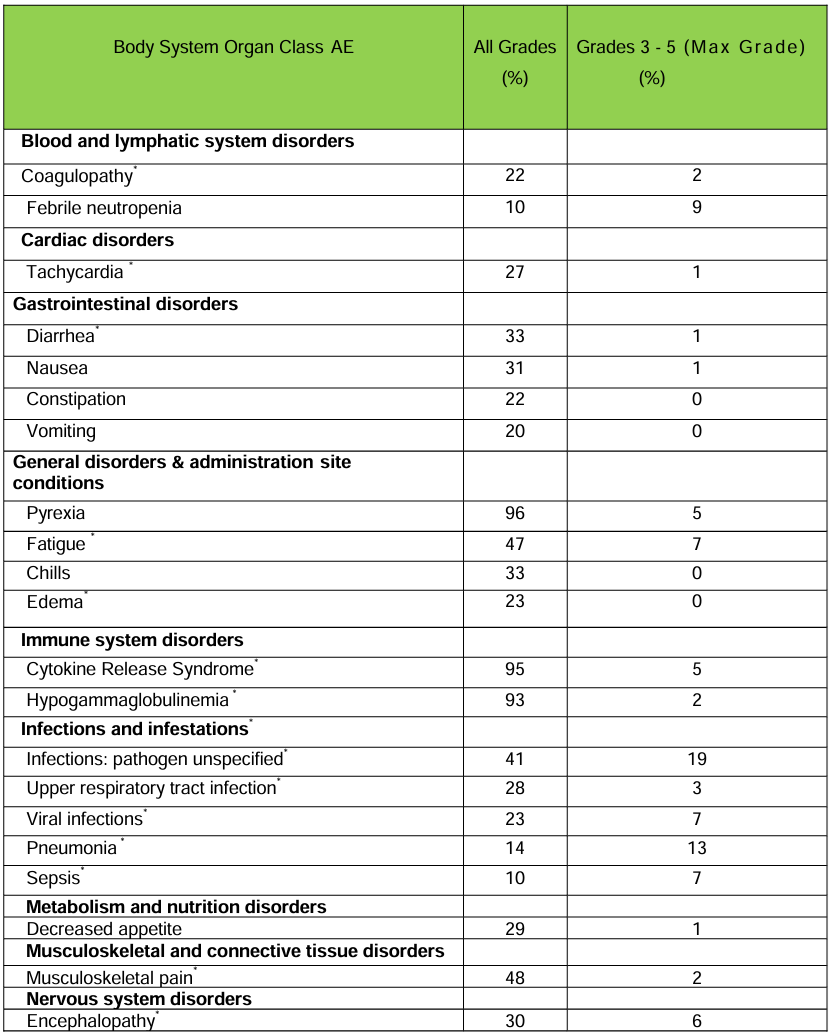
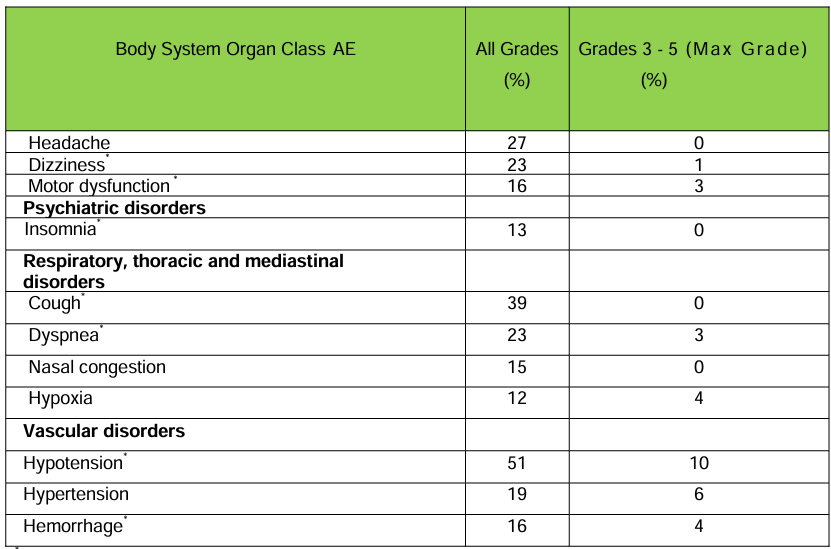
主要不良反应包括细胞因子释放综合征、神经系统毒性、长期血细胞减少等,发生率较高,在97例患者中,55%发生了严重不良事件,涉及细胞因子释放综合征、神经系统毒性、感染等,在97例患者中,9%死亡,主要死因包括细胞因子释放综合征、感染、神经系统毒性等,采取了相应的处理措施,如使用托珠单抗、皮质类固醇、抗癫痫药物等,以及针对血细胞减少给予支持治疗来进行不良反应处理,总体而言,西达基奥仑赛的获益大于风险,但在使用时需要谨慎评估患者状况。
结论
西达基奥仑赛在经过多线治疗后的复发/难治多发性骨髓瘤患者中显示出显著的疗效,包括高总体反应率和严格完全反应率,以及较长的反应持续时间,虽然西达基奥仑赛存在一定风险,但考虑到复发/难治多发性骨髓瘤患者的高疾病负担和有限的替代治疗方案,该产品的获益大于风险,FDA批准其上市。
原始出处
Kavita Natrajan, Megha Kaushal, Bindu George, Bindu Kanapuru, Marc R. Theoret; FDA Approval Summary: Ciltacabtagene Autoleucel for Relapsed or Refractory Multiple Myeloma. Clin Cancer Res 2024.
猜你喜欢
- Cancer Cell:吴一龙/周清/易鑫揭示分子残留病灶在非小细胞肺癌放化疗期间的动态变化特征以及临床应用价值
- 聪明吃点心 把握以下原则
- Nat Biomed Eng:给免疫系统踩油门,MIT开发IL-12+明矾疗法,高效杀伤肿瘤,且副作用更低
- 阴道流血和白带异常有哪些表现
- 最高法发布10个药品安全典型案例:含生产、销售假药等案
- Physiol Rev 付琴/王莹/Yan Chen/Yang K. Xiang合作发表心血管磷酸二酯酶的特邀综述
- 广东实现乡镇公共充电桩全覆盖
- 危重症患者连续性肾脏替代治疗(CRRT)剂量调整
- 西双版纳州傣医医院呼吸机等采购项目成交公告
- 吃药伤身?巧用大椎穴治疗风寒风热感冒
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)