首页 > 医疗资讯/ 正文
2024年4月27日,中山大学附属第一医院的罗镇华研究员、冯旭阳副研究员和小儿外科刘钧澄教授团队在柳叶刀Lancet的子刊eBioMedicine 上发表题为“Mucosal-associated invariant T cells promote ductular reaction through amphiregulin in biliary atresia”的研究论文,揭示黏膜相关恒定T细胞(Mucosal-associated invariant T cells, MAIT)异常活化、表现组织修复表型,并高表达生长因子AREG,促进胆道闭锁疾病的胆管反应的分子机制。

胆道闭锁(Biliary atresia, BA)是一种严重的新生儿胆道疾病,胆管细胞损伤导致肝内外胆管阻塞,导致胆汁淤积,并造成肝纤维化[1]。虽然肝门肠吻合手术可以帮助胆汁引流,提高短期疗效[2],但是,无论胆汁引流恢复程度如何,免疫介导的胆管损伤仍然持续存在[3],而且与成人肝病相比,术后BA的肝纤维化进展迅速,导致术后两年内,至少75%的患儿将快速发展为肝硬化,需要进行肝移植[4]。胆管细胞损伤后,免疫应答启动,同时,胆管细胞增殖、肝脏祖细胞激活分化为反应性胆管细胞,参与组织修复。如果胆管细胞损伤持续存在,超过其自我修复过程,那么,胆管细胞异常增殖,并通过与各种浸润的免疫细胞相互作用诱导慢性炎症,最终导致肝脏的血管生成和纤维化,整个过程称为胆管反应(Ductular Reaction, DR)[5]。
最初的免疫反应引起胆管细胞损伤和凋亡,随后,免疫反应一直持续到促纤维化反应的发生,最终免疫反应和胆管反应共同导致了肝纤维化。这其中胆道闭锁的免疫环境如何促进胆管反应和共同导致肝纤维化的发生是领域研究的热点。黏膜相关恒定T细胞(MAIT细胞)是一群非传统的T细胞亚群,在肝脏中非常丰富,占肝内T细胞的15-45%[6, 7],功能多样,既有抗菌、抗病毒宿主防御作用,又可促进组织修复和维持稳态。目前,MAIT细胞是否参与胆道闭锁的免疫反应尚不清楚。
作者探索MAIT细胞在胆道闭锁疾病中的功能,发现BA肝脏MAIT细胞高水平与低生存、胆管增殖和肝纤维化相关。进一步RNA测序分析显示,BA MAIT细胞呈现组织修复表型,上调组织修复相关生长因子AREG。机制研究表明,MAIT细胞通过AREG促进胆管细胞增殖和胆管类器官的生长,也促进和胆管类器官-LX-2混合模型的炎症因子和促纤维化分子表达。以上结果揭示,BA中MAIT细胞异常活化,高表达组织修复相关基因AREG,促进胆管反应。AREG高表达的MAIT细胞可以作为BA治疗的潜在靶点。
该研究创新性构建体外细胞共培养模型,通过单细胞测序分析,发现这一系统的淋巴细胞群比例变化、基因表达谱与BA疾病相一致(图1),可以模拟BA免疫微环境。该模型首先通过RRV感染胆管细胞,随后与外周血单个核细胞共培养,建立方法相对简单,克服胆道闭锁疾病临床标本稀少的限制。因此,该系统可广泛应用于研究,有望成为研究胆道闭锁病理机制的新型工具。
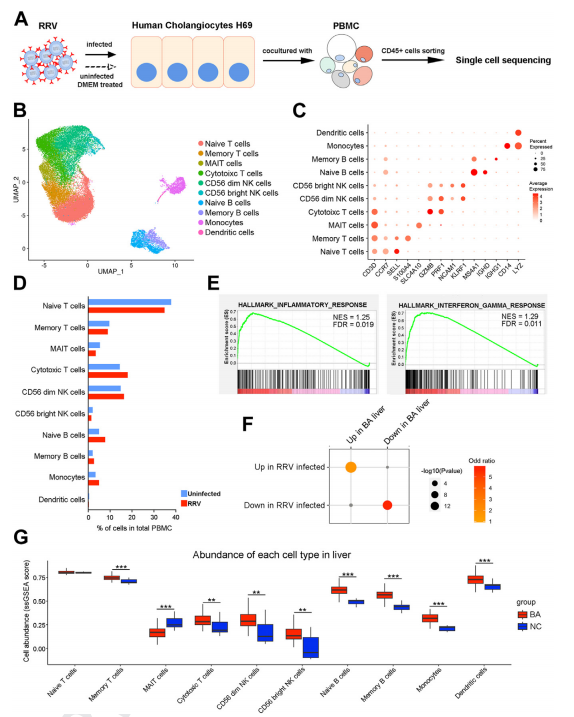
图1 RRV感染胆管细胞的体外细胞共培养模型模拟BA的免疫微环境
中山大学附属第一医院的罗镇华青年研究员和冯旭阳副研究员、小儿外科刘钧澄团队的蒋宏副主任医师为共同通讯作者。中山大学附属第一医院助理研究员肖曼欢为论文的独立第一作者。罗镇华研究员为国家级青年人才项目入选者,中山大学“百人计划”引进人才,博士生导师,主持国家自然科学基金重大研究计划等项目。课题组长期致力于肝脏胆管疾病系统生物学研究,研究方向:运用临床数据分析、生物信息学和3D培养类器官实验生物学等交叉学科手段,研究肝脏胆管疾病的分子标志物、致病机制和治疗方法。课题组长期招聘博士后、助理研究员等职位,请有意者通过电子邮件联系: luozhh35@mail.sysu.edu.cn
原文链接:
https://www.thelancet.com/journals/ebiom/article/PIIS2352-3964(24)00173-7/fulltext
参考文献
[1] Ortiz-Perez A, Donnelly B, Temple H, Tiao G, Bansal R, and Mohanty S K; Innate Immunity and Pathogenesis of Biliary Atresia. Front Immunol, 2020, 11: 329.
[2] Yang J, Gao W, Zhan J, and Feng J; Kasai procedure improves nutritional status and decreases transplantation-associated complications. Pediatr Surg Int, 2018, 34: 387-393.
[3] Lampela H, Kosola, S., Heikkilä, P., Lohi, J., Jalanko, H., & Pakarinen, M. P; Native liver histology after successful portoenterostomy in biliary atresia. Journal after clinical gastroenterology, 2014, 48: 721-728.
[4] Bezerra J A, Wells R G, Mack C L, Karpen S J, Hoofnagle J H, Doo E, and Sokol R J; Biliary Atresia: Clinical and Research Challenges for the Twenty-First Century. Hepatology, 2018, 68: 1163-1173.
[5] Sato K, Marzioni M, Meng F, Francis H, Glaser S, and Alpini G; Ductular Reaction in Liver Diseases: Pathological Mechanisms and Translational Significances. Hepatology, 2019, 69: 420-430.
[6] Dusseaux M, Martin E, Serriari N, Peguillet I, Premel V, Louis D, Milder M, Bourhis L L, Soudais C, and Treiner E; Human MAIT cells are xenobiotic-resistant, tissue-targeted, CD161hi IL-17-secreting T cells. Blood, 2011, 117: 1250-1259.
[7] Tang X Z, Jo J, Tan A T, Sandalova E, Chia A, Tan K C, Lee K H, Gehring A J, De Libero G, and Bertoletti A; IL-7 licenses activation of human liver intrasinusoidal mucosal-associated invariant T cells. J Immunol, 2013, 190: 3142-52.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)