首页 > 医疗资讯/ 正文
不典型CML
不典型慢性粒细胞白血病(aCML)是一种费城染色体(Ph)及BCR::ABL融合基因均阴性的罕见的血液系统恶性肿瘤。《American Journal of Hematology》近日发表一篇综述,阐述了慢性中性粒细胞白血病(CNL)和aCML的诊断、风险分层和治疗。现翻译主要内容供参考,因为原文较长,分为CNL和aCML两个疾病分别整理。

不典型慢性粒细胞白血病
1疾病概况
不典型慢性粒细胞白血病(aCML)是一种罕见的BCR::ABL1阴性造血干细胞疾病,同时表现为MDS和MPN的特征;其特点为中性粒细胞增多,伴循环未成熟髓系细胞,明显的粒细胞异型增生(dysplasia),无单核细胞增多和嗜酸性粒细胞增多。在2001年WHO分类中首次将其作为一个独特疾病,并列入MDS/MPN重叠疾病。2022年,WHO第五版与ICC在命名和诊断标准上出现分裂,第2.3节对此进行详细描述。本综述中保留术语“不典型CML”。
2.临床特征及诊断
不典型CML是一种非常罕见的疾病,每100例BCR::ABL1阳性CML患者中相对发病率为1-2例。多发生于老年患者,诊断时的中位年龄为70-74岁,且男性居多。2023年对2001年至2019年在荷兰癌症登记组登记的347例成年aCML患者的分析显示,中位年龄为72岁(71%为年龄>65岁),65%为男性。临床表现包括频繁脾肿大(范围40-67%),与贫血和/或血小板减少相关的症状,包括皮肤粘膜出血(高达15%),全身症状,与髓外疾病相关的表现,以及更罕见的弥散性血管内凝血,自发肿瘤溶解或急性肾功能障碍的迹象。
多达三分之一的患者在就诊时可能输血依赖。总体预后较差,中位生存时间为10 - 29个月,白血病转化率高(诊断后12-18个月内高达30-40%)。
2.1实验室检查
aCML的标志性实验室特征包括中性粒细胞增多伴WBC≥13X109/L,其中包括至少10%的循环未成熟髓系细胞(早幼粒细胞、中幼粒细胞和晚幼粒细胞),无单核细胞增多、嗜酸性粒细胞增多或嗜碱性粒细胞增多。粒细胞明显表现为重度异型增生。外周血存在≥10%的未成熟髓系细胞是区分aCML与其他MDS/MPN重叠肿瘤、CNL和其他MPN的重要特征。最近的两组37例和110例aCML病例分别显示中位血红蛋白水平为8.3和11 g/dL;血小板为332和150X109/L,中性粒细胞为57.2和31.8X109/L。此外LDH频繁升高(某报道中高达84.2%)。
2.2骨髓形态学
aCML 的骨髓形态表现为细胞过多,表现为粒细胞占优势(M:E比值>10:1)(图1)。粒细胞异型增生很容易看到,超过半数患者表现出一定程度的红系和/或巨核细胞异型增生。粒细胞异型增生(见于外周血和骨髓)的特征为中性粒细胞机能减退,包括假Pelger-Huët细胞和/或异常分割过度或表现出其他核异常,如核碎裂或突起、异常染色质聚集和细胞质颗粒减少。早期病例报告为染色质异常或粗聚综合征(syndrome of abnormal or coarse chromatin clumping),事实上为aCML。红细胞生成常明显减少。40%的病例存在红细胞生成异常。巨核细胞生成在数量上是正常的,但也可以增加或在某些情况下减少。常见巨核细胞生成障碍,后者以小的低分叶形式和(或)小巨核细胞为特征(图1)。还可见不同程度的网硬蛋白纤维化增加。根据定义,循环和骨髓原始细胞必须<20%。
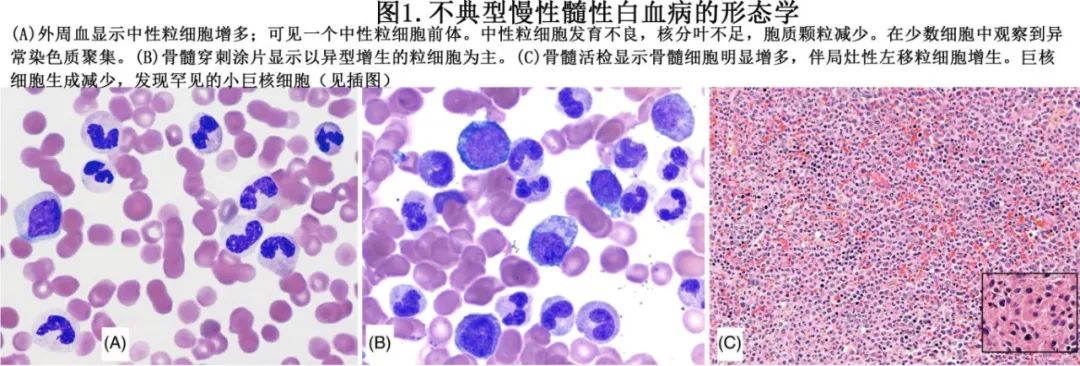
2.3诊断标准
2022年,aCML的命名和标准进行了修订。在WHO第5版的分类中,aCML重新命名为MDS/ MPN伴中性粒细胞增多,仍强调疾病的重叠性,同时避免与“典型”CML相混淆。另外,2022年ICC分类保留了术语“aCML”,但丢弃了“BCR::ABL1阴性”注释,因为它不作为诊断所有MDS/MPN亚型的实际要求。表1总结了WHO和ICC在命名和标准方面的差异。WHO和ICC对aCML的定义为:白细胞≥13X109/L,未成熟髓系细胞占WBC的≥10%,粒细胞生成障碍(dysgranulopoiesis),外周血和骨髓中原始细胞<20%,单核细胞<10%,骨髓细胞过多伴粒细胞增生和异型增生。ICC进一步纳入了MDS对血细胞减少的合格阈值和对<10%嗜酸性粒细胞的正式要求(即需要排除嗜酸性粒细胞过多)。

分子学排除标准包括无BCR::ABL1或 TK 融合伴髓系/淋系肿瘤伴嗜酸性粒细胞增多;无JAK2/CALR/MPL;WHO 增加了 CSF3R 以及 SF3B1 突变的缺失,这些突变通常与 MDS/MPN-RS-T 相关。这两种模式还包括支持性基因异常,包括涉及 SETBP1 和/或 ETNK1(WHO) 的体细胞突变,或存在 ASXL1 和SETBP1(ICC)。
2.4诊断评估和鉴别诊断
aCML 的诊断检查包括外周血和骨髓检查、细胞遗传学或 PCR 检测以排除BCR::ABL1重排、细胞遗传学/FISH 分析,以识别核型异常并排除涉及PDGFRA/B、FGFR1、PCM1::JAK2和其他基因融合,相关基因融合见于伴嗜酸性粒细胞增多和 TK 基因融合的髓系/淋巴系肿瘤(有些可能需要 RNA 测序)。此外,使用髓系基因组合的 NGS 有助于识别支持性和/或潜在可操作的突变,并分配预后风险。对于可能适合 HSCT 的患者,建议进行 HLA 分型。
aCML的鉴别诊断包括CML、CMML及其他MDS/MPN重叠疾病、纤维化前期MF、CNL。非典型CML可以与BCR:: ABL1阳性CML轻松鉴别,因为没有定义的CML的t(9;22)标记和嗜碱细胞增多,并且存在明显的粒细胞异型增生。外周WBC无单核细胞增多症(aCML<10% vs. CMML>10%)可与CMML区分。虽然纤维化前期MF的表现可能与aCML相似,包括白细胞增多、贫血或脾肿大,但存在明显的粒细胞生成障碍,不存在PMF相关巨核细胞异型增生,以及缺乏JAK2、CALR或MPL的典型驱动突变,支持aCML的诊断。在其他类型的MPN中出现嗜中性粒细胞增多症有时会导致诊断混乱,但仔细审查临床病史和分子学结果(例如MPN相关驱动突变)应该可以排除此类病例。
最近对aCML和CNL之间的区别(或许缺乏区别)进行特殊考虑。虽然两者都可能表现为中性粒细胞增多,但值得注意的差异包括循环髓系前体细胞比例较高(≥10%),并且在aCML中观察到明显的粒细胞生成障碍,而在CNL中则完全没有。不考虑这些形态学差异,最近一项对61例aCML和CNL患者的研究表明,两者具有相似的临床、分子和预后特征,因此有理由将两者合并为一个整体。而随后的一篇文章使用来自国家癌症数据库的数据,收集了702例aCML和294例CNL患者的结果,结果显示aCML和CNL的中位生存期分别为15.2个月和23.1个月(p=0.00074),认为组织病理学和病史的差异足以证明将它们作为单独疾病维持下去。最近的WHO和ICC分类将aCML和CNL作为不同的疾病,进一步支持该问题。
3.遗传学特征(略)
4.预后和风险分层
由于疾病的罕见性、不良的生存结局以及对风险评估模型缺乏共识,aCML的预后评分仍然具有挑战性。然而,在阐明影响预后的遗传学变量方面取得了重大进展,这些遗传学变量可能有助于更准确地确定患者风险。
4.1预后
aCML的OS均很差,多介于12到20个月之间;包括混合疾病队列在内的更罕见的早期报告显示,存活时间略长,为24-37个月。与其他相关疾病相比,aCML具有最差的OS率。65例aCML和69例MDS/MPN-U患者的生存期分别为12.4个月和21.8个月(p=0.004),而最近的国家癌症数据库中aCML和CNL的生存期分别为15.2个月和23.1个月(p=0.0074)。
转化为AML在aCML中很常见,高达40%的患者在诊断后12-18个月内发生。根据Breccia等的研究,预测白血病转化的危险因素包括存在可触及的器官肿大、单核细胞增多、骨髓原始细胞>5%、红细胞生成异常和输血依赖。
4.2风险分层
目前对aCML的风险分层尚无共识,但复发的临床和遗传因素确实预示着较差的预后(高龄,严重贫血/白细胞增多)。此外,对支撑疾病、进展和治疗反应的遗传学框架的更好理解,也推动越来越多的基于分子学的风险分层的发展,以改善患者风险。
4.2.1临床模型
早期研究表明,年龄>65岁、女性、Hb <10g/dL、WBC>50X109/L和循环前体细胞是aCML的不良预后因素。Onida等基于76例BCR::ABL1阴性CML患者的数据设计了一种预后评分系统,年龄>65岁、Hb≤10g/dL和WBC计数>50X109/L分别赋予1分,将患者分为“低危”(0-1分)和“高危”(2-3分),相应的中位生存时间分别为38个月和9个月(p<0.01)。
一项包括43例WHO定义的aCML的研究发现,在单因素分析中,较高的WBC、较低的Hb和EZH2突变与较短的OS显著相关;但在多因素分析中,只有血红蛋白水平和红细胞生成障碍保留预后影响。Montalban-Bravo等对65例aCML患者进行的另一项大型研究揭示了年龄(p=0.001)、Hb水平(p=0.024)、血小板计数(p=0.003)、骨髓原始细胞比例(p<0.001)/单核细胞比例(p=0.041)、LDH水平(p<0.001)和异基因干细胞移植(HR=0.144;p=0.007)是多因素分析中OS的独立预测因子。然后利用基线患者特征(年龄、血小板计数、骨髓原始细胞比例和LDH)的模型生成生存期的列线图。
一项当代人群研究证实了移植在aCML中的有益作用。中位随访15.8个月后,110例aCML患者中有86%死亡。在多因素分析中,年龄(>65岁;HR=1.85;p=0.001)、Hb和HSCT (HR=0.51;p=0.039)与OS显著相关,接受异基因造血干细胞移植的患者OS最高(2年OS 59%),因此作者建议所有适合HSCT的患者都接受移植。
4.2.2临床-分子学和基于分子学的模型
最近多项研究确定了影响aCML结局的其他临床-分子学和独立分子学风险因素。梅奥诊所提出一个基于25例aCML患者数据集的模型。多因素分析显示高龄(p=0.003)、低血红蛋白(p=0.008)和TET2突变(p=0.01)是独立不利预后因素。根据年龄>67岁、血红蛋白<10 g/dL、存在TET2突变各1分,建立低危(0-1个危险因素)和高危(≥2个危险因素),相应的中位生存期为18个月和7个月。
在71例aCML患者的大样本研究中,特异性突变的预后意义如下:RUNX1、CUX1和NRAS与更短的OS相关,而SRSF2和SETBP1与更有利的预后相关;ASXL1过于普遍(约90%)而无法视为预后因素。最近,一项多中心国际研究(迄今为止最大的研究之一)评估了分子谱对aCML (n=30)和CNL (n=23)临床结局的影响。虽然没有发现其与AML转化相关,但CBL、CEBPA、EZH2、NRAS、TET2和U2AF1(“高危”基因)突变与较短的生存期相关。使用年龄、性别和白细胞校正的Cox模型,CEBPA、U2AF1、NRAS和EZH2仍保持相关性(HR分别为9.54、5.75、3.63和3.062),而SRSF2突变与更好的生存率相关,与既往数据一致。然后根据突变状态对患者进行分类,而不考虑正式诊断(aCML与CNL),分为四个预后不同的分子学定义亚组。高危亚组定义为:(1)携带高危基因突变,但CSF3R野生型;(2)携带CSF3R突变和任何高危基因。在多因素分析中,高危患者表现出更高的死亡风险。使用该分层系统,在一般aCML/CNL队列中观察到分布范围较大的生存期(13-42.8个月)。有趣的是,与此同时,最近的一项研究仅使用基于转录组学的数据识别三个基因标记(DNPH1、GFI1B、PARP1),系统地将aCML患者划分为预后不良类别。
5.治疗
aCML尚无标准治疗,其总体治疗方案是由个体风险水平和临床概况/患者症状驱动。选择包括常规治疗和支持性治疗(例如羟基脲、干扰素、强化诱导化疗、HMA)、JAK抑制剂、新型靶向药物和联合治疗以及造血干细胞移植。
纳入110例aCML患者的荷兰癌症登记组数据提供了治疗概况。当按年龄分层时,≤65岁患者(n=22)接受了(按频率降序排列)强化化疗(36%)、羟基脲、一线异基因造血干细胞移植、最佳支持治疗(BSC)和激酶抑制剂。>65岁患者(n=88)主要接受羟基脲(50%)治疗,其次为BSC和激酶抑制剂,很少接受HMA、强化化疗或一线HSCT治疗。
5.1常规治疗
aCML的治疗指征为控制骨髓增生、症状性脾肿大、原发性或其他疾病相关症状、贫血和/或血小板减少症。最常用的药物为羟基脲,部分患者可部分和完全血液学缓解,但持续时间短。白消安也可使用,主要在早期的研究中被引用。据报道,干扰素在有限的aCML队列中可诱导完全血液学和持久缓解。在聚乙二醇化干扰素(PEG-IFN-a-2b)治疗BCR::ABL阴性CML的2期研究中,5例患者中有2例在治疗3个月后完全缓解;治疗的中位持续时间分别为36个月和38个月,之后两例患者均因毒性而停止治疗。目前还没有关于当代干扰素制剂(如ropeginterferon干扰素α -2b)在aCML中的相对疗效和耐受性的正式数据。AML样诱导化疗尚未在aCML的治疗领域得到高度利用,其使用通常仅限于具有侵袭性疾病行为的高危患者,或处于加速/急变期的患者,通常作为HSCT的桥接。值得注意的是,最近的一项研究表明,与基于HMA的治疗或其他药物(羟基脲、芦可替尼)相比,接受强化化疗的aCML患者的OS明显更差(p=0.012);但接受诱导的患者(n=3)普遍存在白细胞增多症和较差的体能状态,可能会导致结果偏倚。其他用于aCML的治疗包括低强度化疗、组蛋白去乙酰化酶抑制剂和免疫调节剂,如沙利度胺和来那度胺,但疗效有限。
阿扎胞苷和地西他滨用于aCML是合理的,因为它们是MDS和CML治疗的基石。HMA已在aCML超说明书应用,作为移植的桥接,或用于一线或对另一种药物(如羟基脲,IFN)失败/不耐受的无可靶向突变的不适合移植患者。但HMA的成功率并不一致,而且在许多情况下较为有限。在梅奥诊所研究中,5例患者接受HMA治疗(中位数为5个周期),最佳缓解为40%病情稳定。其他研究显示地西他滨(20mg/m2静脉滴注,第1-5天)的良好缓解,在1至6个疗程的治疗后,8例中有7例达到完全缓解/血液学缓解。缓解持续时间易变,在一个研究中从9个月到20个月不等;2例成功桥接到异基因移植,但一例患者随后死于急性移植物抗宿主病的并发症。
最近的HMA数据较差。Sun等对31例aCML病例的数据进行了系统回顾性分析,发现对当前治疗的缓解率很低,包括对基于HMA的治疗的ORR为33.3%。引人注目的是,在这项研究中,没有任何治疗策略(包括HSCT)对OS有影响。Montalban-Bravo等也调查了65例aCML患者的治疗反应。在接受“疾病修饰”药物治疗的患者中,38例(95%)患者的反应可评估;其中19例(50%)接受单药HMA治疗,6例(16%)联合芦可替尼治疗,4例(11%)联合其他研究药物治疗。ORR为29%,3例患者(8%)达到CR。当评估相对于治疗方案的生存率时,接受羟基脲、芦可替尼或HMA为基础治疗的患者之间没有观察到显著差异。最后,Julien等最近发表了包括43例WHO定义的aCML的预后影响。大多数(65.4%)接受降细胞治疗,主要是羟基脲,16.9%接受TKI (n=12;n=8伊马替尼,n=3达沙替尼),13.2% 接受HMA和14% 接受HSCT。在多因素分析中,降细胞治疗和HSCT均与显著的生存改善无关,而TKI和HMA实际上与显著恶化的OS相关(可能因转化为AML的病例中大量使用HMA而导致混淆)。综上所述,当代研究评估HMA治疗aCML的缓解率约为30%,但没有观察到对生存有利,事实上在某些情况下有害。
支持性治疗包括贫血和血小板减少的管理,遵循与MDS和MPN类似的原则,使用促红细胞生成剂(ESA)和红细胞和/或血小板输注。脾切除和脾照射在aCML的治疗中作用有限(类似CNL),因为并发症及其他部位白细胞增多和髓外造血的潜在恶化。在一个研究中,两例接受脾切除的aCML患者在术后均未显示疾病改善。因此,它们应作为缓解疾病的最后手段加以保留。
5.2 JAK抑制剂
在CSF3R突变的情况下,JAK–STAT通路信号的激活在某些研究高达20%的aCML病例中存在,从而为JAK抑制剂在aCML中的应用提供了机制依据。芦可替尼治疗羟基脲难治性aCML患者(剂量从10毫克增加到20毫克,每日两次)可导致血液学和临床改善,包括脾肿大减少和症状评分改善,但并未伴随着CSF3R突变体VAF的改变。2020年,Dao等发表了一项芦可替尼前瞻性II期研究,纳入23例aCML患者,其中6例(26.1%)有CSFR3突变。共11例患者(47.8%)接受>6个疗程的治疗;但只有2例(8.7%)获得部分缓解,根据国际工作组的标准没有缓解。3级贫血和血小板减少分别为34%和14%。
Fedratinib在MDS/MPN和CNL患者的2期研究中进行测试。其具有广泛的激酶抑制谱,靶向JAK2,但也靶向FLT3, BRD4,并抑制c-Myc表达,理论上可能适合MDS/MPN,因为在MDS中看到myc驱动的克隆扩增。1例aCML患者(CSF3R未突变)入组,另外包括4例CNL和MDS/MPN-RS-T及 1例MDS/MPN-U。60%的可评估患者在第24周出现缓解,包括3例(75%)症状缓解和1例(20%)脾脏缓解(1例患者两者均缓解)。作者得出结论,fedratinib在这些亚群中显示出有希望的初步临床疗效,并且可能由于其更广泛的抑制范围而提供增强疗效。该研究目前正在进行中。
5.3其他靶向药物
目前可用药物的或新药靶向aCML发病机制中特定通路,可能具有临床疗效,其中部分已经过测试和/或超说明书使用。Wang等在2014年的一项研究纳入MDS/MPN(包括n=65 aCML)的研究中指出,尽管治疗主要由羟基脲和HMA组成,但仍有部分患者使用靶向治疗,包括JAK2、RAS、FLT3、MAPK、MYC、AKT和其他TKI抑制剂。如前所述,基于临床前和有限的临床研究,携带JAK2 V617F或CSF3R T618I/膜近端突变的aCML患者可能受益于federatinib或芦可替尼JAKi治疗。携带CSF3R截断突变的患者存在SRC家族- tnk2激酶信号激活,可能受益于双BCR::ABL1/SRC家族激酶抑制剂达沙替尼,但只有体外研究支持。
对于携带激活NRAS或KRAS突变驱动RAF-MEK-ERK通路下游激活的患者(aCML中约10-33%),基于令人鼓舞的AML临床前数据和aCML病例报告,初步证据支持MEK1/2抑制剂曲美替尼(trametinib)的应用。一例NRAS突变的aCML患者在持续接受曲美替尼治疗14个月后获得接近完全血液学缓解。另一例aCML患者携带ASXL1、GATA2、NRAS和SRSF2(但CSF3R未突变),先前接受过维奈克拉、羟基脲和地西他滨治疗,在4个月的曲美替尼治疗过程中获得血液学缓解、症状改善和摆脱输血;病人后来不幸死于败血症。
5.3.1靶向治疗:概念验证
Fontana等对43例aCML患者进行的综合突变谱和基因表达分析显示,27%(10/37)的患者在KIT、NRAS、KRAS和CSF3R基因中存在可操作的突变,所有这些突变都可以用目前可用的药物达沙替尼、曲美替尼和芦可替尼靶向治疗。在这项研究中,使用来自RAS、KIT D816V和CSF3R t618i突变患者的骨髓来源细胞,在存在/不存在特定抑制剂的情况下进行集落测定;显示出对体外抑制剂的敏感性,至少为部分aCML病例的靶向治疗提供了初步依据。值得注意的是,在同一患者中作为早期事件发生的双重ETNK1 G245V和NRAS G12D突变,在体外使用曲美替尼联合phosphoethanolamine靶向治疗,以分别消除RAS通路激活和ETNK1突变的影响,这导致患患者群的强协同效应的组合。然后建立了患者来源的异基因移植物模型来测试曲美替尼在体内的活性。用1 mg/kg曲美替尼治疗可以使动物存活到实验结束,而未经治疗的动物则发生白血病并处死(p=0.07)。外周血细胞流式细胞术显示,与未治疗动物相比,治疗动物的人CD45+细胞减少,免疫组织化学显示,与未治疗动物相比,治疗动物的脾脏和BM中没有人CD45+细胞。总之,这些数据为aCML中使用其他靶向治疗提供了令人鼓舞的初步证据。
5.4新药/联合疗法和临床试验
在aCML的小病例研究中,已经研究或报道了有限数量的药物组合。首先,在一项包括4例aCML患者的MDS/MPN队列的II期研究中评估了芦可替尼联合和阿扎胞苷;57%的患者缓解,其中jak2突变患者和脾肿大患者的缓解率最高,该组合通常耐受良好。其次,在一例52岁的aCML患者中,地西他滨联合CAG化疗(低剂量阿糖胞苷、阿柔比星和G-CSF)在第一个疗程后完全缓解。患者随后接受三个额外周期的巩固治疗;2个月后患者恢复良好,白血病细胞残留<0.01%。第三,如上所述,体外对ETNK1 G245V和NRAS G12D突变的双重抑制在患者群中产生协同效应,值得进一步探索。
ABNL-MARRO 001研究(未经治疗的MDS/MPN和复发/难治性重叠综合征的新疗法一揽子研究)是一项国际、开放标签、正在进行的MDS/MPN重叠综合征的新型活性骨髓靶向化合物组合的1/2期研究。每组计划测试一种髓系靶剂联合ASTX727,ASTX727是一种口服药物,由固定剂量的地西他滨和胞苷脱氨酶抑制剂E7727、cedazuridine联合使用。目前该组正在评估ASTX727与JAK1抑制剂itacitinib (INCB039110)的联合疗效。
另一项I/II期试验正在评估阿扎胞苷、维奈克拉和pevonedistat联合方案,pevonedistat是NEDD8活化酶的选择性抑制剂(泛素化和特定蛋白质/蛋白质稳态降解所必需的),用于新诊断继发于其他髓系疾病的AML患者,包括aCML。该联合方案先前已证明在MDS和AML中具有临床活性。另一项II期研究正在评估盐酸拓扑替康加卡铂联合或不联合veliparib(一种聚[ADP-核糖]聚合酶抑制剂)治疗继发于MPN的AML或晚期aCML。
5.5造血干细胞移植
异基因造血干细胞移植仍然是aCML唯一有效的治愈方式。第一个系列报道是由Koldehoff等报道的,描述9例接受异基因造血干细胞移植的aCML患者。移植后中位随访55个月,9例患者中有8例存活(9年后估计生存率为89%)。得出结论,HSCT具有治愈潜力和可接受的移植相关发病率。随后的随访报告了21例患者的5年总生存率为80%,中位生存期为48个月。
aCML中使用HSCT的最大研究来自Onida等和欧洲血液和骨髓移植协会(EBMT),42例患者移植时的中位年龄为46岁;从诊断到移植时间为7个月;64%接受相合同胞供者移植;24%接受降低强度预处理。5年无复发生存率为36%,移植相关死亡率为24%,复发率为40%。在这项研究中,影响生存的唯一因素是患者年龄和EBMT评分。随后,Itonaga等报道了19例患者接受HSCT的结果(n=15 aCML;n=4 CNL);1年OS >58%,且在体能状态较好且BM原始细胞<5%的患者中更高。
荷兰癌症登记组数据显示,2001年至2013年及2014年至2019年,≤65岁患者的HSCT率从16%(12/77)增加到50%(11/22),呈显著趋势(p=0.003)。移植队列(n=15)的详细资料如下:中位年龄58岁(47-70),15例患者中有6例接受一线移植,15例患者中有9例接受强化诱导化疗或TKI治疗;7例接受低强度预处理。异基因造血干细胞移植具有明显的生存优势;多因素分析证实其OS最高(2年OS率59%)。最近的另一组65例aCML患者的多因素分析发现,异基因造血干细胞移植是改善生存率的独立预测因子(HR=0.144,P=0.007)。
虽然绝大多数证据支持HSCT的生存优势,但其余结果却较为微妙。MDACC的早期研究中包括混合队列(MF、CMML、 aCML;共20例), Mittal等报道了由于移植物抗宿主病和败血症导致的移植相关死亡率较高;中位随访17.5个月后,2年生存率为47%,无病生存率为37%。最近一项纳入31例aCML的研究发现,没有任何治疗策略(包括HSCT)对OS有影响。
大多数aCML患者在接受一线药物治疗后进行异基因造血干细胞移植。在Montalban-Bravo等人最近的一项研究中,接受移植的7例aCML患者(11%)中,2例是在地西他滨达到CR后进行移植,1例是在芦可替尼实现脾脏缩小后进行移植,2例是在克拉屈滨联合低剂量阿糖胞苷挽救性治疗后进行移植(包括1例既往对阿扎胞苷无反应),1例是在既往两线治疗后进行移植;只有1例患者在没有任何其他治疗的情况下进行一线移植。
对于aCML中HSCT的最佳时机,目前还没有明确共识。部分专家主张所有适合移植的患者进行HSCT。根据CMML的相应数据,在疾病的慢性期(相对于加速/急变期)移植可能与更有利的结局相关。另一种方法是根据目前确定的临床和分子学预后因素对患者进行风险分层,并在高危病例中预先提供HSCT,而其他病例推迟移植。然而,考虑到aCML的预后不佳,高危突变的频率,对常规治疗的总体低反应,以及移植提供的明确的长期生存优势,作者倾向于支持适合移植的患者进行一线HSCT。其他重要的考虑因素包括供者的可用性、可靶向突变的存在和分子靶向药物作为桥接治疗的作用(与强诱导治疗相比),以及预处理方案的强度/类型。
与CNL一样,对于携带CSF3R突变的aCML患者,移植前进行分子学监测可能有助于预测移植后复发。
5.6整体管理
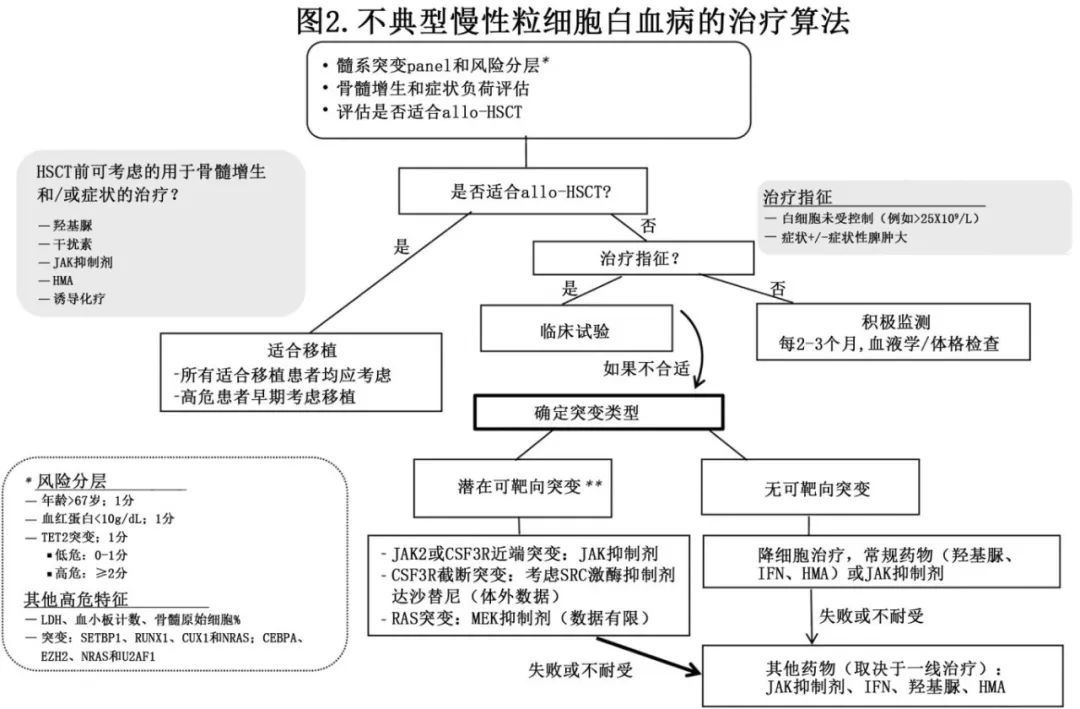
gottlib和Breccia对aCML的治疗方法进行了全面的总结,根据现有证据和临床经验提出的治疗算法如图2所示。总之,治疗方法应为风险调适和症状导向。考虑到预后不佳,建议适合移植的患者中优先考虑HSCT作为一线治疗。作为移植前的桥接,强化诱导化疗(侵袭性疾病行为)或降细胞治疗(羟基脲vs. IFN)或JAKi可控制白细胞增多、症状和/或脾肿大。对于不适合移植的患者,建议在可用的情况下参加临床试验。如果患者在其他方面无症状,则应采取积极观察。如果必须治疗,无论是因为进行性白细胞增多(通常WBC>25-30)、症状性脾肿大还是全身症状,使用标准药物(羟基脲、IFN、HMA)或JAKi(可能优先用于症状严重或高度增殖性患者)进行降细胞治疗均有获益。对于重度、输血依赖或症状性贫血的患者,ESA或MDS治疗中包含的其他药物(如danazo)的标准治疗可能具有部分疗效。原则上,如果确定了潜在的可操作突变(例如CSF3R、JAK2、RAS),则可以考虑使用JAK或MEK抑制剂等药物进行靶向治疗,优先在临床试验的支持下,否则取决于是否可作为超说明书指征。部分专家分享了他们选择MDS或MPN治疗的策略,并根据具体情况应用它们来解决aCML患者的具体需求。
参考文献
Szuber N, Orazi A, Tefferi A. Chronic neutrophilic leukemia and atypical chronic myeloid leukemia: 2024 update on diagnosis, genetics, risk stratification, and management. Am J Hematol. 2024;1‐28. doi:10.1002/ajh.27321
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)