首页 > 医疗资讯/ 正文
在患MMR缺陷肿瘤的疑似林奇(Lynch)综合征患者中,高达70%的患者在MMR基因中缺乏可识别的胚系致病性变异,这被称为林奇样(Lynch-like)综合征(LLS)。之前的研究已经报道了多种LLS相关肿瘤中双等位基因体细胞MMR失活。此外,将肿瘤检测结果转化为患者管理仍有争议。本研究旨在评估常规工作流程中实施肿瘤MMR基因检测所面临的挑战。研究者描述了229例LLS患者的临床特征。对39个可获得的肿瘤进行了MMR基因检测,采用两个变异丰度(VAF)阈值(≥5%和≥10%)对结果进行分析。
VAF≥5%时发现的双等位基因体细胞事件多于VAF≥10%时(35.9% vs. 25.6%),免疫组化结果不一致的发生率增加(30.8% vs. 20.5%)。在疑似LS病例的诊断算法中,目前识别MMR体细胞打击的效用存在解读困难。
研究背景
林奇综合征(LS)约占结直肠癌(CRC)病例的3%,也易发生子宫内膜、卵巢和其他肿瘤。LS是由错配修复(MMR)基因(MLH1、MSH2、MSH6或PMS2)之一的胚系失活或EPCAM基因缺失引起,其分子诊断主要依赖于肿瘤MMR缺陷(MMRd)筛查(微卫星不稳定性[MSI]评估和/或MMR免疫组织化学[IHC]染色)以及胚系MMR检测。在患有与MMR基因体系甲基化不相关的MMRd肿瘤的患者中,多达70%的患者缺乏可识别的胚系致病性变异(PV)。这些病例被称为林奇样综合征(LLS)。最近的研究报告,在15%-95%的LLS肿瘤中发生MMR基因的体细胞双等位基因失活,可能代表散发性事件。此外,MUTYH或MSH3的胚系双等位基因失活,或POLD1和POLE基因的外切酶结构域内的胚系PVs可导致MMRd。
LLS的临床管理具有挑战性,因为它们代表了一组异质的遗传性和散发性疾病。与LS个体相比,LLS亲属患CRC的风险较低,但高于散发病例。本研究对LLS队列进行了临床和分子特征分析,并对可获得肿瘤的患者进行了肿瘤检测。本研究旨在评估在常规基因检测流程中实施肿瘤分析的可行性,以改善LLS患者的诊断和管理。
患者和方法
完整的临床队列包括229例LLS病例(52.4%的男性和47.6%的女性):105例之前报告的和124例新发现的肿瘤中有MMRd和/或MSI的患者,但没有胚系MMR PVs,也没有MLH1启动子的体细胞超甲基化。临床及肿瘤数据见表1。
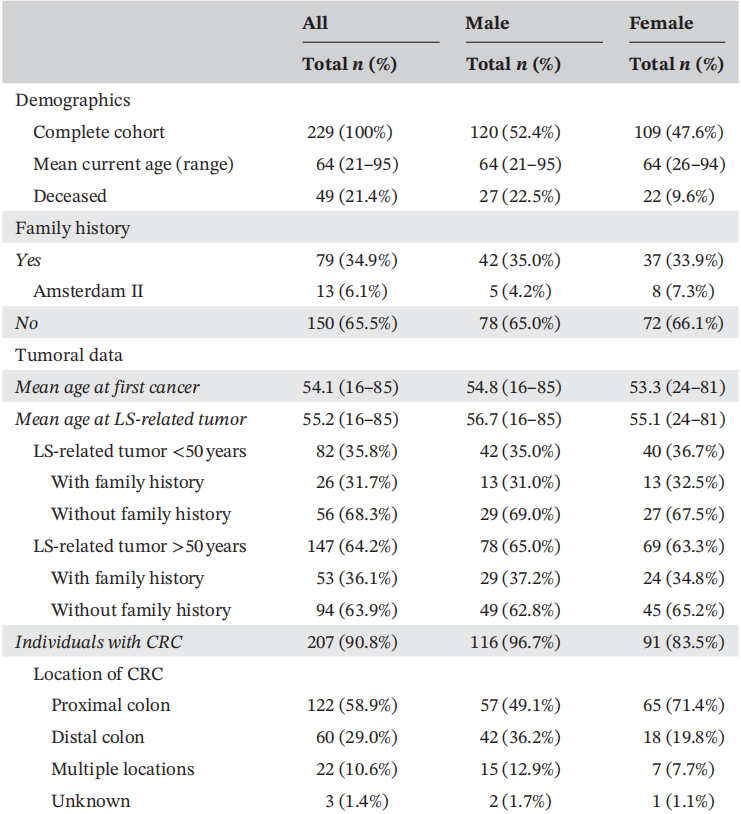
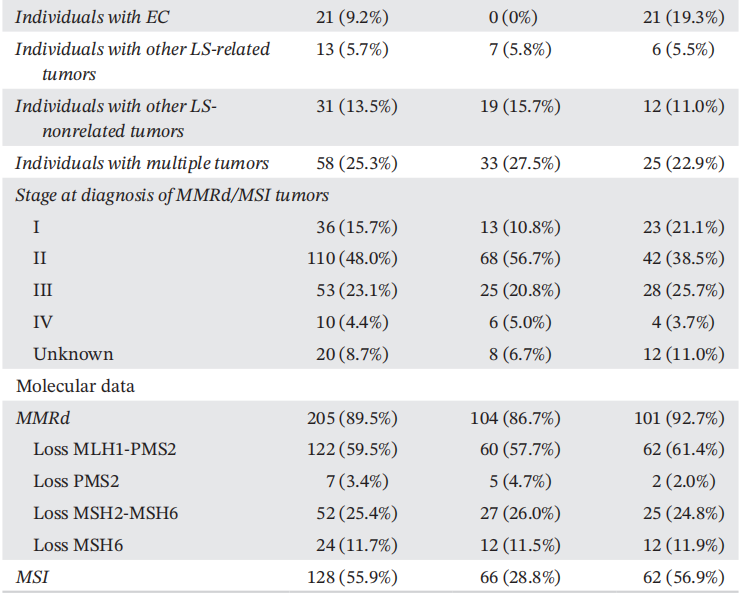
表1
在229例LLS患者中,41例肿瘤细胞占比>70%的肿瘤样本进行了分子检测,并符合以下纳入标准:(1)MSI和/或MMRd肿瘤;(2)MLH1、MSH2、MSH6、PMS2或EPCAM中未发现胚系(可能的)PVs,这些PVs是根据其IHC MMR表达模式进行测序的;(3)无体细胞MLH1启动子超甲基化。使用适用于体细胞检测的NGS panel对从结直肠癌或子宫内膜癌中提取的DNA进行分析。在VAFs≥5%且覆盖频率≥30X的编码区和相邻内含子区(即±20 bp)中发现的所有变异均来自以下基因:MLH1(NM_000249.3)、MLH3(NM_001040108.1)、MSH2(NM_000251.1)、MSH3(NM_002439.3)、MSH6(NM_000179.2)、MUTYH(NM_001128425.1)、PMS2(NM_000535.5)、POLD1(NM_001256849.1)和POLE(NM_006231.2)。变异分类使用了vaRHC,这是一个根据ACMG/AMP ClinGen基因特异性指南开发的半自动变异解读工具。在可能的情况下,研究者通过比较配对肿瘤DNA中胚系杂合SNP(单核苷酸变异)的等位基因分数来评估杂合性缺失(LOH)。如果肿瘤组织中至少有3个构成性杂合SNPs显示等位基因不平衡,则认为LOH状态为阳性。在VAFs≥20%的肿瘤中发现的变异通过Sanger测序在血液来源的DNA中重新检测,以按照建议丢弃之前遗漏的组成性变异。
研究结果和讨论
本临床系列包括229例LLS个体。34.9%的个体有LS相关肿瘤家族史,发生LS相关肿瘤的年龄与家族史无相关性。首次诊断癌症的平均年龄为53.9岁(范围:16-85岁)。大多数女性被诊断患有CRC(90.8%),主要发生在近端结肠(58.9%),19.3%的女性还被诊断患有子宫内膜癌,5.7%被诊断患有与LS相关的其他肿瘤(卵巢癌、胃癌、小肠癌和尿路上皮癌)。MMRd的IHC模式与其他已发表的结果一致,其中很大一部分显示缺乏MLH1‐PMS2表达(59.5%)和MSH2‐MSH6表达(25.4%)。表1总结了人口统计学、肿瘤和分子数据。
在41例LLS肿瘤中,有2例(4.9%)因DNA扩增失败而被排除。当VAF阈值≥5%时,39例患者中有14例(35.9%)检测到与IHC模式一致的双重体细胞打击,其中10/14例(71.4%)检测到2个体细胞MMR PVs,4/14例(28.6%)检测到1个体细胞MMR PV和同一MMR基因的LOH(杂合性缺失)。此外,一些患者存在影响同一MMR基因的两次以上体细胞打击(病例5、104、208)。此外,在11/39例(28.2%)样本中,检测到符合肿瘤MMR免疫组织化学模式的一个体细胞打击。由于缺乏可提供信息的SNPs(单核苷酸变异),其中9例不能评估LOH,因为NGS前的基因检测算法只针对1或2个MMR基因。12/39(30.8%)的病例发现与免疫组织化学模式不一致的体细胞打击。此外,具有一个相容体细胞打击的4例患者在其他MMR基因中携带额外的体细胞 PVs,这与肿瘤MMR IHC模式不一致,因此导致解读困难(病例45、61、78、194)(图1A)。
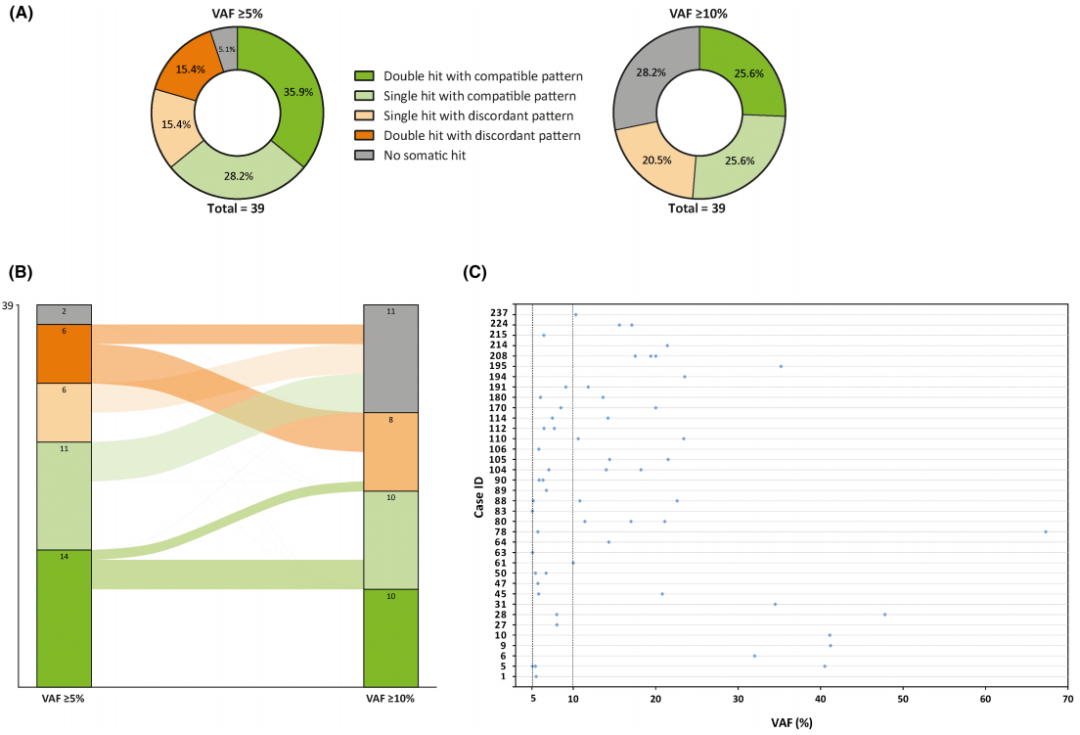
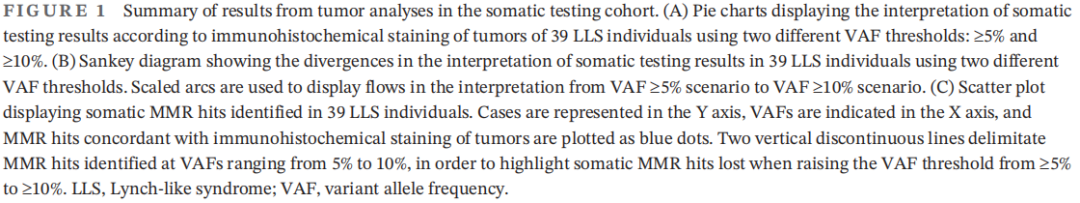
图1
为了解决解读结果不明确并且由于缺乏正交验证,研究者将VAF检测阈值提高至≥10%,以减少潜在的假阳性信号和乘客突变,这些突变是MSI的影响,而不是其原因。通过这一调整,根据IHC MMR状态,39例患者中有10例(25.6%)发生了兼容的双重体细胞打击(相比之下,之前为35.9%)。不一致结果的发生率也显著下降(30.8%降至20.5%)。然而,无体细胞打击的患者数量增加(5.1%增至28.2%)(图1A-C)。
在POLE、POLD1、MSH3或MUTYH等可能导致MMRd的其他基因中未发现PVs。
在报告的双等位基因MMR失活百分比中,存在广泛的异质性,这可以部分归因于实验设计和数据分析的差异,因此难以进行无偏倚比较。此外,体细胞分析的解释所带来的局限性也尚未得到明确的描述。考虑到MMRd肿瘤的高突变性,可能会出现不明确的解读,这证明了制定标准化方案的必要性。本研究表明,单个肿瘤可能存在涉及不同MMR基因的多个打击。此外,在30.8%(VAF≥5%)或20.5%(VAF≥10%)的病例中,主要的MMR打击与IHC模式不一致。这些案例被认为是不确定的。
病例198说明了本研究的一个显著发现(图2A)。常规肿瘤筛查发现PMS2表达缺失(图2B),提示仅PMS2胚系突变分析。然而,MLH1 c.113A>G; p.(Asn38Ser) PV在肿瘤DNA中被检测到,VAF=59.1%,并随后在血液DNA中得到证实(图2C),因此患者198被重新分类为LS。这一发现凸显了之前的基因检测策略的缺点之一,即根据IHC模式靶向候选MMR基因。最近,NGS技术的出现使得在大多数诊断流程中实施了多基因panel,从而可以同时分析疑似LS患者的所有MMR基因。然而,由于存在高度同源的假基因,使用基于NGS的方法分析PMS2在诊断环境中仍然存在挑战。

图2
配对体细胞-胚系检测已被反复建议作为一种有用的方法,通过识别引起LS的胚系PVs以及LLS肿瘤的双等位基因MMR体细胞突变来提高诊断率。此外,配对分析可以简化对MMR变异的解读,特别是那些在低VAF检测到的变异。尽管MMR基因的嵌合突变似乎罕见,但该策略也具有检测体细胞嵌合的潜力。
正如本研究所示,对LLS患者肿瘤分析的解读有时存在争议。通过使用本研究的方法,双体细胞MMR失活只能解释研究系列中最多1/3的MMRd肿瘤。此外,对于未发现双等位基因MMR变异的LLS患者是否应按照LS进行治疗,还是应根据个人史和家族史进行治疗,目前尚未达成共识。在多基因检测时代,如果获得的结果不能提供信息,则可以大概率排除胚系原因。这一事实,加上体细胞分析的解读困难,以及其对LLS患者临床管理的影响缺乏共识,提出了目前MMR体细胞打击识别在疑似LS病例常规诊断算法中的效用的疑问。在常规诊断中,研究者建议只有在验证所使用的方法显示出高信息性结果率之后,才对LLS肿瘤的MMR基因的体细胞变异进行分析。
参考文献:
Rofes, Paula et al. “Tumor analysis of MMR genes in Lynch-like syndrome: Challenges associated with results interpretation.” Cancer medicine vol. 13,7 (2024): e7041. doi:10.1002/cam4.7041

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)