首页 > 医疗资讯/ 正文
瘙痒(pruritus)是一类在皮肤病和全身性疾病中十分常见的症状,被定义为一种需要抓挠的不愉快的感觉。
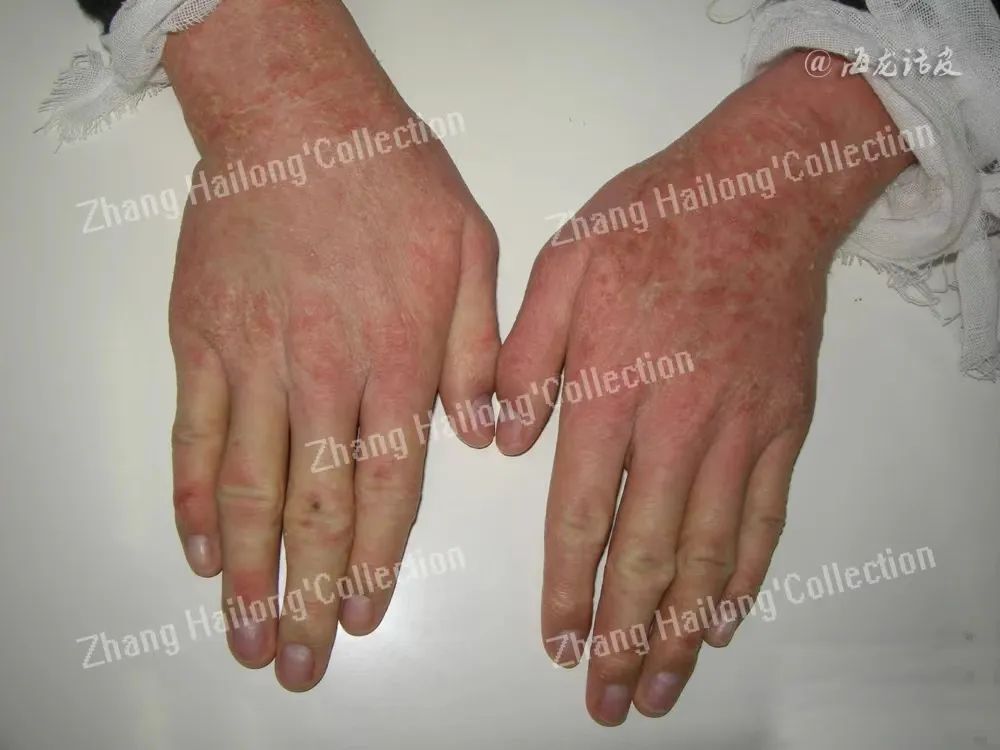
瘙痒根据发作时间的持续长短可分为急性瘙痒和慢性瘙痒;也可以根据发作来源的不同,分为全身性疾病瘙痒(如尿毒症、胆汁淤积等引起的瘙痒)和皮肤病性瘙痒(如特异性皮炎和银屑病引起的瘙痒)。在临床上,皮肤引起的不自主的搔抓常引起瘙痒部位的刺痛感和烧灼感,给患者带来不适体验感。
此外,皮肤瘙痒常引起患者睡眠障碍,严重影响患者生活质量,导致心理疾病甚至自杀,给患者家庭和社会带来沉重的负担。因此研究皮肤瘙痒的发病机制,从而控制皮肤瘙痒一直是临床研究的焦点。
昼夜节律(circadian rhythm,又称生物钟)是指在生理或生物学行为上所表现的以约24h为周期的生物节律。在哺乳动物中,位于下丘脑的视交叉上核(suprachiasmatic nucleus,SCN)被广泛认为是协调整个身体时钟的昼夜节律振荡器,由视网膜下丘脑束传来的光信息通过SCN承载的昼夜起搏器达到与生物节律的同步。
大量研究表明机体的睡眠、体内激素水平、新陈代谢、以及食欲等众多的生理过程离不开生物钟的调控,而免疫、内分泌、消化、心血管等方面疾病的发生也受到生物钟的调控,皮肤正常生理活动如温度、PH值、皮肤渗透性、经皮失水量(transepidermal water loss,TEWL)等的调节,以及皮肤相关疾病如皮肤癌、皮肤瘙痒的发生与生物钟的调控密切相关。研究发现皮肤瘙痒具有显著的昼夜节律,但其具体机制不明,进一步研究揭示皮肤瘙痒昼夜节律的调控机制将为控制瘙痒提供重要的线索。
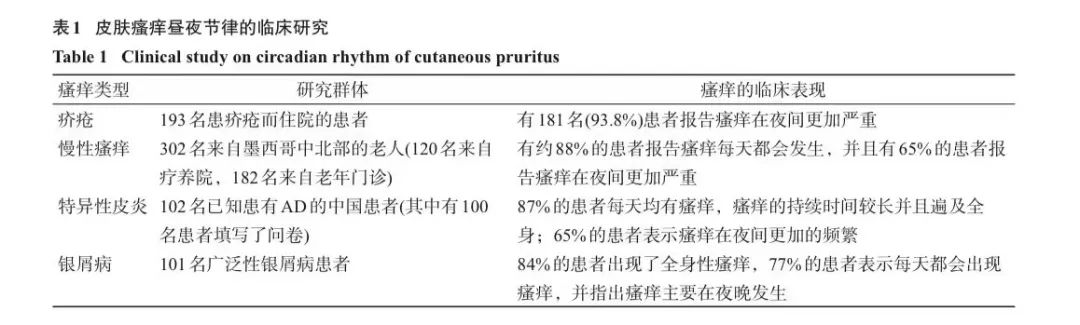
皮肤瘙痒昼夜节律的临床研究
近年来,皮肤病如疥疮、慢性瘙痒,特异性皮炎(atopic dermatitis,AD)及银屑病等引起瘙痒的临床研究显示,瘙痒常在夜间加重,提示皮肤瘙痒具有明显得昼夜节律,具体研究结果和昼夜节律特征总结见下表。
瘙痒昼夜节律的主要调控因素
皮质醇
下丘脑-垂体轴是人体昼夜节律调控的重要因素。皮质醇是由肾上腺皮质产生的类固醇,具有抗炎作用,其在早晨分泌增加,而夜晚分泌下降,具有典型的24小时昼夜节律。
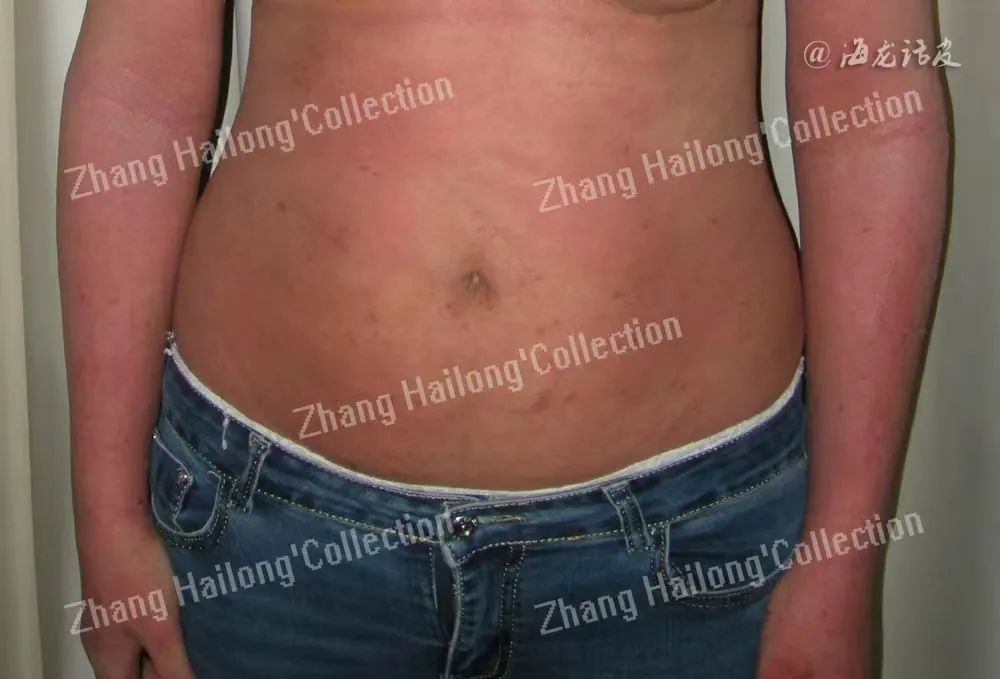
除了肾上腺分泌的皮质醇以外,还有研究表明,应激暴露的角质形成细胞促肾上腺皮质激素释放激素分泌增高,可使皮肤角质形成细胞和成纤维细胞表达分泌促肾上腺皮质激素,进而导致皮质醇和皮质酮的分泌。血清皮质类固醇水平通常在晚上处于低谷,这意味着该激素的抗炎作用在这段时间内最低,可能会加剧炎症性皮肤病。因此,许多学者认为夜间AD引发瘙痒强度的增加和皮质醇的节律密切相关。
褪黑素
褪黑素主要由松果体分泌,其他组织如皮肤组织也可以分泌褪黑素。褪黑素的分泌也具有昼夜节律,在夜晚(黑暗)开始不久后增加分泌,在凌晨1:00-4:00其血清学水平达到峰值。规律分泌的褪黑素通过影响其受体,驱动靶组织结构中的昼夜节律,如腺垂体或同步外周振荡器,如胎儿肾上腺,还有许多其他组织外周组织。褪黑素的这种分泌节律还可以有效的调节睡眠-觉醒周期,褪黑激素浓度在黑暗之前随着光线的消退而上升,在黑暗中达到峰值,并在暴露于光线时下降以促进清醒,褪黑激素分泌节律还在SCN中起作用,以减弱生物钟的唤醒促进信号,从而促进睡眠,褪黑素的分泌异常和睡眠障碍的出现以及抑郁症的发展有关,所以褪黑素常被认为是昼夜节律的主要调控因素。
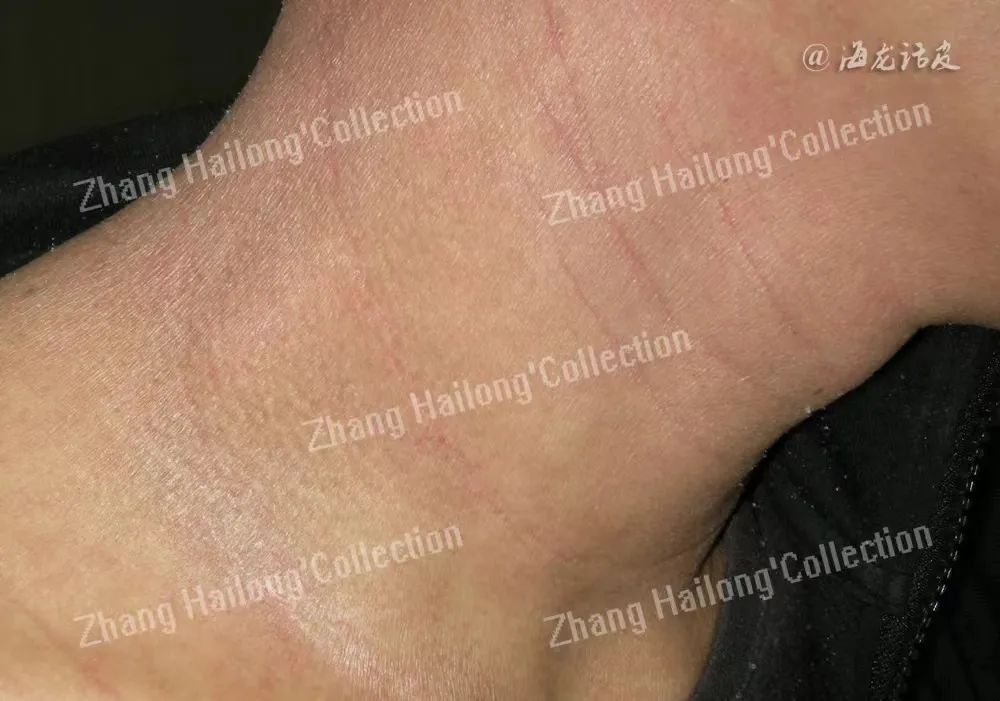
研究报道褪黑素具有较强的抗炎和抗氧化能力,可能与AD的慢性皮肤炎症和睡眠障碍直接相关,但是关于AD患者体内褪黑素水平的研究结果差异较大。
另有研究表明,褪黑素能够直接作用于肥大细胞的数量,抑制肥大细胞的增殖,同时褪黑素在炎症反应时还能通过影响T细胞活性,抑制Th17细胞释放相应细胞因子,肥大细胞的增殖以及Th17细胞在瘙痒发展中的作用已经得到证实。已有研究采用褪黑素进行干预用来调节昼夜节律,因此一些学者也提议用褪黑素来治疗夜间瘙痒。综上,褪黑素水平的夜间波动与特应性皮炎的瘙痒密切相关。
人体核心温度
人体的核心温度是由位于人体脑部下丘脑内部的体温调节中枢所设定的。核心温度的变化具有显著的昼夜节律,在傍晚达到峰值而在清晨降至最低。人体核心温度与皮肤温度的变化呈现出相反的模式,即核心温度的降低总是伴随着皮肤温度的升高,两者具有相反的节律。研究发现,在非眼球快速运动(non-rapid eye movement,NREM)睡眠阶段,随着下丘脑的体温调节中枢温度设定点降低,人体的核心温度随之降低从而导致外周皮肤温度升高,而瘙痒强度随外周皮肤温度的升高而增强,因此在NREM睡眠阶段,核心温度的降低、皮肤温度升高从而诱导瘙痒的发生。
细胞因子
白细胞介素(interleukin,IL)-2、IL-8被证明能够诱导瘙痒。IL-2被认为是诱导慢性瘙痒的一种介质。研究发现:与未出现瘙痒症状的银屑病患者相比,患有瘙痒的银屑病患者病变的皮肤组织中IL-2免疫反应性淋巴细胞显著增加,证实了促炎因子IL-2在诱导银屑病瘙痒中的作用。另有研究发现IL-2的含量总是在夜间增加。因此IL-2也被认为是夜间瘙痒的诱因。新近研究说明,IL-8受时钟基因(circadian locomotor output cycles kaput,CLOCK)的负向调控,在紫外线辐射诱导的昼夜节律紊乱中,CLOCK表达下调而IL-8表达增加,从而诱导皮肤炎症和瘙痒,提示IL-8参与了瘙痒昼夜节律的调控。
前列腺素
皮肤屏障功能障碍是AD发病的关键因素之一,AD患者中常存在皮肤屏障功能的紊乱。前列腺素(prostaglandin,PG)D2是由前列腺分泌的前列腺素之一,具有修复皮肤屏障损伤的功能。小鼠体内PGD2的含量出现昼夜波动,在白天达到最高,在夜间降至最低。有研究表明,PGD2和PGE2通过特异性前列腺素受体加速了机械抓挠引起的皮肤屏障破坏的恢复过程。因此有学者怀疑PG的昼夜节律在夜间瘙痒加重的患者中被打乱。
生物钟基因对于瘙痒的调控
在分子水平上,生物钟由核心生物钟基因调控,主要包括有CLOCK、BMAL1、PER、Cry、RORA和核受体亚家族1D组成员1(nuclear receptor subfamily 1 group d member 1,NR1D1)。昼夜节律由BMAL1/CLOCK复合体驱动的正回路和PER/CRY复合体介导的负反馈回路调控的,它们对于整个生物体维持日常节律,调节细胞的周期具有核心作用。
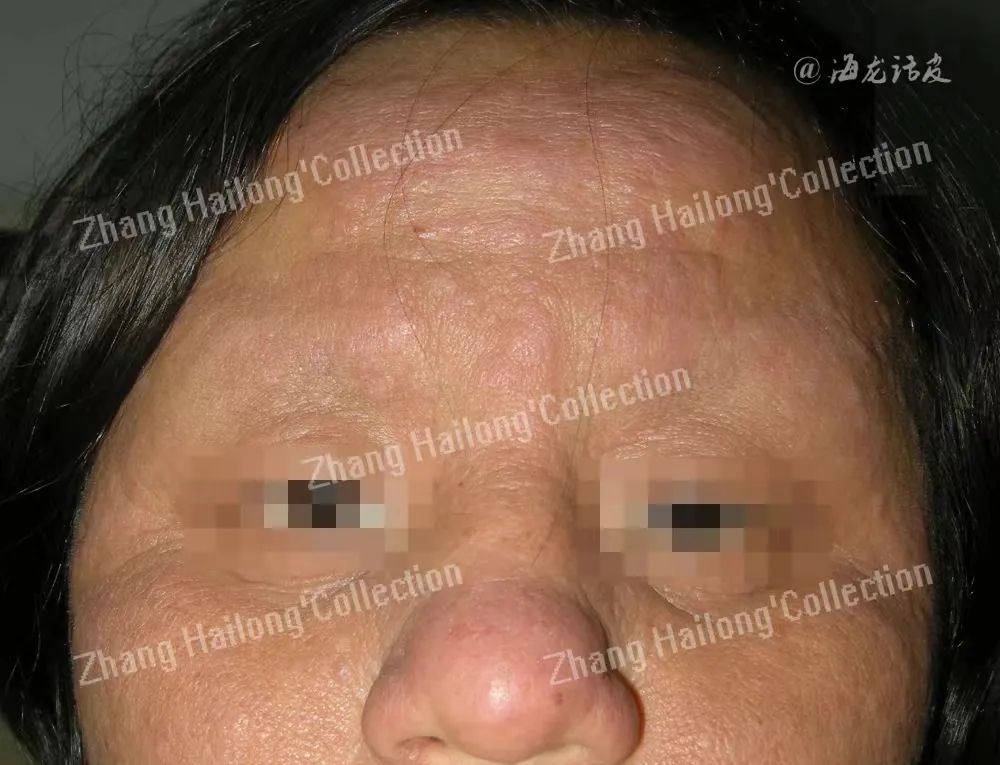
JAK/STAT通路
AD的发生与JAK/STAT通路的作用密不可分。JAK/STAT通路的发生机制具体来看,就是两种经过活化后的JAK蛋白经过相应的组合后促进STAT蛋白的磷酸化进程并诱导STAT蛋白的二聚化,STAT蛋白经过二聚化后异位到细胞核上影响相关基因的表达,从而诱导细胞中IL-4、IL-31因子的产生。而IL-4、IL-31在AD的发病中起到了至关重要的作用,所以JAK/STAT通路就是主要通过诱导IL-4、IL-3的产生来介导AD瘙痒的发生。JAK/STAT通路发挥作用的机制受到生物节律的调控。
有研究说明,JAK/STAT通路是IL-4诱导时钟基因PER2表达的重要媒介,IL-4能够通过激活JAK/STAT信号通路和HaCaT角质形成细胞中PER3启动子的活性来增强PER2表达,同时发现由IL-2介导JAK/STAT通路引起的PER3表达的上升会引起体内多种促炎因子的释放从而助于AD的发生。新近研究发现,在Cry缺失的小鼠体内,STAT蛋白的磷酸化程度出现了明显的下降,说明了Cry对于JAK/STAT通路的调控作用。
另一相关的研究表明:JAK/STAT的相关表达产物在果蝇体内呈现出昼夜循环的表达,STAT92E的含量会在傍晚达到峰值,并且循环会一直持续到第2天。根据上述研究说明,Cry基因可以通过调控JAK/STAT通路从而诱导AD的发生。
NF-κB通路
NF-κB是核心转录因子之一,在诱导细胞促炎因 子IL-6,IL-1β的表达方面起到了关键的作用。IκBa的磷酸化对于NF-κB因子的激活具有重要作用:NF-κB因子受到激活后转移到细胞核中对靶基因的相关表达进行调控,从而对促炎因子IL-6,IL-1β的表达进行诱导。慢性肾病患者经历的最普遍的症状是瘙痒以及血液中磷酸钙(calcium acid phosphate,Cap)含量的升高。Cap诱导AD瘙痒发生的通路离不开IL-6的参与:在对某患者群体体内的IL-6阳性染色体进行分析后发现,患者非瘙痒皮肤中的IL-6含量远低于瘙痒皮肤内IL-6的含量,在进行血液透析的患者中,血液中IL-6含量竟是正常人的5倍之多。这些研究足够说明IL-6在诱导慢性肾病相关瘙痒中的关键作用。
研究发现,活性氧(reactive oxygen species, ROS)在分子层面能够抑制IκBa的磷酸化来抑制 NF-κB发挥作用。并且相关研究发现了ROS与生物钟间的联系。该研究对体内缺失BMAL1以及BMAL1正常的2组小鼠进行了研究,分别取2组小鼠的真皮与表皮进行分析,测定与对比了2组小鼠体内ROS的含量的差异,结果发现,在BMAL1缺失的小鼠体内,ROS的含量更高,证实了ROS的含量的变化是受时钟基因调控。因此BMAL1调控ROS含量的过程影响了NF-κB诱导IL-6因子的生物学过程,这很可能诱导了AD的发生。
AQP3水通道蛋白介导
研究表明:水通道蛋白3(aquaporin 3,AQP3)在皮肤水合作用中发挥的效应可能与AD的发生相关联。研究发现,在AD病变的人类皮肤组织样本中,与AQP3相关基因的转录以及蛋白质的表达显著增加,并且在病变皮肤组织中,还发现对于AQP3形成具有强诱导作用的CCL17也呈出高表达,这表明了AQP3对于AD病+变皮肤表皮增生起到了作用。AQP3在正常小鼠皮肤中的表达被检测出具有明显的昼夜节律,而在CLOCK基因发生突变的小鼠体内,AQP3急剧减少。根据荧光素酶显色技术表明,AQP3基因的转录工作通过时钟基因在D位点结合蛋白质激活,说明了小鼠AQP3的昼夜节律受到时钟基因的严格调控。
另一研究也发现,人类皮肤内的AQP3蛋白随24h的振荡和循环与小鼠体内AQP3的振荡循环基本一致,而且还发现人体内AQP3发挥的相关作用受到内源性CLOCK/BMAL1时钟基因异二聚体的调节。故通过上述研究可以说明,生物钟基因可能通过控制AQP3参与对AD的调控。
结语
研究生物钟基因在瘙痒昼夜节律中的作用和调控机制,将为阐明瘙痒的发生和调控机制提供重要线索,也将为控制瘙痒、缓解皮肤病奠定基础,因此,这仍将是未来皮肤领域一个非常重要的研究方向。
参考文献:
1.姜子超,桑晓雪,鲁建云,高丽华.皮肤瘙痒昼夜节律的研究进展[J/OL].中南大学学报(医学版). https://link.cnki.net/urlid/43.1427.R.20240111.1359.002
2.Chung BY, Um JY, Kim JC, et al.Pathophysiology and treatment of pruritus in elderly[J].Int J Mol Sci, 2020, 22(1):174.
3.Welz-Kubiak K, Reszke R, Szepietowski JC. Pruritus as a sign of systemic disease[J]. Clin Dermatol, 2019, 37(6): 644-656.
4.Alam M, Buddenkotte J, Ahmad F, et al.Neurokinin 1 receptor antagonists for pruritus[J]. Drugs, 2021, 81(6): 621-634.
5.其他文献(略)。
- 上一篇:肌钙蛋白升高不要只想到心梗,还有8种情况不可忽略
- 下一篇:无创通气,一文解读
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)