首页 > 医疗资讯/ 正文
冒烟型骨髓瘤
多发性骨髓瘤(MM)是一种克隆性骨髓浆细胞疾病,其前驱状态为意义未明单克隆丙种球蛋白血症(MGUS)和冒烟型骨髓瘤(SMM),其中SMM介于MGUS和MM之间,是一种无器官或组织损伤的浆细胞克隆(10%~59%),存在进展为有症状多发性骨髓瘤的风险。近日《British Journal of Haematology》发表英国血液学会良好实践文件,阐述了SMM的诊断和治疗,现整理主要内容供参考。

概述
SMM进展到SMM的风险,诊断后前5年为每年10%,随后5年为每年3%,后10年为每年1%。但由于SMM为无症状,多数患者从发病到诊断SMM的时间不固定,因此各研究中的诊断时间很"随机"。
MGUS、SMM和MM存在相似的遗传学改变,包括超二倍体(通常为奇数染色体3、5、7、9、11、15、19、21的三体)或免疫球蛋白位点易位(常见伴侣易位[translocation partner]:MMSET/FGFR3、CCND1、CCND3、MAF、MAFB1)。拷贝数改变(通常为del[13q],gain[1q], del[14q], del[1p], del[17p]和单核苷酸变异(SNV)通常随着进展为MM而增加,但在大多数病例中,在诊断为SMM时,骨髓瘤克隆的基因组构成几乎已完全获得。与SMM诊断的时间点随机相一致,利用突变特征来重建这些遗传异常的时序发展,一些导致生发中心后B细胞转化的起始易位可能发生于生命的前二十或三十年。
2014年IMWG更新了MM诊断标准,包括生物标志物骨髓克隆性浆细胞≥60%、受累/未受累轻链比值≥100且受累FLC> 100mg/L (FREELITE检测)或MRI显示>1处局灶性病变。导致该更新的证据显示,部分无症状患者可从治疗中获得总生存获益,且这些生物标志物与超高的进展风险相关(2年时进展风险为80%)。然而,一项纳入近期研究的荟萃分析显示,符合最新IMWG MM标准(基于BMPC和SFLC)的未治疗患者的进展风险显著较低(该研究见eClinicalMedicine. 2023;58:101910. https:// doi.org/10.1016/j. eclinm. 2023. 101910)。
SMM的流行病学尚不明确,在英国,MM的终生患病率估计为1%。来自瑞典骨髓瘤登记系统的数据表明,14.4%的患者诊断为SMM,发病率为0.4/100000/年。iStopMM研究对冰岛所有40岁以上的成年人进行了筛查,包括75422例患者,发现SMM的发病率要高得多。人群中SMM的总体患病率为0.53%,男性多见,中位年龄为70岁,但研究中几乎完全是白人。也有研究显示男性患病率(0.69%)高于女性(0.39%),且随年龄增长而升高,70岁以上为1.08%,80岁以上为1.59%。iStopMM研究中描述的更高的患病率可能与基于人群的筛查的性质有关,与先前流行病学研究相比,该研究能够更准确地识别SMM患者,尤其是低危SMM。
定义
SMM的诊断需要
1. 血清单克隆蛋白≥30 g/L或尿单克隆蛋白≥500 mg/24h和/或克隆性骨髓浆细胞10%~59%和
2.未发生根据IMWG“SLiM CRAB”标准定义的骨髓瘤定义事件(表1)。

筛查
建议
目前的证据不支持在临床试验之外筛查MGUS和SMM (1C)。
诊断检查
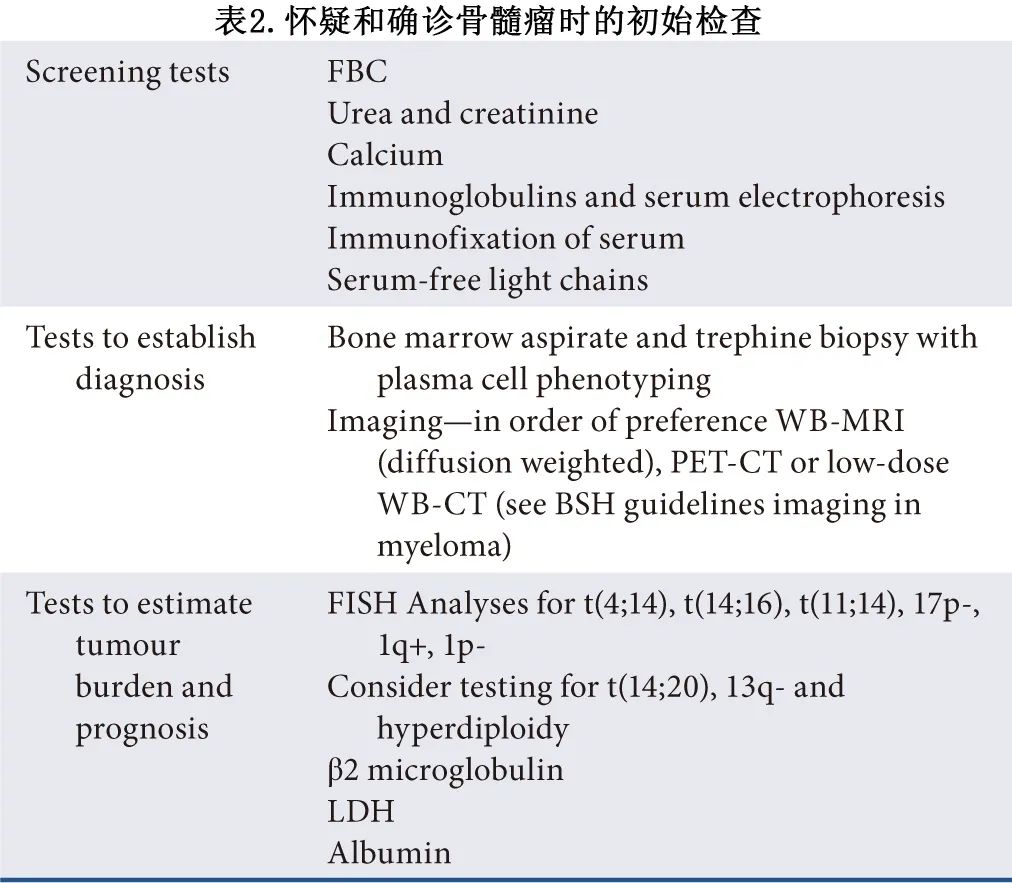
疑似骨髓瘤患者应使用表2中提到的检查进行检查,包括骨髓活检和横断面成像。
建议
应根据表2中列出的检查进行检查 (1C) 。
应使用无血清轻链分析检测单克隆轻链,而非尿M蛋白(1B) 。但在高单克隆FLC不确定病例、仅有轻链的SMM 或疑似AL型淀粉样变性的病例中,24小时尿蛋白和M蛋白分析可能有助于评估轻链负荷 (2C) 。
如果SFLC< 500mg/L且怀疑骨髓瘤是肾损害的诱因,应考虑肾活检(1C)。
应使用横断面成像且尽量为功能性(即扩散加权全身MRI[具有最大灵敏度]或PET-CT)。骨骼检查不应用于评估骨髓瘤中的骨病 (1A) 。
尿白蛋白-肌酐比值以及肌钙蛋白和 NT-proBNP 以及仔细评估淀粉样蛋白的特征可能是检测淀粉样蛋白的有用筛查工具 (2C) 。
所有新诊断骨髓瘤病例均应在 MDT 会议上讨论。(1C)
应在诊断时使用 CD138 选取细胞的间期 FISH 对所有患者进行细胞遗传学分析(1A)。
应探测样本的t(4;14)(p16;q32)、t(14;16)(q32;q23)、t(11;14)(q13;q32)、17p-、1q+、-1p,并考虑检测t(14;20)(q32;q11)、13q-和超二倍体 (1B) 。
在>20%的细胞中发现的细胞遗传学异常应视为显著,而较小克隆的意义尚不明确 (2C) 。
预后/预后因素/危险分层
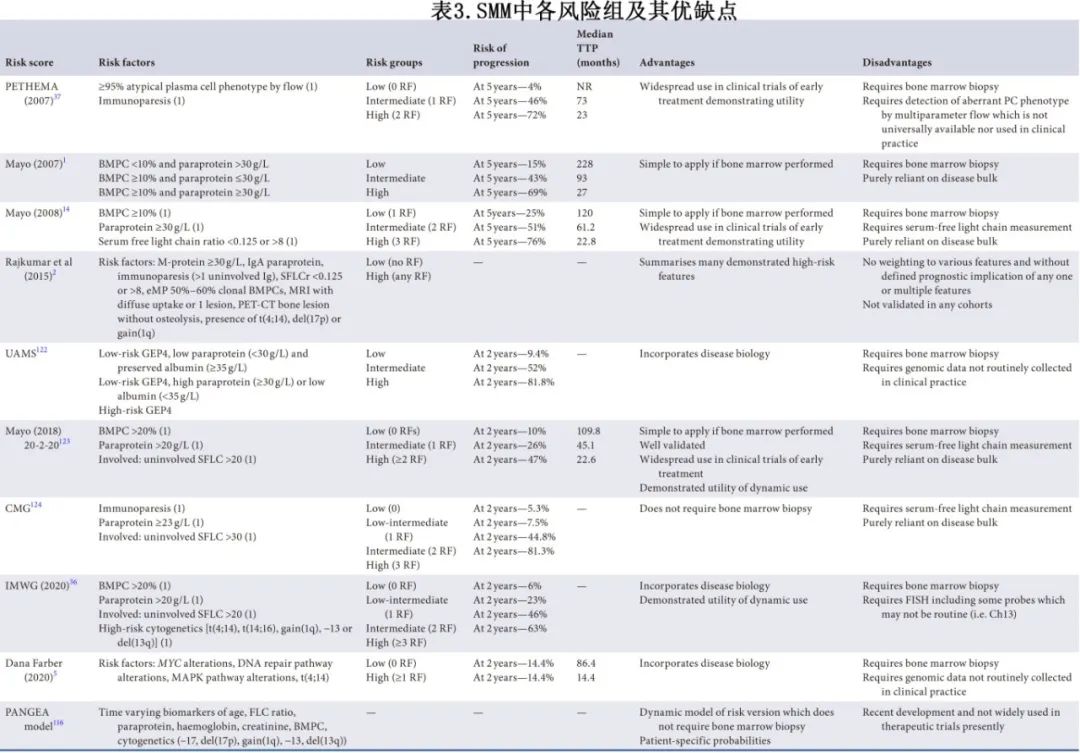
目前已有多个经过验证的风险评分和大量预后生物标志物,它们的潜在优缺点见表3。
建议
新诊断SMM患者应在诊断时使用经过验证的已发表模型进行风险分层,作为进一步管理的指南。考虑使用梅奥20-2-20(2018)和更新的IMWG模型20-2-20,后者纳入FISH(2020)。疾病进展的患者考虑进行再分期 (1C) 。
支持治疗
建议
SMM患者在诊断时和随访期间需要明确的信息和心理支持(1C) 。
SMM患者不常规推荐VTE预防 (1C) 。
所有患者应在诊断时接种疫苗,保存疫苗日志并避免接种活疫苗(IV级,英国 DoH 指南) (1B) 。
肺炎球菌感染疫苗接种包括:沛儿13价肺炎球菌多糖结合疫苗,2个月后接种23价Pneumovax。对于有复发性或严重感染史的患者,应在6周后检查功能性抗体,以加速获得IVIg(英国 DoH 指南)。应每5年重复接种一次 (1B) 。
50岁以上患者应接种2剂重组带状疱疹疫苗,间隔8周至6个月(UK DoH指南) (1C) 。
复发性或严重感染患者应考虑预防性使用抗生素 (2C) 。
对于 IgG 水平较低(<4g/L,IgG副蛋白残留)、接受6个月预防性抗生素治疗但仍复发或发生严重感染以及疫苗接种无应答的患者,应提供免疫球蛋白替代治疗(NHSE指南) (2C) 。
建议患者和家庭成员每年接种流感疫苗 (1C)。
建议所有患者和家庭成员接种COVID-19疫苗(英国DoH指南) (1C) 。
目前不建议常规检测 COVID-19 抗体(1C) 。
对于发生 COVID-19 感染且症状发作5天内的患者,建议进行抗 COVID 治疗 (1C) 。
对于不需要抗骨髓瘤治疗的 SMM 患者,缺乏数据支持使用双膦酸盐(1C) 。
SMM患者的监测
建议
没有足够的证据支持在临床试验之外治疗SMM。
对于低危患者(梅奥[20-2-20]/IMWG), 第1年内每3个月监测,如果稳定则延长至每6-12月;对于中危患者,第1~2年每3个月监测,如果病情稳定则考虑延长至每4~6个月;对于高危患者,考虑参加临床试验,否则在5年内每3个月监测。
对于高危患者,应考虑每年重复影像学检查,尤其是在疾病标志物发生变化的情况下(1C)。目前缺乏数据支持所有无症状或无明确进展证据的患者常规复查影像学,但应采用低阈值进行重复影像学检查。基线时发现不确定或孤立局灶性病变的患者应进行间隔影像学检查(3~6个月) (1C)。
在诊断的前5年内,生化标志物发生变化或梅奥20-2-20/IMWG风险组增加的患者,按照高危监测 (1C)。
考虑在初级或二级保健机构使用医疗保健专业人员(护士、初级保健、实验室工作人员)进行长期监测的分层临床模型。所有模式都需要有充足的资源,并由训练有素、有积极性的工作人员进行监督,才能取得成功(1A)。
监测SMM可以在出现CRAB特征之前发现具有SLiM特征的进展,减少不可逆的终末器官损伤的频率。根据进展风险提出分层监测模型,但风险模型仍在不断完善中。
低、中危SMM
对于低、中危SMM患者,建议监测,包括症状评估和下列实验室检查:全血细胞计数、肾功能、骨剖面、血清免疫球蛋白、血清蛋白电泳、无血清轻链检测。根据EMN和IMWG指南,确诊后6~12个月内应每2~3个月进行1次实验室监测。如果结果稳定,患者可在后续一年内每4~6个月接受1次随访,之后每6~12个月接受1次随访。NICE指南建议在确诊后的5年内每3个月进行1次实验室监测,但指南一致认为实验室监测的频率应根据疾病的长期稳定性来决定。
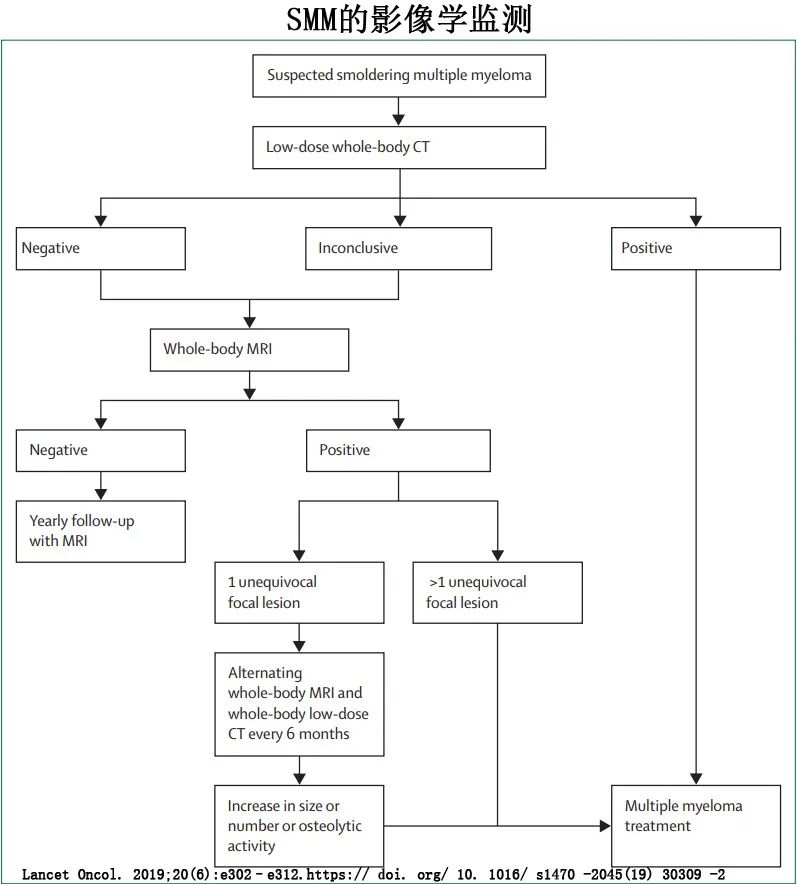
IMWG指南还建议,在最初5年内,在临床怀疑/疼痛或观察到M蛋白进行性增加时每年进行CT和/或MRI检查,并报告了SMM患者详细的影像学算法(下图)。骨病是SMM进展时常见的CRAB特征,也可能无症状。MRI弥散加权成像是检测SMM病灶和弥漫性浸润最敏感的影像学检查方法,MRI上单个病灶的存在可能对骨病进展有预测价值。然而,IMWG的系列影像学建议并非基于随机试验的证据,也没有对卫生经济影响进行评估或对效能进行评估。
高危SMM
目前尚无针对高危SMM最佳管理的循证指南,且不同试验对高危SMM的定义不同,因此较有挑战性。应使用目前的20-2-20风险模型或IMWG风险模型,并考虑参与针对高危患者的试验。
早期干预可降低进展率,但对死亡率的影响存在较大争议,且所有干预均存在治疗相关毒性。一项纳入8个随机对照试验的META分析显示,早期治疗显著可降低SMM的进展风险(RR=0.53,p=0.01),尤其是在高危患者中(RR=0.51,p=0.0001),且高危SMM患者的治疗也显著降低死亡率(RR=0.53,p=0.04)。
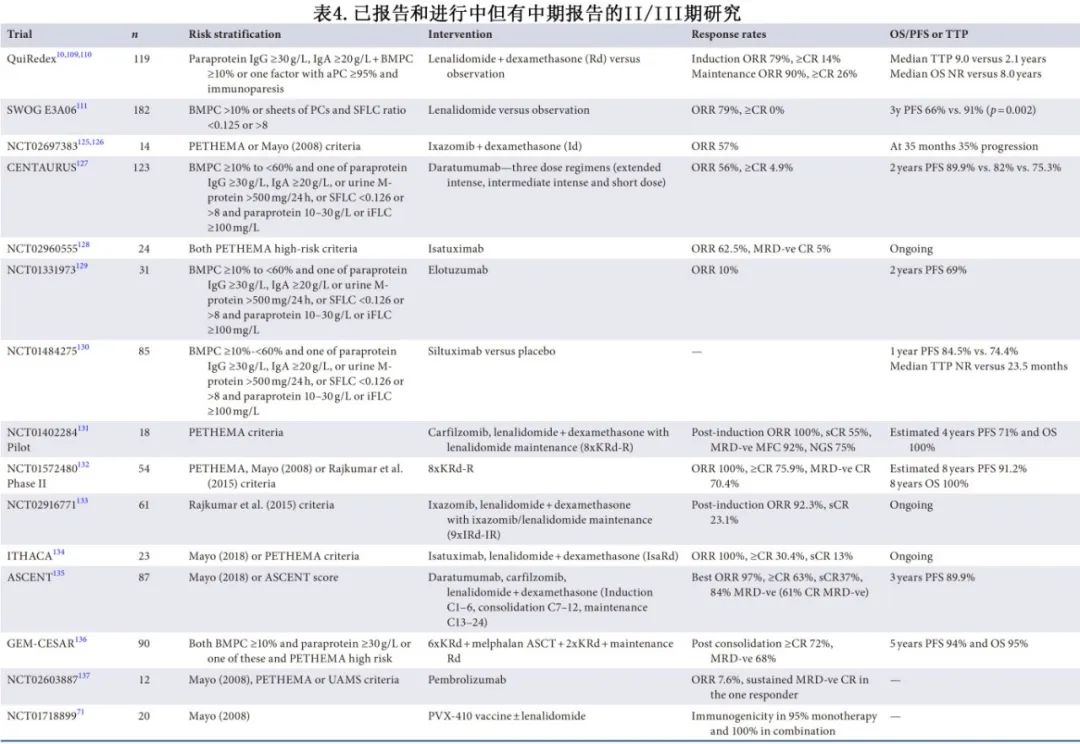
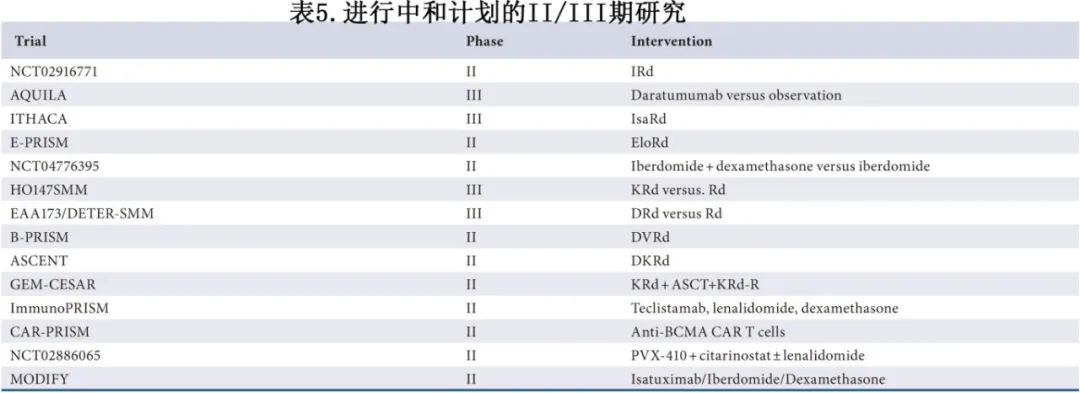
表4和表5总结了各种正在进行的高危SMM研究,但本文仅讨论使用来那度胺的两个关键初始研究。
QuiRedex是研究SMM早期治疗的第一项研究,将125例高危SMM患者随机分组接受来那度胺和地塞米松(Rd)治疗或观察,结果显示治疗组至疾病进展时间较长,3年生存率较高;中位随访时间为12.5年(范围10.4 ~ 13.6年),观察组和治疗组的中位TTP分别为2.1年和9.5年(HR=0.28),中位OS分别为8.5年和未达到(HR=0.57),进展后的OS无差异。尽管在本试验中观察到总生存期获益,但来那度胺尚未成为常规标准治疗。值得注意的是,该研究在IMWG更新诊断标准之前的2007—2010年纳入患者,且使用不充分的影像学检查(研究方案仅要求进行骨骼检查,敏感性较差)来排除骨病;因此纳入了目前定义为骨髓瘤的患者,并且考虑到早期结局不良,该研究还提出了关于观察组治疗的问题。
为克服上述局限性,SWOG E3A06研究在2013—2017年将182例中或高危SMM患者随机分组接受持续来那度胺单药治疗或观察。中位随访35个月时,3年PFS分别为91%和66% (p=0.002),治疗组的HR为0.46。该研究允许患者在疾病正式进展前交叉接受来那度胺治疗,可能会限制OS的评估。重要的是,观察组的进展率较低(2年的进展率为24%),可能与2013年的试验修正案有关,该修正案允许患者在5年内确诊,而不仅仅是在诊断时确诊,从而提示这一人群并非真正的高危人群。此外,41%接受来那度胺治疗的患者发生了3-4级不良事件,20%的患者因不良反应停止治疗,但两组中患者报告的健康相关生活质量指标从开始治疗至2年期间均无显著下降。
演变中的疾病
基因组学研究表明,部分SMM(和MGUS)患者具有与MM相似的遗传景观(静态演化模型);随着肿瘤负荷的增加,这些患者固有地发展出MM的临床表现。因此,至少对于这类患者,血清生物标志物的变化(如副蛋白和游离轻链比值升高和血红蛋白降低)可用于动态评估风险。
一项回顾性研究对诊断后5年内每年应用20-2-20模型和IMWG模型的效用进行评估,表明与仅使用基线评分相比,重新分层可使不同风险类别之间的至进展时间具有更大的一致性。从评估开始的2年和5年进展风险随着时间的推移保持相似,但与处于相同组或至较低危组的患者相比,两次评估之间风险组的增加对进展具有预后意义。但这些风险评分在诊断后5年的适用性还未研究过。
对于血清学标志物不断变化的患者,应采用低阈值进行重复影像学检查或增加随访频率。多个研究组评估了动态标志物的价值,包括疾病进展(副蛋白升高、Hb下降)的不同定义,并结合副蛋白或骨髓浆细胞比例的初始阈值(表6)。

PANGEA模型在对6441例前驱期患者(1510例SMM)的回顾性分析中,对随时间变化的生物标志物使用多变量Cox回归,根据骨髓、血液标志物和细胞遗传学的可用性开发了三个模型。该模型可作为个体患者风险的在线计算器(www.pangeamodels.org/)。
参考文献
Hughes D, Yong K, Ramasamy K, Stern S, Boyle E, Ashcroft J, et al.Diagnosis and management of smouldering myeloma: A British Society for Haematology Good Practice Paper. Br J Haematol. 2024;00:1–14. https://doi.org/10.1111/bjh.19333
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)