首页 > 医疗资讯/ 正文
近日,FDA批准奥希替尼联合含铂化疗用于携带EGFR 19del或21号外显子L858R突变的局部晚期或转移性非小细胞肺癌的治疗。这一批准得到了 3 期FLAURA 2研究(NCT04035486)的结果支持。在该研究中,奥希替尼联合化疗(n = 279)与奥希替尼单药(n = 278)相比,显著提高了该人群的无进展生存期,分别为 25.5 个月(95%CI,24.7-不可评估)和 16.7 个月(95% CI,14.1-21.3)(HR,0.62;95%CI,0.49-0.79;双侧P<.0001)。

获批依据
此次获批是基于FLAURA2临床研究(NCT04035486)的积极数据。研究共纳入了 557 名EGFR 19del或21号外显子L858R突变且既往未接受过系统性治疗的晚期非小细胞肺癌患者。患者按照 1:1 的比例随机分配接受奥希替尼联合含铂化疗或奥希替尼单药治疗。
研究设计
FLAURA2是一项全球III期、开放标签、随机研究,旨在评估奥希替尼联合铂-培美曲塞化疗与奥希替尼单药作为携带EGFR突变的晚期NSCLC一线治疗的疗效和安全性。
入组患者应符合如下标准:年龄≥18岁(日本≥20岁),诊断为病理证实的非鳞状局部晚期/转移性NSCLC,携带ex19del/L858R突变;WHO PS 0-1,未接受过晚期NSCLC的系统性/EGFR-TKI治疗;稳定的中枢神经系统转移患者可以入组,且至少 2 周不需要类固醇治疗。

▲研究设计
符合条件的患者(N=557)以 1:1 的比例随机分配至奥希替尼联合化疗组(奥希替尼80 mg每日一次+培美曲塞500 mg/㎡+顺铂75 mg/㎡或卡铂AUC5,共 4 个周期,随后每 3 周接受奥希替尼80 mg QD+培美曲塞500 mg/㎡维持治疗)或奥希替尼单药治疗组(80 mg QD),直至出现疾病进展/达到停药标准;患者按种族(中国人/非中国亚洲人/非亚洲人)、EGFR突变检测方法(本地实验室/中心实验室)和WHO PS(0/1)分层。主要终点是研究者根据RECIST v1.1标准评估的PFS。其它关键次要终点包括:OS、PFS2、客观缓解率(ORR)、健康相关生活质量(QoL)、CNS PFS和基于CTCAE v5版标准评估的安全性。
基线特征
患者基线特征非常平衡。在奥希替尼/铂类/培美曲塞组中,中位年龄为 61 岁(范围26-83岁),大多数患者为女性(62%)、华裔亚裔(25%)或非华裔亚裔(39%),体能状态为 1(62%)、从不吸烟(67%)、罹患腺癌(99%)、存在转移(95%)、出现胸外转移(53%)以及 42% 的患者患有CNS转移。EGFR突变为外显子 19 缺失(61%)和 L858R(38%)。基线中位肿瘤大小为 57 mm(范围,10-284)。
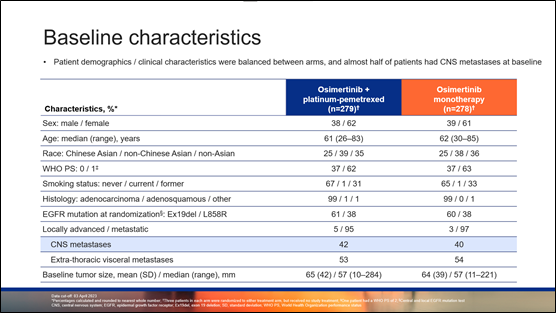
▲基线特征
相比FLAURA研究,入组FLAURA2研究患者的疾病负荷更重,纳入了更多基线合并脑转移、骨转移、肝转移和胸外转移的患者,且中位肿瘤直径也更长。
研究结果
截止 2023 年 4 月 3 日,在联合化疗组和单药组中,研究者评估的中位PFS分别为 25.5 个月和 16.7 个月(中位随访时间分别为 19.5 个月和 16.5 个月),HR为 0.62,95%CI:0.49-0.79,P<0.0001,有显著的统计学差异,达到了主要研究终点。在联合化疗组和单药组中,BICR评估的中位PFS为 29.4 个月和 19.9 个月(中位随访时间分别为 19.4 个月和 14.6 个月),HR为0.62,95% CI:0.48-0.80,P=0.0002,也存在显著的统计学差异。
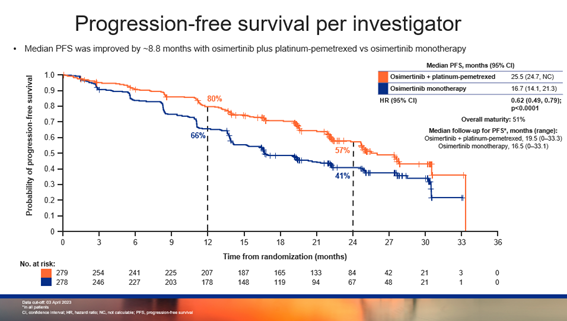
▲研究者评估的PFS
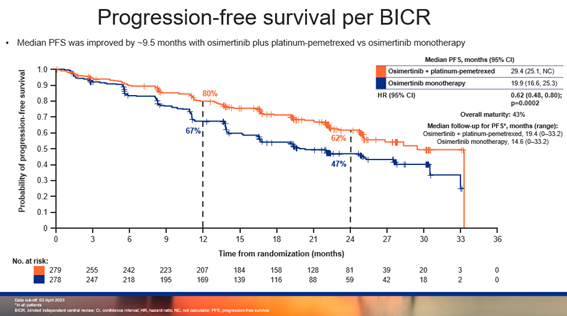
▲BICR评估的PFS
亚组分析结果显示,在所有亚组中具有一致的PFS获益。在基因突变亚组中,EGFR ex19del患者在两组中的中位PFS分别为 27.9 个月和 19.4 个月(HR = 0.60),L858R患者在两组中的中位PFS分别为 24.7 个月和 13.9 个月(HR = 0.63),联合治疗提高了L858R患者约 11 个月的中位PFS,获益程度接近ex19del亚组。
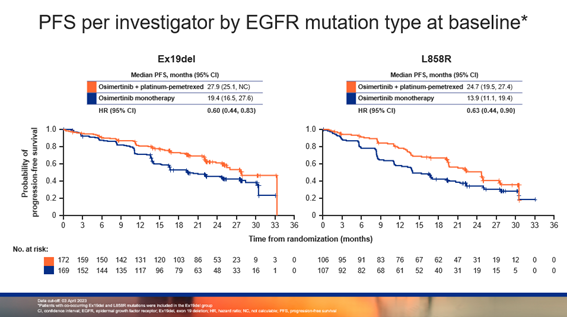
▲基于EGFR突变亚型的PFS
在脑转移亚组中,奥希替尼联合化疗相较于奥希替尼单药可提升脑转移患者的中位PFS约 11 个月(24.9 个月 vs 13.8 个月),降低疾病进展或死亡风险 53%(HR = 0.47);在基线无脑转移亚组中,奥希替尼联合化疗组的中位PFS更长,达到 27.6 个月(vs 21.0个月;HR = 0.75)。此外,在亚裔中国人群中,PFS获益趋势明显,降低疾病进展或死亡风险 51%(HR = 0.49)。
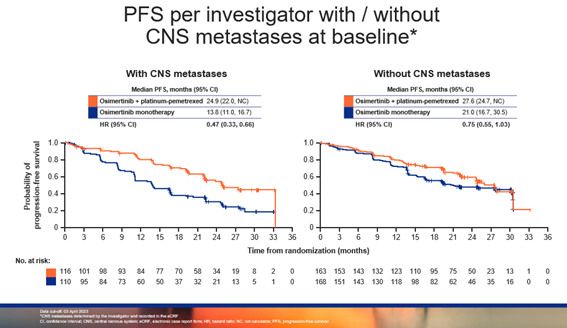
▲研究者根据基线有无脑转移评估的PFS
在疗效应答方面,奥希替尼联合化疗组的客观缓解率(ORR)高达 83%,相比当前标准治疗(SoC)奥希替尼单药(76%)有明显提升,中位缓解持续时间(DoR)也表现优异。在数据截止时,PFS2和OS尚未成熟,奥希替尼联合化疗组与奥希替尼单药组的PFS2分别为 30.6 个月 vs 27.8 个月(HR=0.70;P=0.0132),中位OS暂未达到(HR=0.90;P=0.5238)。
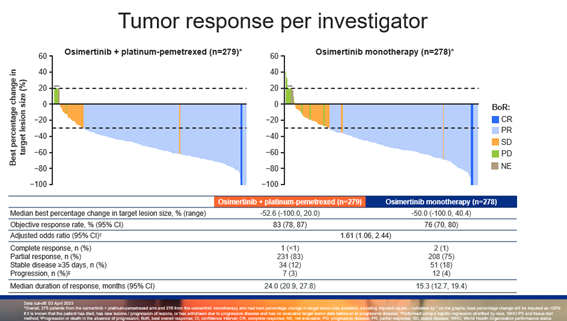
▲研究者评估的肿瘤缓解情况
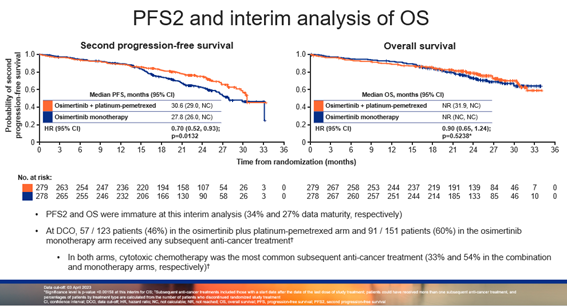
▲中期分析时的PFS2和OS数据(均未成熟)
安全性
安全性数据显示,在奥希替尼联合化疗组中,奥希替尼的中位治疗时间为 22.3 个月,培美曲塞的中位治疗周期为12个周期,76% 的患者完成了 4 个周期的含铂双药化疗;在奥希替尼单药组中,奥希替尼的中位治疗时间为 19.3 个月。奥希替尼联合化疗的安全性与既往一致,未发现新的安全信号。奥希替尼联合化疗和奥希替尼单药的治疗相关不良事件(TRAE)发生率分别为 97% vs 88%,绝大多数TRAE为轻/中度,奥希替尼联合化疗的安全性良好可管理。
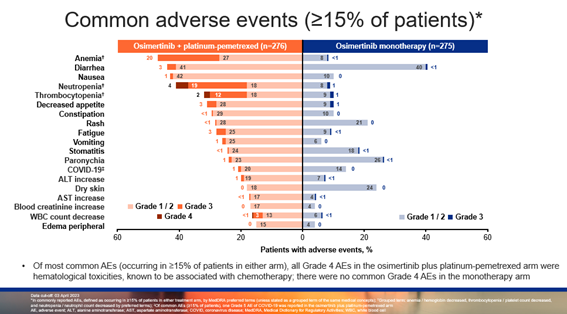
▲常见不良事件(>15%的患者中发生)
背 景
EGFR突变非小细胞肺癌
肺癌是全球第二大常见癌症,也是导致癌症相关死亡的主要原因。非小细胞肺癌(NSCLC)约占所有肺癌的 85%,55% 的患者在确诊时发生远端转移。其中,EGFR突变在全球 14%-38% NSCLC患者中检出。
靶向治疗的引入改善了EGFR突变的局部晚期或转移性NSCLC患者的治疗前景。与化疗相比,EGFR-TKI靶向治疗具有更高的缓解率、PFS和潜在的OS优势,并且第三代EGFR-TKI与上一代抑制剂相比展现出更优异的疗效。
奥希替尼
奥希替尼是第三代、不可逆、中枢神经系统活性的EGFR-TKI,可有效并选择性地抑制EGFR-TKI致敏性突变和EGFR T790M耐药突变。基于FLAURA III期研究中奥希替尼与对照EGFR-TKIs相比所显示的更好的PFS和OS,奥希替尼目前已是EGFR突变(EGFRm)晚期NSCLC的首选一线治疗药物。然而,肿瘤的异质性和产生机制复杂的治疗耐药性可导致疾病进展。来自第一代EGFR-TKI与化疗联合的研究数据显示两者具有协同效应;因此,奥希替尼联合化疗可能比奥希替尼单药治疗产生更好的PFS获益。
参考文献:
[1]FDA官网.
[2]FDA Approves Osimertinib Plus Chemo for EGFR-Mutated NSCLC.https://www.onclive.com/view/fda-approves-osimertinib-plus-chemo-for-egfr-mutated-nsclc
[3]2023WCLC会议摘要.

猜你喜欢
- 哪些原因引起男性不育
- 红豆薏米和冬瓜荷叶能一起泡着喝吗 红豆薏米茶泡出去挺黄的正常吗
- 冬天怎么吃羊肉汤 冬天喝羊肉汤的好处有哪些
- 每周工作超55小时心脏病致死风险增加
- 吃什么养胃?这四个食物能很好改善肠胃不适症状
- JCC:内科和外科联合治疗不能改善克罗恩病患者肛周瘘的预后
- 气血两虚吃啥调养
- Eur Urol:转移性去势抵抗性前列腺癌和BRCA1/2基因改变的患者结果报告:随机3期 MAGNITUDE 试验的最终分析
- 邱远教授、田泽民博士:被标准检测遗漏的5.2%肠癌患者:错失靶向治疗良机?
- 医学界沸腾!中医经典名方成“卵巢守护神”!华中科技大学发布:补肾活血方通过调节PI3K/Akt信号改善卵巢早衰
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)