首页 > 医疗资讯/ 正文
脂质长期过度消耗,然后在心脏过度积聚,导致心肌病。脂质性心肌病的病因涉及质子泵液泡型H+-ATP酶(v-ATP酶)的关键作用,它使核内体酸化,脂质转运蛋白CD36储存在酸化的核内体中。在脂质过度暴露过程中,ATP酶感知到脂质流入心肌细胞的增加,然后该酶分解,导致内体脱酸,并将储存的CD36从内体向肌膜排出。
2024年2月7日,汕头大学卢玺峰、重庆医科大学李希及荷兰马斯特里赫特大学Joost J.F.P. Luiken等团队合作在Circulation Research在线发表题为“Glycolysis-Mediated Activation of v-ATPase by Nicotinamide Mononucleotide Ameliorates LipidInduced Cardiomyopathy by Repressing the CD36-TLR4 Axis”的研究论文,该研究表明烟酰胺单核苷酸糖酵解介导的v-ATP酶激活通过抑制CD36-TLR4轴改善脂质诱导的心肌病。

在分子水平上,一连串的事件开始于通过心脏脂肪酸转运体CD36增加的细胞脂肪酸内流。在健康的心脏中,CD36部分存在于细胞表面,部分储存在细胞内的内体中这些核内体含有质子泵复合物,称为v-ATP酶,它负责这些细胞器腔的酸化。v-ATP酶由两个亚络合物组成:一个V0亚络合物,形成一个跨越膜的质子通道;一个V1亚络合物,包含一个转子驱动的质子泵腔内酸化对各种内体功能(如CD36的亚细胞储存)都很重要。最近发现,v-ATP酶可以感知进入心肌细胞的脂肪酸过剩,V1从V0分解并漂移到细胞质中。随后,核内体失去酸度,启动囊泡出芽过程,将CD36转运到肌膜,导致心肌脂质逐渐摄取和积累。
CD36不仅是脂肪酸跨肌膜运输的促进剂,还具有多种其他功能,包括通过与TLR4 (toll样受体4)的相互作用启动脂肪酸信号传导。TLR4本身识别脂肪酸作为配体,但需要CD36作为辅助受体激活脂质供应过剩。TLR4激活通过包括接头蛋白MyD88和应激相关激酶(如p38-MAPK和P42/44ERK)在内的途径诱导细胞炎症,导致关键炎症转录因子NFκB的刺激和细胞因子的产生。这种CD36介导的炎症信号传导作用可能会加重CD36介导的心肌脂质积累对脂质超载心脏功能的不良影响。
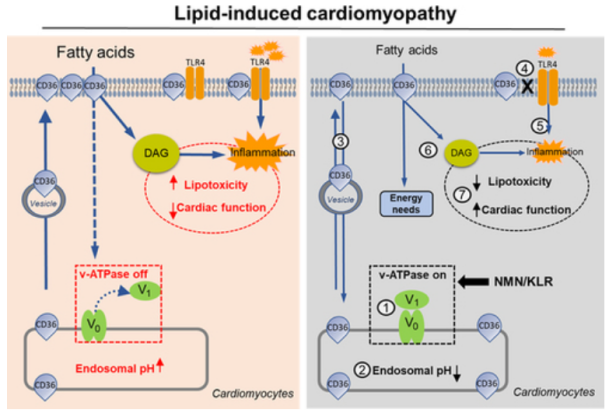
机理模式图(图源自Circulation Research )
将CD36保持在细胞内可以证明是一种有效的策略,可以抵消高脂肪饮食(HFD)对啮齿动物心脏的不适应心脏形态和功能变化的发生。通过诱导v-ATPase重组的营养制剂操作,可以防止CD36转位到肌膜。其中一种操作包括3种AAs(赖氨酸/亮氨酸/精氨酸,以下简称赖氨酸/亮氨酸/精氨酸[KLR])的混合物,它激活mTORC1及其与V1的结合,之后该亚复合物与V0重新组装,从而在过量脂质供应期间重新激活内体酸化。将这种混合物应用于高棕榈酸盐(HP)条件下培养的心肌细胞,可在体外逆转收缩功能障碍。然而,目前还没有详细研究KLR在体内是否以及在多大程度上可以对抗脂质诱导的心脏收缩功能障碍。
该研究检测了喂食诱发心肌病的HFD的啮齿动物心脏是否受益于补充NMN,以及其有益作用是否涉及v-ATP酶重组、CD36内化、降低细胞内脂质、降低TLR4介导的炎症,并最终导致心脏泵血功能的恢复。研究表明,NMN通过维持v-ATP酶活性,成功地保护了心肌脂质过载时的内体酸化,并随后阻止了CD36介导的脂质积累、CD36-TLR4对炎症、纤维化、心功能障碍和全身胰岛素抵抗的相互作用。脂质组学显示,高脂饮食显著增加了富含C18:1的二酰基甘油脂类,随后被赖氨酸/亮氨酸/精氨酸/NMN治疗逆转/保存。对mTORC1/v-ATPase抑制剂和心脏特异性v-ATPase-KO小鼠的研究进一步证实了v-ATPase在这些有益作用中的关键作用。综上,v-ATP酶重组有望成为对抗脂质性心肌病的一种有吸引力的策略。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.123.322910
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)