首页 > 医疗资讯/ 正文
他汀类药物是动脉粥样硬化疾病一级和二级预防的基础,然而他汀类药物使用引发的不良反应也引起了广泛关注,除了严重或常见的并发症如横纹肌溶解、肝功能损伤外,新发糖尿病(DM)或糖耐量异常也越来越多地报道为他汀类药物治疗后的副作用。尽管人们越来越关注与他汀类药物治疗相关的葡萄糖稳态失调,但其机制仍不清楚。
“肠道生态失调”的概念及其与心脏代谢疾病的关联已经引起了越来越多的关注。已有研究分析了二甲双胍对肠道菌群及其代谢物的重塑作用,发现Glycoursodeoxycholic acid (GUDCA)和肠道FXR是治疗肥胖相关代谢性疾病的新靶点1,2,3。最近的一项研究进一步提出微生物宿主同工酶广泛存在于肠道中。具体来说,细菌二肽基肽酶-4 (mDPP4)同工酶已被确定能够降解宿主活性胰高血糖素样肽-1 (GLP-1),从而导致肠道屏障完整性的破坏和小鼠葡萄糖代谢受损4。
最近一项基于人群的横断面肠道菌群分析显示,他汀类药物治疗与肠道菌群改变有关,主要差异在于拟杆菌科、瘤胃球菌科和普雷沃氏菌等的分布6。与此同时,先前的研究已经证明,个体对他汀类药物的反应,无论是在靶LDL降低方面,还是在脱靶胰岛素抵抗方面,都可以用微生物组的基线变化来解释7。然而,肠道微生物组是否对他汀类药物治疗后的葡萄糖稳态产生影响仍有待阐明。
2024年2月6日,西安交通大学第一附属医院袁祖贻/吴岳教授团队与香港中文大学于君教授团队合作在Cell Metabolism杂志发表题为“Statins aggravate insulin resistance through reduced blood glucagon-like peptide-1 levels in a microbiota-dependent manner”的研究论文,揭示了他汀类药物和熊去氧胆酸(UDCA)联合治疗可以改善葡萄糖稳态,而不影响其降脂作用。

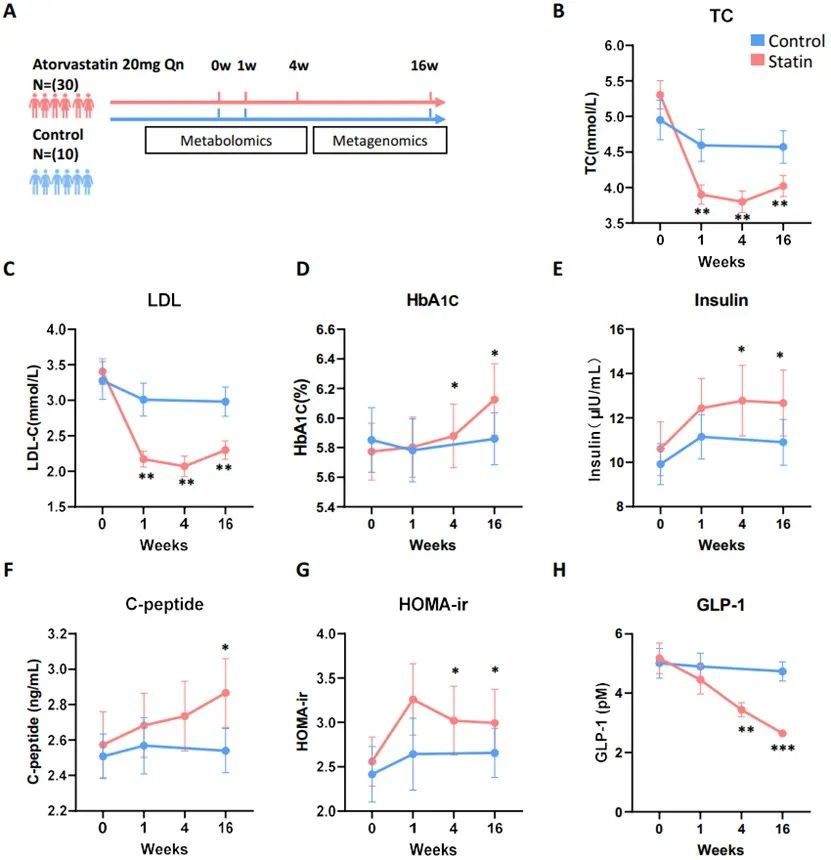
研究者首先发现,服用阿托伐他汀的患者在他汀开始治疗1周后,总胆固醇(TC)和低密度脂蛋白(LDL)水平显著降低,HbA1c、胰岛素、c肽和HOMA-ir在第4周显著升高,并延长至16周,阿托伐他汀起始治疗4周后,活性GLP-1浓度显著下降,这提示阿托伐他汀可抑制GLP-1分泌,影响葡萄糖稳态。
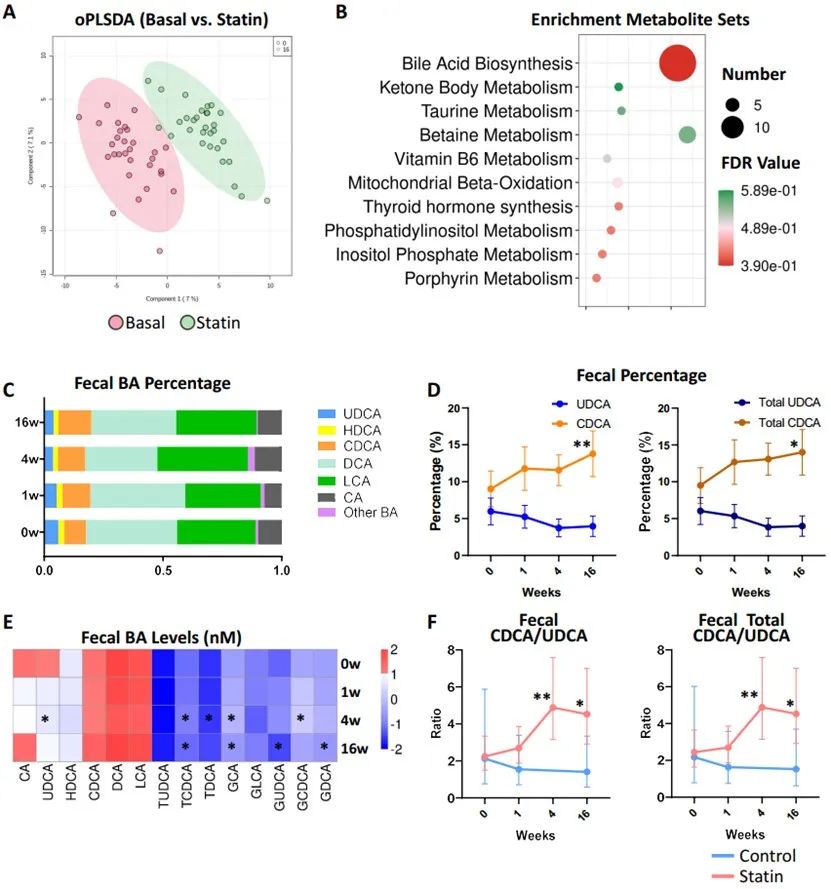
由于阿托伐他汀可能通过下调循环GLP-1水平而影响葡萄糖稳态,研究者随后应用非靶向代谢组学分析来确定循环代谢组学改变,并寻找与葡萄糖稳态失调相关的潜在关键代谢物。正交偏最小二乘判别分析(oPLS-DA)显示,他汀类药物治疗后,代谢物在胆汁酸生物合成途径中大量富集。通过比较服用他汀类药物患者在不同随访点的粪便和血清胆汁酸谱发现:鹅去氧胆酸(CDCA)百分比逐渐增加而UDCA百分比下降;他汀类药物治疗4周后,CDCA与UDCA之比显著升高。由于粪便中CDCA向UDCA的转化主要通过肠道HSDH酶进行,这暗示着他汀类药物可能通过调节肠道菌群影响胆汁酸代谢。
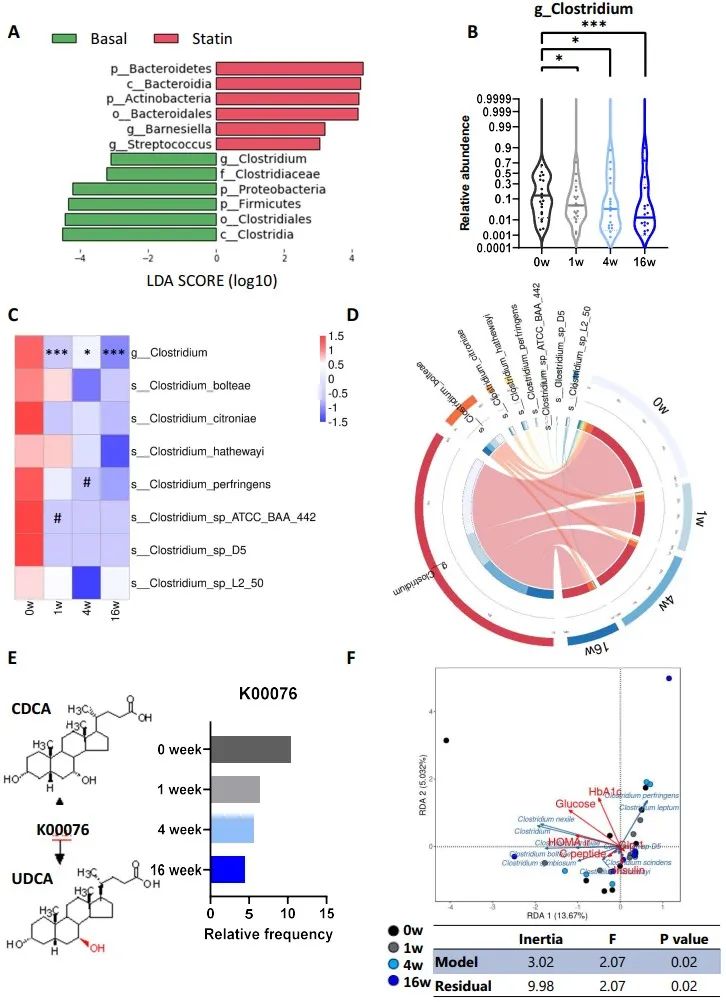
为了进一步揭示他汀类药物如何控制肠道微生物群从而影响胆汁酸代谢,研究人员对粪便样本进行了宏基因组学分析,线性判别分析(LDA)显示,服用阿托伐他汀后,厚壁菌门、梭菌纲和梭菌属的丰度下降,梭状芽孢杆菌属多个种的丰度也明显下降。此外,通过采用非靶向方法在临床队列中鉴定微生物组中的其他分类群,来自梭菌属的物种与胆汁酸代谢的相关性也强于其他细菌属,同时,属于梭状芽孢杆菌属的多个物种被观察到介导羟基类固醇脱氢酶生成的途径。值得注意的是,KEGG数据库中的7-α-羟基类固醇脱氢酶(K00076)是CDCA向UDCA转化关键酶的同源基因,呈时间依赖性下降。相关分析进一步发现,梭状芽孢杆菌种类与血糖指标呈负相关。这些结果表明,他汀类药物可导致富梭菌减少,表达CDCA到UDCA转化的关键酶HSDH减少。梭状芽孢杆菌与血糖指标之间的关系进一步表明,富梭状芽孢杆菌菌群的减少可能会影响胆汁酸的合成和排泄,并损害葡萄糖代谢。
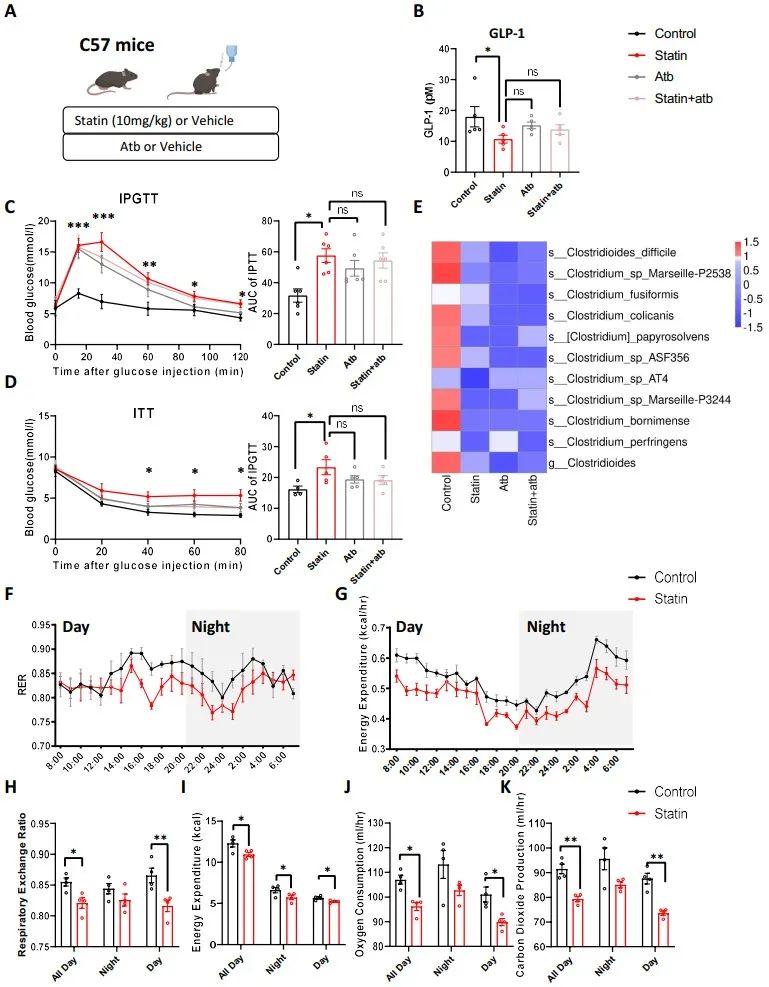
为了进一步评估阿托伐他汀对葡萄糖代谢和能量消耗的影响,研究者给C57BL/6小鼠喂了12周的阿托伐他汀。为了确定阿托伐他汀是否通过调节肠道微生物群来影响葡萄糖水平,研究人员同时使用抗生素造模无菌小鼠进行了干预。与对照组相比,阿托伐他汀治疗显著降低血清GLP-1水平,并引起小鼠葡萄糖耐量异常和胰岛素抵抗。与对照小鼠相比,阿托伐他汀治疗后,梭状芽孢杆菌的数量减少了,小鼠的7-α-羟基类固醇脱氢酶(K00076)也呈时间依赖性下降。然后,研究者进行了粪便微生物群移植实验,将服用他汀类药物6个月以上患者的肠道微生物群移植到C57BL/6小鼠身上。与对照组相比,粪菌移植小鼠中观察到糖耐量受损表型,此外还发现小鼠粪便胆汁酸中UDCA降低,CDCA增加。
在服用阿托伐他汀的患者中,梭状芽孢杆菌(C. sp.)被发现受到抑制。为了进一步阐明C. sp.是否参与了他汀类药物诱导的糖耐量异常,研究者将C. sp.移植到无菌小鼠体内。C. sp.定植后,阿托伐他汀诱导的血清GLP-1降低、糖耐量异常和胰岛素抵抗均显著恢复。7-α-羟基类固醇脱氢酶在C. sp.定植后也显著增加。粪便中胆汁酸的α-mca和UDCA均显著升高,与血清代谢组学结果一致。此外,代谢笼测定进一步提示,C. sp的定植增加了RER和EE,表明C. sp可以促进葡萄糖利用,改善葡萄糖耐受不良。研究者在体外0-500 μM浓度下用阿托伐他汀共培养C. sp,发现阿托伐他汀剂量依赖性抑制C. sp的生长。这些结果表明,C. sp可以治疗他汀类药物相关的糖耐量异常。
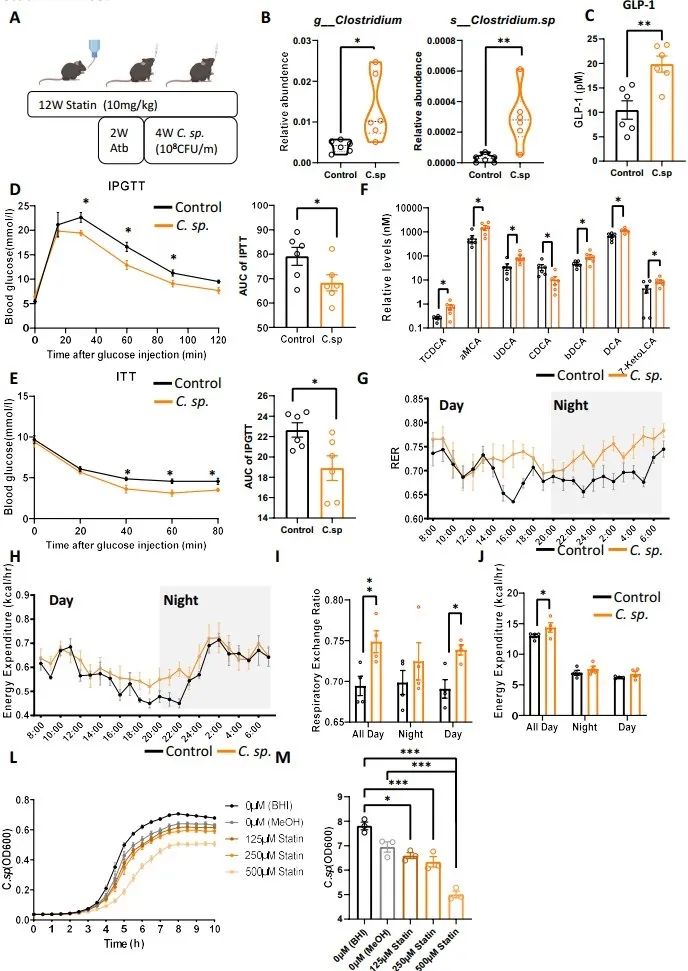
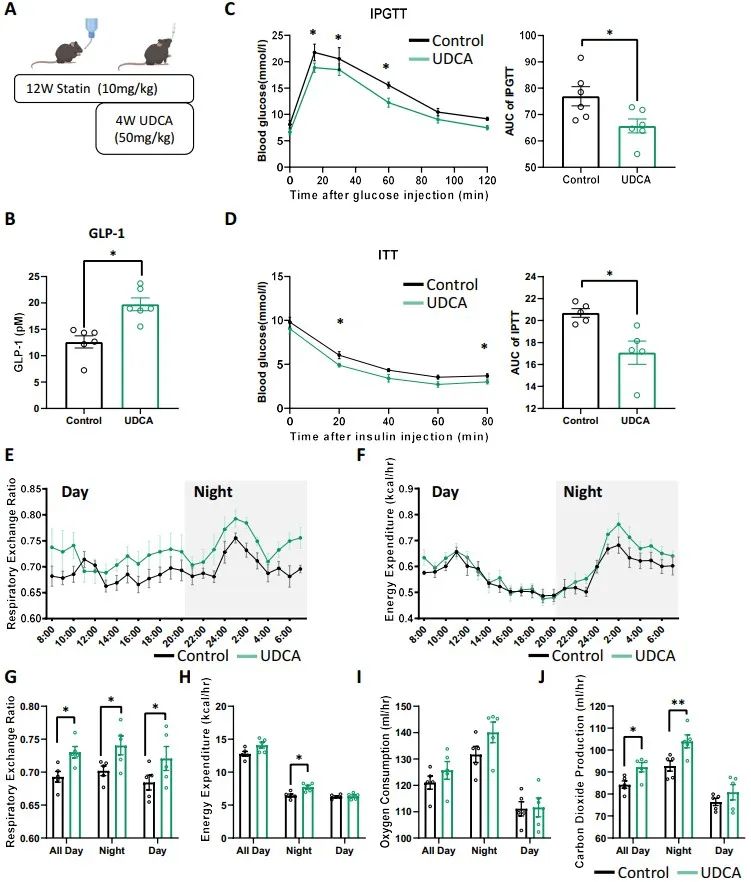
由于人类胆汁酸代谢组学分析显示,在使用阿托伐他汀后,UDCA逐渐降低,研究者进一步研究了UDCA是否对他汀诱导的糖耐量异常有治疗作用。为此,对接受阿托伐他汀治疗12周的小鼠,连续4周给予50mg/kg UDCA。口服UDCA可增加GLP-1分泌,而且可显著恢复葡萄糖耐受不良和胰岛素抵抗,代谢笼结果进一步提示,UDCA对小鼠糖代谢有改善作用。补充UDCA后,肝脏胆汁酸合成基因以及肝脏和回肠FXR靶基因的表达也发生了变化。这些结果表明,UDCA增加GLP-1的分泌,改善胰岛素抵抗。
由于UDCA在临床上常用于肝胆疾病,研究者随后进一步探索UDCA是否可以改善他汀治疗患者的糖耐量异常。为此,招募了5名使用他汀类药物超过6个月且HbA1c较基线显著升高的患者。随访2个月后,HbA1c水平及血清胰岛素、C肽、GLP-1水平均显著降低,且肝功较前有所改善。这表明UDCA可以恢复受损的葡萄糖水平,而不会影响他汀的降脂作用。以上结果提示,他汀类药物和UDCA可以作为一种复合制剂用于治疗血脂异常,同时降低糖耐量异常和肝功能受损的副反应发生。
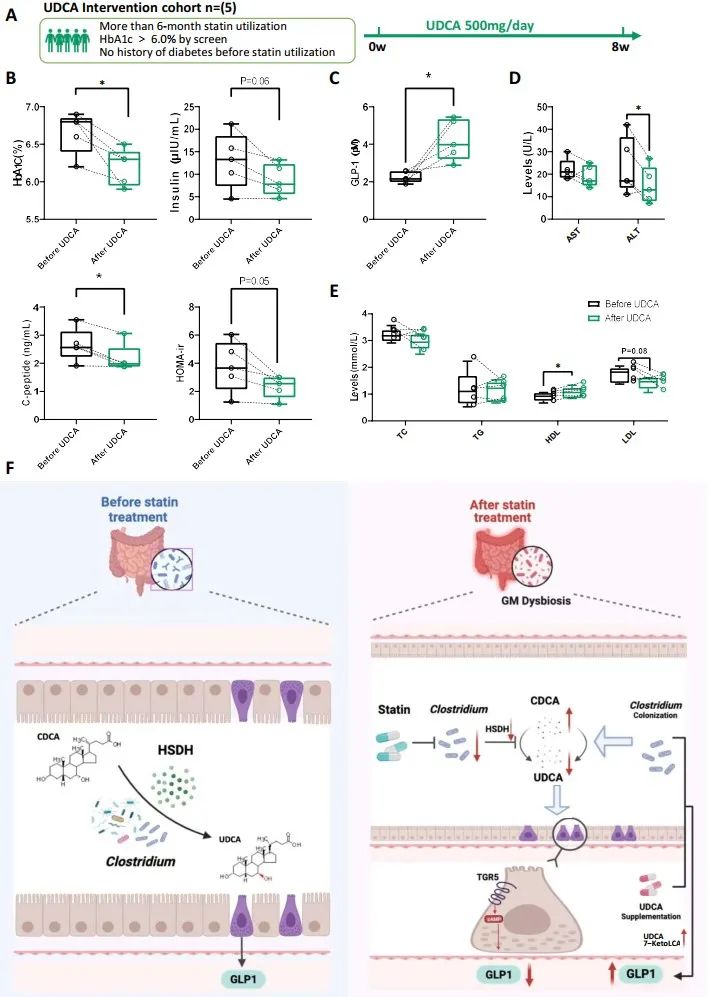
在目前的研究中,研究者调查了使用他汀类药物的患者的肠道微生物群和胆汁酸谱。通过综合元基因组学和代谢组学分析,发现使用阿托伐他汀后梭状芽孢杆菌丰度降低,这抑制了粪便中CDCA向UDCA的转化。UDCA的降低下调了循环GLP-1,导致葡萄糖稳态。动物实验和临床验证进一步表明,他汀联合UDCA是改善他汀类药物相关葡萄糖代谢异常的潜在治疗策略。本研究的主要贡献在于,在他汀类药物治疗中,UDCA的辅助治疗可能是未来一种潜在的新型降脂方法。
西安交通大学第一附属医院心内科折剑青副教授、博士生古丽尼尕尔为论文的共同第一作者。西安交通大学第一附属医院心内科袁祖贻/吴岳教授和香港中文大学于君教授为论文的通讯作者。该研究获得了国家重点研发计划(2021YFA1301200, 2019YFA0802300)、国家自然科学基金(92049203, 81941005, 82170464)、陕西省重点研发计划的资助和支持。该研究还得到了麦特绘谱生物科技(上海)有限公司对代谢组学分析的协助。
参考文献:
[1] Sun, L., Xie, C., Wang, G., Wu, Y., Wu, Q., Wang, X., Liu, J., Deng, Y., Xia, J., Chen, B., et al. (2018). Gut microbiota and intestinal FXR mediate the clinical benefits of metformin. Nat Med 24, 1919-1929.
[2] Forslund, K., Hildebrand, F., Nielsen, T., Falony, G., Le Chatelier, E., Sunagawa, S., Prifti, E., Vieira-Silva, S., Gudmundsdottir, V., Pedersen, H.K., et al. (2015). Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota. Nature 528, 262-266.
[3] Wu, H., Esteve, E., Tremaroli, V., Khan, M.T., Caesar, R., Manneras-Holm, L., Stahlman, M., Olsson, L.M., Serino, M., Planas-Felix, M., et al. (2017). Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug. Nat Med 23, 850-858.
[4] Wang, K., Zhang, Z., Hang, J., Liu, J., Guo, F., Ding, Y., Li, M., Nie, Q., Lin, J., Zhuo, Y., et al. (2023). Microbial-host-isozyme analyses reveal microbial DPP4 as a potential antidiabetic target. Science 381, eadd5787.
[5] Vieira-Silva, S., Falony, G., Belda, E., Nielsen, T., Aron-Wisnewsky, J., Chakaroun, R., Forslund, S.K., Assmann, K., Valles-Colomer, M., Nguyen, T.T.D., et al. (2020). Statin therapy is associated with lower prevalence of gut microbiota dysbiosis. Nature 581,310-315.
[6] Wilmanski, T., Kornilov, S.A., Diener, C., Conomos, M.P., Lovejoy, J.C., Sebastiani, P., Orwoll, E.S., Hood, L., Price, N.D., Rappaport, N., et al. (2022). Heterogeneity in statin responses explained by variation in the human gut microbiome. Med 3, 388-405.
原文链接:
https://doi.org/10.1016/j.cmet.2023.12.027
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)