首页 > 医疗资讯/ 正文
高危DLBCL
大 B 细胞淋巴瘤中弥漫性大 B 细胞淋巴瘤非特指型(DLBLC NOS) 是最常见的亚型,过去20年中R-CHOP 一直是 DLBCL 治疗的主要手段,长期总生存期 (OS) 约为60%。但早期复发或难治性疾病患者的预后不佳,复发患者接受大剂量化疗 (HDT) 和自体干细胞移植 (ASCT) 的中位 OS 仅有6.3个月,3年无事件生存率 (EFS) 仅为20%。
随着引入CAR-T等免疫疗法,复发性和难治性 DLBCL 患者的生存期仅在近期有所改善,但大多数患者仍会死于该疾病。很多学者根据临床、病理学/分子因素、治疗早期反应等因素来确定疾病复发高危患者,并优化其一线治疗,尽管这些探索尚待转化为新的治疗范例,但仍可用于设计新的临床试验,并可能影响新的治疗策略。
《Blood》近日发表一篇综述,主要关注定义高危 DLBCL NOS 患者和其他侵袭性 LBCL 亚型(如高级别 B 细胞淋巴瘤)的特征及改善其结局的方法。

高危DLBCL的特征
临床预后因素
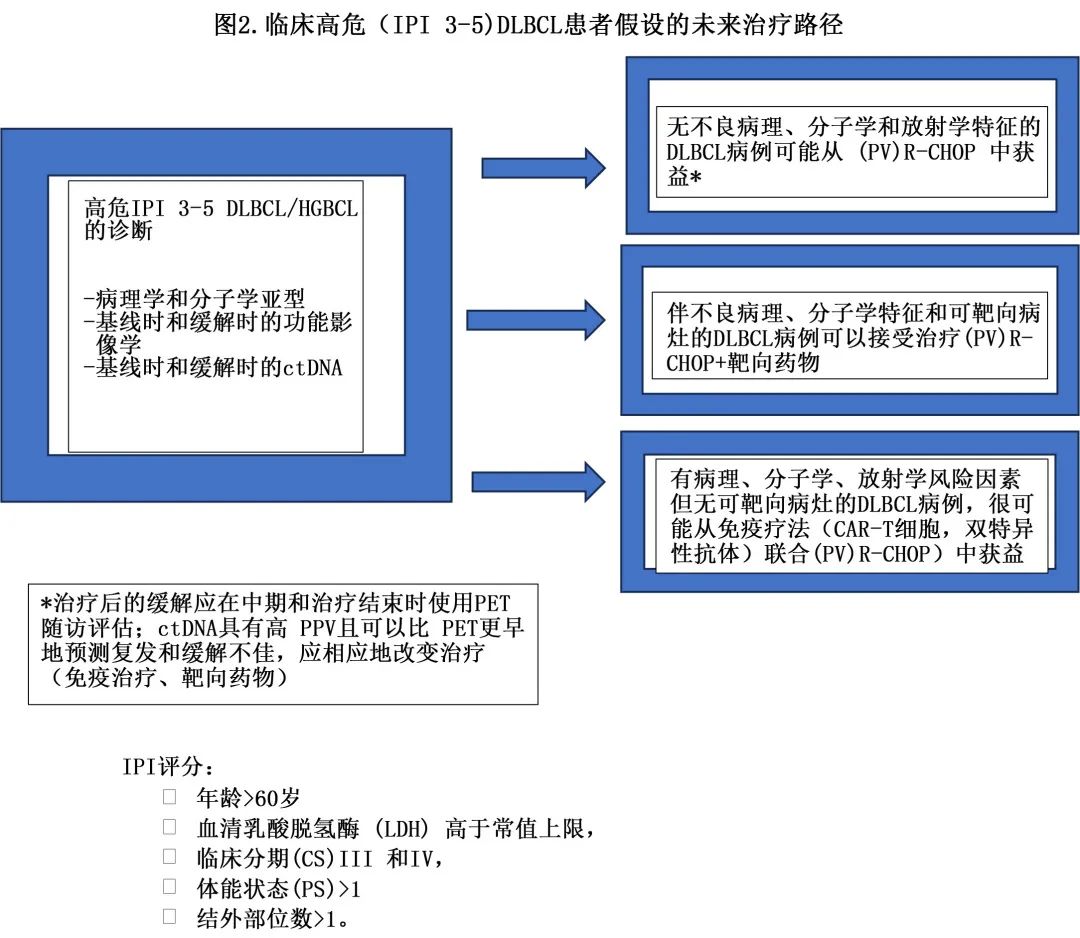
注:图中的PV为维泊妥珠单抗
基于临床因素的国际预后指数 (IPI) 是在利妥昔单抗给药前时代开发的,并保留了其预后价值。IPI将评分分配给临床因素 (图2) 并将患者分为4个风险组(0-1=低危,2=低-中危,3=高-中危,4-5=高危),OS介于26%-73%。修订版 IPI(R-IPI) 设计用于接受 R-CHOP 治疗的患者,使用相同的临床变量,将患者分为3个风险组,OS为55%-94%。最后,开发了具有相同临床预测因素的NCCN-IPI,但根据年龄范围、LDH值和特定结外部位区分评分。NCCN-IPI将评分为0-8分的患者分为4组,5年 OS 为33%-96%,能够描述风险最高和最低的亚组。有研究在2124例患者中比较了所有3个预后指数;NCCN-IPI对 OS 的区分能力最佳,最高 (NCNN-IPI =6-8) 和最低风险组 (0-1) 之间的差异最大,OS为49%-92%;但NCCN-IPI未能识别预后最差且 OS 显著低于50%的患者(表1)。
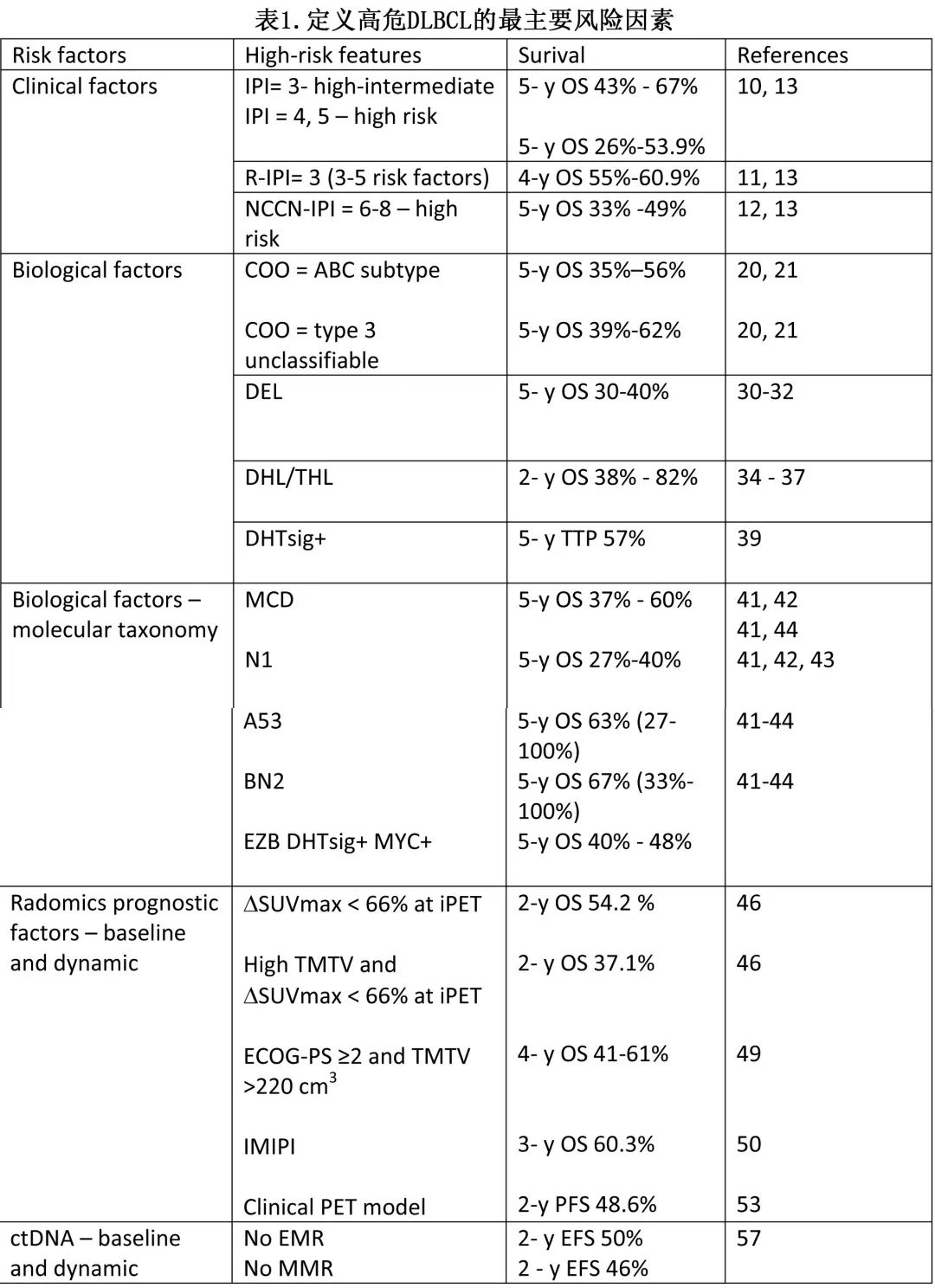
还有其他临床变量与不良结局相关,包括从诊断到治疗的时间短(对应于侵袭性病程)、维生素 D3 水平低、高钙血症和淋巴细胞与单核细胞比值,但这些指标尚未常规纳入预后指数。
在临床实践中,使用现成因素的临床预后指数通常用于识别有复发风险的患者,而在临床试验中,IPI也经常被用作入组标准的一部分,将研究干预重点放在高危患者上(最有可能从强化方案中获益),因为随机化期间都使用分层因素以确保研究组的平衡。最近,由于认识到从诊断到治疗的时间较长可能影响部分研究的结果并导致对照组超预期表现,有的研究排除了从诊断到治疗的时间较长的患者。但与临床因素预后意义相反(如下文所述),尝试使用这些因素指导治疗在很大程度上是不成功的。
病理和分子预后因素
DLCBL NOS是LBCL 的特定亚型,具有显著的临床和生物学异质性。Alizadeh等人使用基因表达谱 (GEP) 鉴别了与起源细胞 (COO) 相关的2种不同亚型的DLBCL,生发中心 B 细胞样亚型 (GCB) 和活化 B 细胞样亚型 (ABC) 在淋巴细胞发育中的基因型相似。进一步的工作发现了基因表达与 GCB 或 ABC 无关的3型DLBCL亚型,ABC亚型患者的结局劣于3型和GCB,5年 OS 分别为35–56%、39%-62%和60-78%。值得注意的是,在 GOYA 等前瞻性研究中,GCB和 ABC 之间的差异并不显著,5年无进展生存期 (PFS) 分别为66%和56%。这表明各 COO 亚型内的生物学和分子异质性,因此可能低估这些研究中具有不良预后特征的患者。同样,前瞻性入组 ABC 或non-GCB DLBCL 亚型患者的 ROBUST 和 PHOENIX 研究显示,对照组中这些患者的结局优于历史对照,从而指出难以将回顾性研究的结果外推至前瞻性试验设计中,尤其是鉴于巨大的生物学和分子异质性。
GEP 在常规实践中不可用,因此设计了使用免疫组织化学 (IHC) 算法的替代方法,其中 Hans 算法使用最广泛。值得注意的是,IHC模型和 GEP 方法之间存在相当高的不一致率 (15-50%),导致 IHC分类错误的发生率很高。设计用于福尔马林固定石蜡包埋 (FFPE) 活检的新技术是比 IHC 更好的 GEP 替代方法,包括 Lymph2Cx 检测,两种方法之间的一致性>95%,但其在临床实践中的应用仍然有限。
BCL2 和MYC(双表达淋巴瘤-DEL)的双表达是一个不良预后因素,5年 OS 在30%-40%之间。DEL更常发生在 ABC 亚型中,但无论 COO 3如何,都会形成不利的独立预后因素。
根据 WHO 新分类,伴 MYC 和 BCL2 重排的 DLBCL 病例属于一种新亚型,称为 DLBCL/高级别 B 细胞淋巴瘤 (HGBL)-MYC/BCL2,即双打击淋巴瘤 (DHL),如果存在额外的 BCL6 重排,则称为三打击淋巴瘤 (THL)。根据 WHO 分类,MYC和 BCL6 重排淋巴瘤未单独分类,但根据形态学特征评估,属于 DLBCL 或 HGBL 亚型。国际共识分类(ICC)则区分了两种亚型:HGBL伴 MYC/BCL6 的和HGBL伴MYC/BCL2 重排。DLBCL/HGBL-MYC/BCL2(DHL) 具有 GC 基因表达谱,占新诊断 DLBCL 的5-10%,长期 OS 低于50%,预后不良。回顾性数据表明,R-DaEPOCH、R-CODOX-M/IVAC强化治疗可改善预后,但一项随机研究中未证实这一点。临床试验数据显示,DHL患者的2年 OS 率为63%。DHL亚组生存期的不一致结果与过去进行 FISH 检测的偏倚有关。Ennishi等通过 GEP描述了一组具有双打击特征 (DHITsig) 和不良预后的高危患者,他们属于 GCB 亚型,DHITsig+的5年至进展时间 (TTP) 为57%,而DHITsig-为81%(不受MYC/BCL2 状态影响)。值得注意的是,一些 MYC 和 BCL2 重排为隐秘性,无法通过 FISH 检测。虽然DHL罕见,但基于临床和分子数据的缺乏以及关于其预后的矛盾结果,MYC/BCL2重排患者属于高危组,R-CHOP后的生存率较低,随机研究中没有关于最佳治疗选择的证据,鼓励参与临床试验。此外MYC、BCL2和 BCL6 的 FISH 检测是所有 DLBCL 患者的推荐诊断程序。
近年来随着对 DLBCL 的分子学异常的深入认知,也为未来 DLBCL 的新分类学铺平了道路。区分新的基因亚型有助于了解 COO 组内和组外的生物学和临床异质性,并确定具有特定基因异常和不同结局的患者。Schmitz等和Chapuy等的两篇关键研究为使用全外显子测序 (WES)、DNA拷贝数分析和靶向扩增子重测序的新分子学分类奠定了基础。DLBCL的全面基因组分析能够捕获突变、体细胞拷贝数改变和结构变异。Chapuy等人发现了98个突变,这些突变在检测的队列中富集,每个 DLBCL 样本的遗传驱动改变的中位数为17。使用聚类(clustering)方法共确定了5种亚型:C1-C5 聚类,具有不同遗传特征但生存概率也不同,且与 COO有相关性。国家癌症研究所 (NCI) 小组应用 WES确定了4个不同的遗传亚组,后来通过研究对此进行了改进,因此区分了7种基因亚型;这是一种特殊的算法,可见于https://llmpp.nih.gov/lymphgen/index.php。来自英国 (UK) 的研究组概括了类似的遗传分类(图1)。
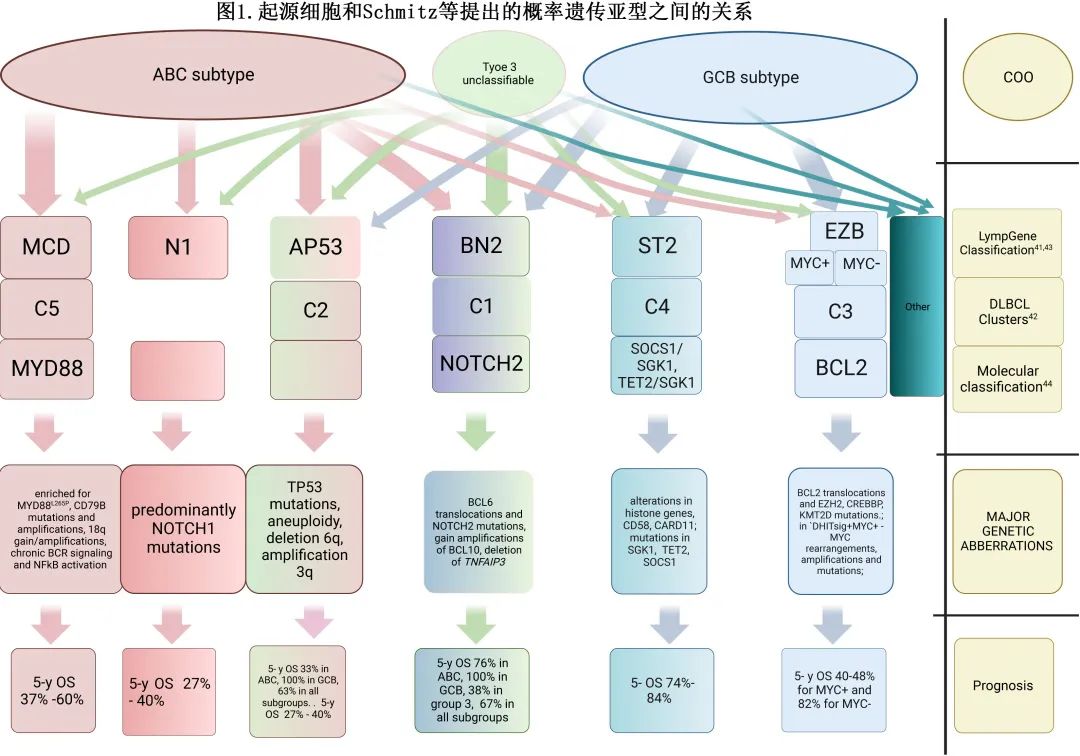
分子分类学为 COO 分类增加了细致度,有助于辨别 COO 内预后不同的患者亚组。
功能影像学-基线和动态放射学预后因素
用于分期评价疾病负荷和治疗反应的 18F-氟脱氧葡萄糖 (FDG) 正电子发射断层扫描 (PET) 的放射组学特征具有预后意义,因此PET-CT认为是 DLBCL 诊断(包括缓解评估)的金标准。许多分析表明,较高的总代谢性肿瘤体积 (TMTV) 与较差的 PFS 和/或 OS 相关。TMTV的预后价值是一个独立的预后因素,且与生物学和/或临床风险因素结合时可进一步提高。Mikhael等提出了一种新的预后模型——国际代谢预后指数 (IMPI),由MTV、年龄和 CS 组成,可定义比 IPI 更好的高危组 (https://petralymphoma.org/impi)。LYSA开发了另一个 OS 预后模型。HOVON工作组设计了“临床PET”模型,结合了临床和放射学特征:年龄、PS MTV、SUVpeak和Dmaxbulk(两个最大质量之间的最大距离);已证实临床 PET 对 PFS 和 TTP 的阳性预测值 (PPV) 高于IPI。
中期PET(iPET) 对 PFS 或 EFS 具有较高的阴性预测值 (NPV)。最近发表的研究完善了 iPET 作为预后因素和一线治疗调整工具的缓解标准和最佳时机。iPET-2和iPET-4(分别在第2 和第4 个治疗周期后)可以同等定义预后不同的患者亚组,其中 iPET-4 和 Deauville 评分 (DS) 5 的 PFS 风险比 (HR) 最高。在 iPET-2 和 iPET-4 评估的最大标准摄取值相对于基线的差异 (△SUVmax),比在 iPET-2 和 iPET-4 通过 DS4/5 DS 5 测量的具有更好的预测价值,PFS的PPV 最高。因此,iPET-2时DS 5 的患者创建了疾病复发风险最高的亚组,并可在极早期确定为治疗调整的潜在候选者。同样,iPET-4 时DS4和/或△SUVmax <70%是另一组治疗失败风险的患者。
基线和治疗期间循环肿瘤DNA作为预后因素
测量循环肿瘤 DNA(ctDNA) 已成为评估肿瘤体积和预测治疗效果的另一种工具。自 Scherer和 Kurtz的开创性论文发表以来,已经发表了许多显示治疗前 ctDNA 和生存期之间相关性的报告。217例 DLBCL 患者的 ctDNA 分析显示,高水平的 ctDNA 预示着不利的 EFS 和OS;在多变量分析 (MVA) 中,ctDNA仍是 EFS 的独立预后因素。ctDNA的动力学与治疗反应密切相关:快速(在第2周期开始时)和深度下降 (第3周期ctDNA 水平下降>2.5log)称为早期和主要分子学缓解(EMR和MMR),可表征达到完全缓解 (CR) 的患者;它们是 EFS 和 OS 的预后因素,无 EMR 和 MMR 的患者生存期显著更差。前瞻性 III 期 POLARIX 研究和北欧 II 期研究的数据也证实了 ctDNA 动力学作为预后因素的重要性。
Kurtz 等提出了一个综合临床、分子和放射组学特征的复杂预后模型(连续个体化风险指数-CIRI),包括治疗前和动态因素:IPI、分子COO、iPET、基线ctDNA、EMR和MMR (https://ciri.stanford.edu)。
上述几个研究清楚地表明,ctDNA可以成为定义治疗前后高危 DLBCL 患者的有力工具。正在进行和未来的研究将回答,ctDNA 测量是否能够根据 ctDNA 基因分型的结果通过治疗调整来改善患者预后。
高危DLBCL的治疗
治疗优化-强化一线化疗
如上所述,随着对肿瘤生物学知识的不断增加和诊断方法的细化,临床医生有许多工具来识别高危 DLBCL 患者。用于改善患者结局的策略包括使用新的靶向药物富集一线免疫化疗、在疾病早期应用免疫治疗和根据动态风险因素调整治疗。
早期尝试用奥妥珠单抗替代利妥昔单抗或强化化疗改善患者的结局,但并不成功。MegaCHOEP研究纳入年龄调整 (aa)IPI 2-3 的<60岁患者,并随机分配至 R-CHOP 组和 剂量递增方案伴ASCT组;R-MegaCHOEP组患者没有任何生存获益,但发生更多3/4级血液学毒性和感染。在一项随机 III 期 Alliance/CALGB50303 研究中也未观察到 OS 和 PFS 的差异,该试验在一线治疗中研究了剂量强化 R-DaEPOCH 与 R-CHOP-21 的疗效;值得注意的是,事后分析发现 IPI 3-5 患者中观察到 PFS 改善,但 OS 未改善。研究的阴性结果可归因于标准组获得了非常有利的2年OS(85.7%),且高危患者代表不足。一线 R-CHOP 联合 HD/ASCT 巩固治疗策略也未能使 OS 获益。意大利研究小组显示,在 aaIPI 为2-3的高危患者队列中,HDT/ASCT巩固治疗导致2年 FFS 增加,但 OS 没有差异。同样,在 Stiff 等一项随机研究中,在整个 IPI 3-5 患者队列中,HDT/ASCT未产生生存优势;但在亚组分析中,高危组观察到 ASCT 巩固治疗的生存获益。
一线治疗中的治疗优化-R-CHOP+X概念
为了克服高危患者的不良预后,设计了比较R-CHOP +X与标准 R-CHOP 的新诊断 DLBCL 患者随机研究,其中“X”是主要根据其在复发情况下的活性以及生物学作用机制选择的新药。尽管新药治疗复发性疾病的结果令人鼓舞,但这些试验的结果基本上令人失望。利用R-CHOP +X概念达到主要终点的唯一一项研究是 POLARIX 研究,在 IPI 2-5 的 DLBCL 患者中研究抗体药物偶联物维泊妥珠单抗(polatuzumab vedotin,PV) 联合R-CHP;与 R-CHOP 相比,PV-R-CHP显示疾病进展、复发或死亡的相对风险降低27%,毒性特征相似;2年 PFS 的差异为6.5%,对 OS 无影响,这可能反映出目前复发和难治性疾病的更好治疗选择。尽管该研究的效力不足以检测亚组之间的差异,但探索性分析显示 ABC 亚型和 IPI 3-5 的>60岁患者有 PFS 获益。
更深入地了解分子 DLBCL 亚型,有助于确定哪些患者可获益于在研究中从添加新的 X 药物,但对整个患者人群的影响为阴性。REMoDL-B研究检查了硼替佐米与 R-CHOP 的联合治疗,并使用 GEP 根据 COO 对患者进行分层。在中位随访30个月主要分析中,试验组的生存期没有任何改善,但5年后的额外分析显示特定分子亚型的 OS 和 PFS 存在差异:尽管在整组中未观察到联合治疗的获益,但在 ABC 和MHG(分子高级别)亚组中加用硼替佐米显著改善了患者的结局。PHOENIX是根据R-CHOP +X方案设计的另一项研究,在 DLBCL non-GCB 亚型(根据 IHC 标准确定COO)和 IPI 1 患者中比较R-CHOP+伊布替尼与R-CHOP。该研究未达到其主要终点,即 EFS 差异,但在一项非计划分析中,R-CHOP+伊布替尼改善了<60岁亚组的 EFS 和OS;在>60岁的患者中,伊布替尼的毒性增加,影响了化疗的及时给药。回顾性基因组分析确定了与标准组相比获得显著生存期的2个分子亚组,即 MCD 和 N1 亚组,两者均具有不良预后。<60岁 MCD 和 N1 患者接受R-CHOP+伊布替尼治疗后的3年 EFS 和 OS 率均为100%,而 R-CHOP 组分别为42.9%和 50%(EFS) 及69.6%和50%(OS)。这些非预期的阳性结果证实了 BTK 抑制剂在non-GCB 患者亚组中的活性,促使研究人员设计采用阿可替尼的新研究,两项III 期研究正在评价在 R-CHOP +阿可替尼对比 R-CHOP 治疗新诊断DLBCL:REMoDL-A和ESCALADE 。E1412是一项在 DLBCL 患者中比较来那度胺+R-CHOP与 R-CHOP 的大型、随机、II期研究,证实来那度胺与 PSF 和 OS 改善相关;然而使用该方案的 III 期研究集中于ABC DLBCL(ROBUST研究),未显示加用来那度胺的获益,可能是由于后一项研究中高危患者的代表性不足:ROBUST研究从诊断到治疗的中位时间为31天,而 E1412 为20天,表明在真实世界执行分子学分析存在困难,以及对能够等待分子分析结果的低危患者选择的影响。
III 期随机、双盲 FRONT-MIND 研究建立在 E1412 的基础上,在 IPI 3-5 高危 DLBCL 患者中比较tafasitamab+来那度胺+R-CHOP 组与 R-CHOP 组。根据活检日期,符合 FRONT-MIND 研究条件的患者自诊断后不到28天,以避免低危患者进入研究。这项试验已经完成了招募和结果,其他一线研究将有望为高危患者结局的改善开辟道路。
治疗优化-使用动态风险因素的缓解适应性(response-adapted)一线治疗
如前所述,高危人群的定义不仅限于诊断时确定的因素,还采集了治疗期间和治疗后评估的特征,如无代谢反应:iPET2 时 DS5或iPET4时 DS4和/或△SUVmax <70%、治疗结束时MRD+、第二周期治疗后缺乏 EMR 和MMR。多个研究组之前已经研究了强化化疗的缓解适应性治疗策略,但未观察到生存期的明显优势。在 PETAL 研究中,患者接受2个周期的 R-CHOP 治疗,PET阳性 (△SUVmax <66%) 的患者随机接受 Burkitt 方案化疗或继续 R-CHOP 治疗。该策略未带来任何生存获益,但诱导了显著更高的毒性。因此,化疗难治性疾病的高危患者(定义为中期评估时疗效不佳)需要其他方法,即靶向药物或免疫治疗。SAKK 38-19 研究正在评价 iPET 阳性和/或缺乏分子学缓解的患者在2个周期治疗后在 R-CHOP 基础上加用阿可替尼是否会改善结局。
ZUMA-12 研究也测试了缓解适应性治疗方法,该研究纳入了 IPI 3 和/或 DHL/THL 的高危患者,治疗2个周期后 iPET 显示 DS 4/5 的患者转诊至 CAR-T 细胞治疗。37/40例患者接受了本品 (Axicabtagene ciloleucel = axi-cel) 治疗,CR率高达78%,ORR为89%;未达到中位缓解持续时间、PFS和EFS79。值得注意的是,与接受更多线治疗后的患者的白细胞单采产物相比,患者在最终产物中获得了更多数量的 CAR-T 细胞,并观察到更高的 CAR-T 细胞峰值。这可能提倡在高危 DLBCL 患者的早期治疗线中使用 CAR-T 细胞。
优化治疗-一线免疫疗法
引入 CAR-T 细胞彻底改变了复发性/难治性 DLBCL 的治疗模式,将其设定为一线治疗后难治和早期复发患者的治疗选择(而非HDT/ASCT)在 PFS 和 OS 方面有明显获益。axi-cel组未达到中位OS,而标准 HDT/ASCT 组为31.1个月,PFS为14.7个月和3.7个月。正在 ZUMA-23 研究中检测 CAR-T 细胞作为一线治疗,该试验正在招募 IPI 4 的高危DLBCL、HGBCL以及转化型边缘区和滤泡性淋巴瘤患者。1个周期的 R-化疗后,患者随机分配至标准组(5 xR-CHOP或R-DaEPOCH)或实验 CAR-T 细胞组(axi-cel)。该研究将确定CAR-T 细胞在高危 DLBCL/HGBCL 患者一线治疗中的作用。
双特异性抗 CD20XCD3 单克隆抗体已在既往接受过多线治疗的人群中证实了其治疗复发性疾病的疗效,缓解范围为ORR 52%、CR 39%(glofitamab)和ORR 63%、CR 39%(epcoritamab),部分长期 CR 持续至治疗结束,表明具有治愈潜力。它们也正在一线研究中探索。在 1b 期研究中检测了Glofitamab+R-CHOP,其ORR 较高,为93.5%,完全代谢缓解率为76.1%,细胞因子释放综合征 (CRS) 的发生率较低。一项在 IPI 2-5 的新诊断 DLBCL 患者中开展的 glofitamab 联合 Pola-R-CHP 研究正在进行中。在纳入47例高危 DLBCL 患者 (IPI 3-5) 的 1b/2 期研究中,epcoritamab与 R-CHOP 联合治疗的 ORR 为100%,CR为76%;在 DHL/THL 患者中观察到同样良好的结果,安全性特征可控。一项 III 期随机研究正在 DLBCL IPI 3-5 例患者中评估,在 R-CHOP 基础上加用 epcoritamab。治疗早期的免疫治疗具有一些明显的优势:与多线治疗后的患者相比,其采用更稳健和适合的免疫细胞,并引起更强效的免疫应答,正如 ZUMA-12 所示;它也不考虑分子亚型,使患者能够进入研究,而不需要在治疗前进行分子检测(图2)。
结论
采用靶向治疗的研究事后分析显示,在部分预后不良的患者组中有明确的生存获益,包括分子学高危。此外,靶向药物的疗效证实了此类方法的生物学原理,如伊布替尼在 MCD 亚组中的作用,但N1亚型中 BTK 抑制活性背后的分子机制有待阐明。同样,POLARIX中患者结局的生物学驱动差异,证实该研究中纳入广泛患者组和进行生物学研究的重要性。通过这种方式临床试验的结果可以启发和推动肿瘤生物学的基础研究,进而为开发新的疗法铺平道路。这些例子支持以“所有参与者”的方式设计新的试验,从而使更广泛的患者人群能够利用新药。
高危患者是一个可能从新疗法中获得最大获益的群体,但他们的参与受到体能状态较差的限制,与疾病生物学严格相关。为了实现这一目标,临床试验的设计应该引入一些变化,纳入更多的高危患者,如入选标准的放开和试验中心的分散。另一方面,基于生物标志物的研究可以通过将研究人群限制在特定组并防止患者过度治疗来节省资源。分子相关研究已成为当前临床试验不可或缺的一部分,并可能在不久的将来成为临床实践的一部分。在难治性 DLBCL 患者中采用免疫治疗已经延长了其生存期并克服了不良预后。将免疫治疗转移到治疗的早期阶段并使用基于生物标志物的治疗可能会改善高危 DLBCL 患者的结局。
参考文献
Dabrowska-Iwanicka AP, et al. DLBCL: Who is high risk and how should treatment be optimized? Blood . 2023 Nov 3:blood.2023020779. doi: 10.1182/blood.2023020779.
猜你喜欢
- 拥抱更美好的智能时代
- 2020年01月09日每日养生健康简报,星期四!健康是一种生活态度!
- 北京市:明起低风险地域出京已不必须核酸呈阴性证实
- 职场妈妈生存状况:担忧待遇下降 拉低二孩意愿
- WCLC 2025 | 专访上海胸科医院姜龙医生:中国高发地区肺癌高危人群筛查与早诊策略
- 孕期如何长胎不长肉 孕期长胎不长肉的秘诀
- JCI Insight:急性有氧运动揭示FAHFA区分超重和正常体重跑步者的代谢物
- J Eur Acad Dermatol Venereol:司库奇尤单抗在新发中重度斑块状银屑病患者中显示出比窄带紫外线B光疗更优越的效果
- 判断女性艾滋病最简单方法?这四个表现出现及时找医生看看
- 研究发现:开心果不仅能让人开心,还能降糖、降脂、保护眼睛
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)