首页 > 医疗资讯/ 正文
第31届欧洲消化疾病周(UEGW) 2023:英夫利西单抗皮下制剂作为溃疡性结肠炎维持疗法:一项随机、安慰剂对照3期研究( LIBERTY-UC)
来源 2023-10-20 17:49:03 医疗资讯炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD),是难以根治的多因素疾病。虽然大部分IBD患者使用常规疗法初期有效,但无法治愈,患者仍需要使用生物制剂进一步控制长期病情。

英夫利西单抗制剂是我国引进首个抗TNF-α单克隆抗体,可用于CD和UC的治疗,起效较快,诱导和维持缓解效果显著,被2020年美国胃肠病协会指南推荐为挽救急性重症UC的一线药物。近日,在2023年第31届欧洲消化疾病周(UEGW)上,发布了大量的IBD最新诊疗进展。一项最新试验报告显示,英夫利西单抗皮下制剂(CT-P13 SC)既能为中度至重度活动性UC患者带来显著的临床疗效,又能方便地给药。
先前的研究表明,在IBD和类风湿性关节炎的治疗中,CT-P13 皮下注射剂型的疗效和安全性与 CT-P13 静脉注射剂型相当。本研究旨在证明 CT-P13 SC 在UC患者 CT-P13 IV 诱导治疗后的维持治疗中优于安慰剂。
该研究纳入中度至重度活动性 UC 患者(改良Mayo评分 5 至 9 分,内镜评分≥ 2 分)入选 LIBERTY-UC研究,在第 0、2 和 6 周接受开放CT-P13 IV 5 mg/kg 诱导治疗。在第10周,临床反应(定义为改良Mayo评分比基线至少下降2分且至少下降30%,同时直肠出血亚评分至少下降1分或直肠出血绝对亚评分为0或1分)患者按2:1的比例随机接受CT-P13 SC 120毫克(CT-P13 SC)或安慰剂SC臂治疗,每2周一次,直至第54周。主要终点是第54周时的临床缓解。主要次要终点为第54周时的临床缓解,主要评估指标包括临床反应、内镜组织学粘膜改善和无皮质类固醇缓解。安全性评估持续到第 54 周。
结果显示,共有 548 名患者入组。其中,438 名患者(79.9%)对 CT-P13 IV 诱导给药有反应,并在第 10 周进行了随机分组(CT-P13 SC 组和安慰剂组分别为 294 人和 144 人)。
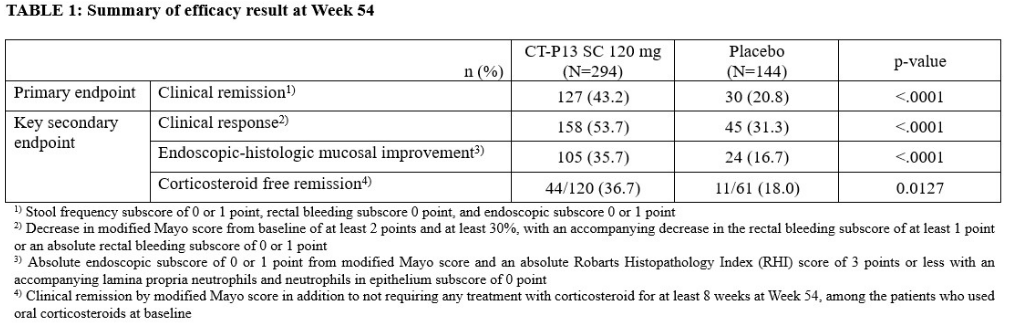
与安慰剂组(20.8%)相比,CT-P13 SC 组(43.2%)在第 54 周的临床缓解率明显更高(P<0.0001),而且CT-P13 SC治疗组的临床反应、内镜-组织学粘膜改善和无皮质类固醇缓解也有统计学意义上的更大改善。CT-P13 SC治疗组和安慰剂组在维持治疗阶段的安全性基本相当。无死亡病例报告。
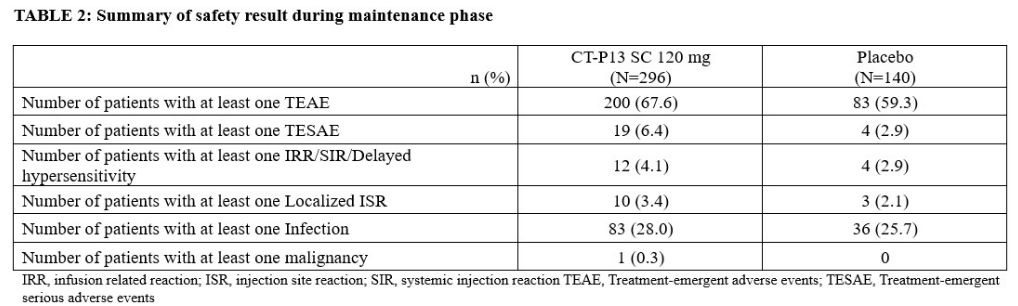
总之,CT-P13 SC对中度至重度活动性UC患者的临床缓解、临床反应、内镜粘膜组织学改善以及第54周无皮质类固醇缓解的疗效均优于安慰剂。另外,未发现新的安全性问题。
参考资料
1 Schreiber et al., 2021. Gastroenterology 2021;160:2340–23
2 Westhovens et al., 2020. Rheumatology 2020;00:1
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)