首页 > 医疗资讯/ 正文
T细胞在实体瘤的免疫治疗中起着基础和关键的作用,有效地将其募集到肿瘤灶中并维持长期的效应功能是一个持续不断的目标,仍然是一个关键的挑战。在这里,华南理工大学杨显珠团队开发了一种富含β-环糊精的可注射海藻酸盐水凝胶(ALG-βCD),并将其注射到肿瘤内,通过捕获的趋化因子CCL25招募CCR9+CD8+T细胞(具有强大的抗肿瘤活性的T细胞的一个亚群)。与此同时,静脉注射金刚烷修饰的抗PD1抗体(Ad-aPD1)将搭乘招募的CCR9+CD8+T细胞,以改善Ad-aPD1在肿瘤内的蓄积。此外,通过Ad和βCD的超分子主客体相互作用,将Ad-PD1和Ad-PDL1抗体固定在ALG-βCD水凝胶中,促进CD8+T细胞与肿瘤细胞的结合,使CD8+T细胞恢复活力,避免耗竭。基于这一治疗策略,T细胞介导的抗癌活性在多个水平上得到促进,最终在原位和手术后的B16-F10肿瘤模型中都取得了优越的抗肿瘤效果。该研究以题为“Promoting The Recruitment, Engagement, And Reinvigoration of Effector T Cells via An Injectable Hydrogel with A Supramolecular Binding Capability for Cancer Immunotherapy”的论文发表在《Advanced Materials》上。

该研究通过设计一种可注射水凝胶来多水平地促进T细胞的抗癌功能,通过影响募集、参与和恢复活力,这被称为RER-T系统。RER-T系统主要是通过原位形成的βCD修饰的海藻酸盐(ALG-βCD)水凝胶捕获趋化因子CCL25并与β-环糊精(βCD)设计丰富的超分子结合位点实现的。捕获的趋化因子CCL25将CCR9+CD8+T细胞聚集到肿瘤组织中,并通过βCD结合位点固定金刚烷修饰的抗PDL1抗体(Ad-aPDL1)。然后,静脉注射金刚烷修饰的抗PD1抗体(Ad-aPD1),使其搭乘CCR9+CD8+T细胞,促进Ad-aPD1在肿瘤内的蓄积,然后通过Ad和βCD的超分子相互作用,进一步将其锚定到ALG-βCD水凝胶中。此外,固定化的Ad-aPDL1和Ad-aPD1促进了CD8+T细胞与肿瘤细胞的结合,并使CD8+T细胞恢复活力以避免衰竭。在这种RER-T策略的基础上,CCR9+CD8+T细胞可以被有效地募集到肿瘤组织中,这种方法显著地促进了它们的激活和抗肿瘤功能,最终实现了增强的T细胞介导的免疫治疗。
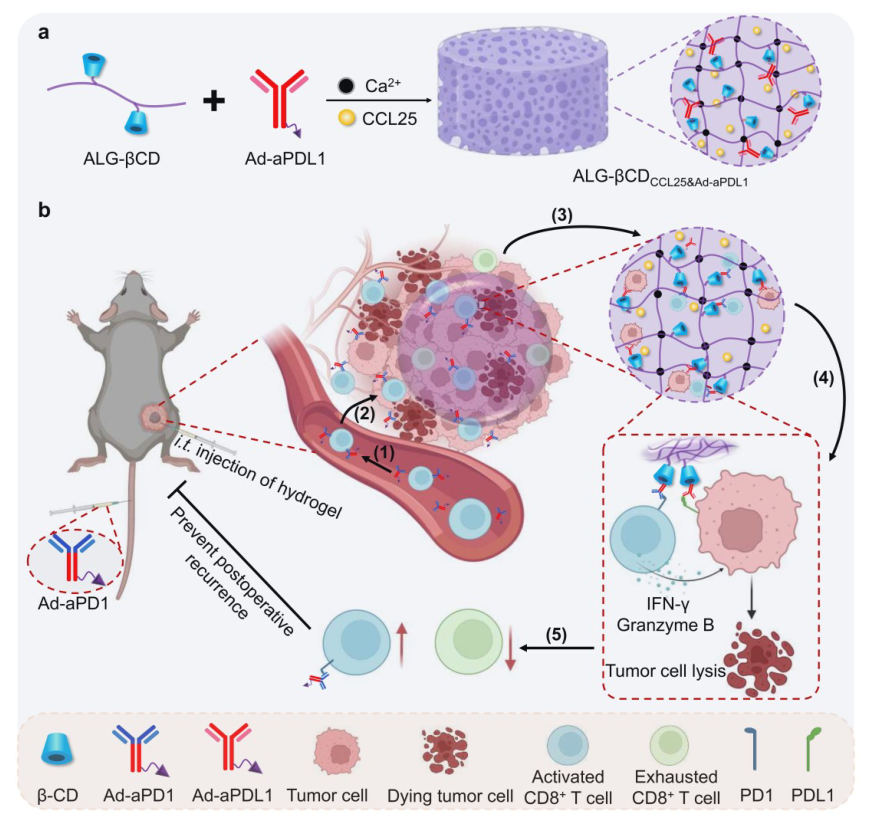
图1.RER-T系统的组成示意图:Alg-βCD水凝胶、捕获趋化因子CCL25和Ad-aPDL1
【捕获的CCL25在RER-T系统中向肿瘤组织募集CCR9+CD8+T细胞】
为了形成可注射水凝胶,通过羧基和羟基之间成功的缩合反应,用βCD修饰海藻酸钠。并且,CCL25在ALG-βCD水凝胶中的负载效率高达89.73±4.85%。捕获的趋化因子CCL25是 CCR9的唯一配体,可以与CCR9相互作用,通过原位ALG-βCDCCL25水凝胶将CCR9+CD8+T 细胞募集到肿瘤组织中。为了证实这一假设,该研究引入了Transwell系统,其中CCR9+CD8+T细胞接种在上室,并将形成的 ALG-βCDCCL25水凝胶添加到下室。T细胞的统计计数进一步证实,水凝胶中T细胞的数量取决于捕获的CCL25的浓度,这意味着通过 RER-T系统有效招募CCR9+CD8+ T细胞。
此外,该研究评估了RER-T系统是否会将CCR9+CD8+T细胞募集到肿瘤组织中。B16-F10荷瘤小鼠瘤内(i.t.)施用ALG-βCDCCL25、空白ALG-βCD或游离CCL25,然后以预定的时间间隔处死进行流式细胞术分析。结果证明,RER-T系统中捕获的CCL25有效地募集CCR9+CD8+T细胞浸润到肿瘤组织中。
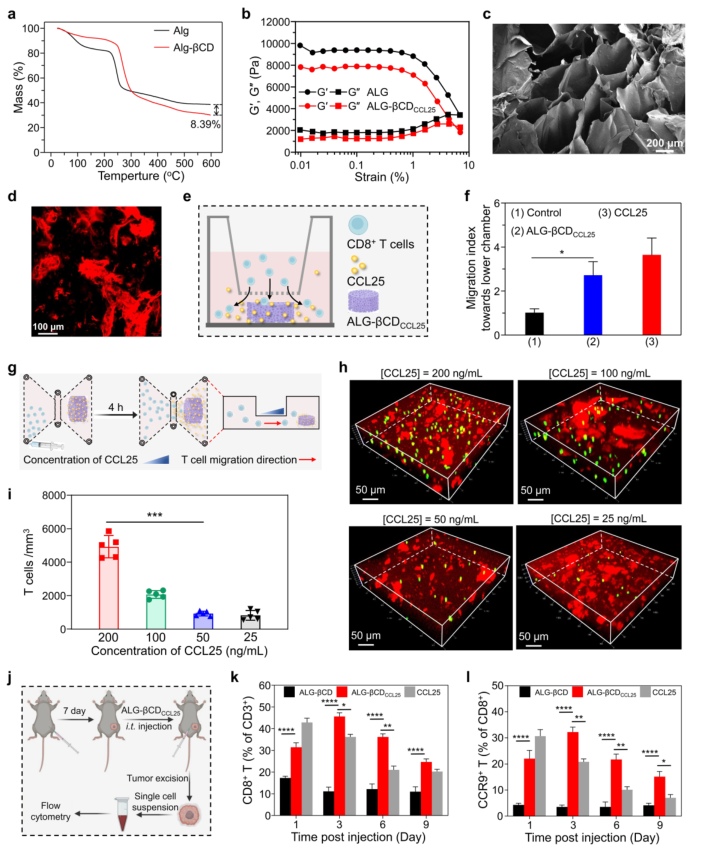
图 2. RER-T系统对T细胞的趋化募集
【循环过程中CCR9+CD8+T细胞搭便车介导的Ad-aPD1瘤内积累】
根据之前的设计,金刚烷修饰的抗体Ad-aPD1可以搭便车募集的CCR9+CD8+T细胞,以改善Ad-aPD1的瘤内积累。此外,该研究首先评估了Ad-aPD1在体外与CD8+ T细胞结合的能力。该研究将分离的CD8+ T细胞与或不与Ad-aPD1一起孵育1小时,然后用抗CD8-FITC 和抗PD1-PE对CD8+T细胞进行染色以进行流式细胞术分析。结果表明Ad-aPD1可以与循环CD8+T细胞结合。总的来说,T细胞搭车的Ad-aPD1在肿瘤中具有更有效的积累以及CCR9+CD8+T细胞的募集。
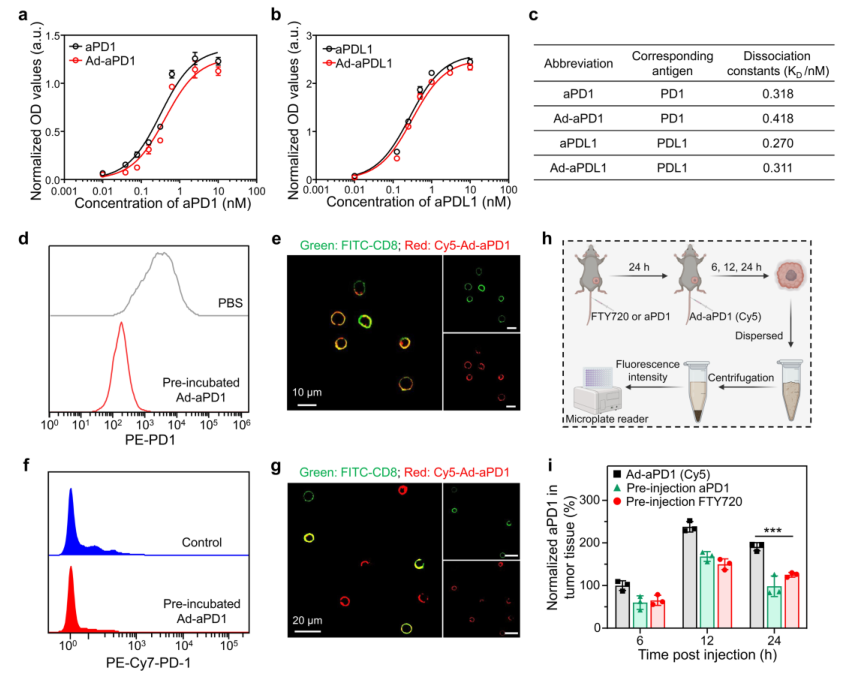
图3.T细胞搭便车Ad-aPD1伴随着T细胞的募集以增强肿瘤积累
【RER-T系统中Ad-aPDL1和Ad-aPD1的超分子固定促进了CD8+T细胞与肿瘤细胞的结合】
RER-T系统的ALG-βCD水凝胶具有丰富的超分子βCD结合位点来固定Ad-aPDL1和Ad-aPD1。因此,固定在ALG-βCD水凝胶上的Ad-aPDL1和Ad-aPD1促进了CD8+T细胞与肿瘤细胞的结合。为了验证这一假设,将ALG-βCD水凝胶与Ad-aPDL1和Ad-aPD1一起孵育,结果表明,Ad-aPD1和Ad-aPDL1可以分别与CD8+T细胞和B16-F10细胞表面的相应抗原结合,然后通过Ad和βCD之间的超分子相互作用将这些细胞富集到水凝胶中。
在证实ALG-βCDaPDL1/aPD1水凝胶可以同时富集CD8+T细胞和肿瘤细胞后,该研究进一步研究了该系统是否可以促进CD8+T细胞与肿瘤细胞的结合。结果表明,ALG-βCD水凝胶和 Ad-aPDL1/Ad-aPD1之间的超分子相互作用可以同时富集CD8+T细胞和肿瘤细胞,并随后促进它们的结合。通过Ad-aPDL1/Ad-aPD1的超分子结合促进T细胞和肿瘤细胞之间的结合,也可以促进T细胞的激活和抗肿瘤功能。
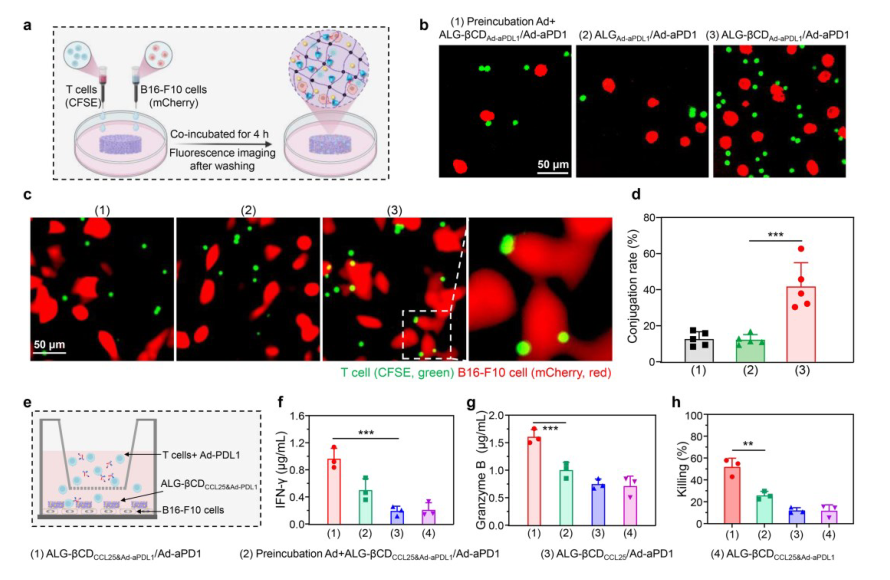
图 4. Ad-aPDL1和Ad-aPD1超分子固定在RER-T系统上,促进CD8+T细胞与肿瘤细胞的结合
【RER-T系统增强T细胞体内的抗肿瘤作用】
该研究建立了原位B16-F10肿瘤模型来研究RER-T系统的治疗活性。Ad-aPD1与ALG-βCDCCL25联合(ALG-βCDCCL25/Ad-aPD1组)显示出适度改善的抗肿瘤功效,肿瘤抑制率为56.18%。此外,当ALG-βCDCCL25&Ad-aPDL1水凝胶(G5)注射到肿瘤中时,肿瘤抑制率达到62.27%。而且,在RER-T系统中进一步添加Ad-aPDL1后,获得了最佳的抗癌活性,达到87.71%。通过评估肿瘤组织重量和治疗后图像进一步证实了G7中所见的卓越抗肿瘤效率,并且在治疗期间观察到良好的生物相容性。
为了评估RER-T系统的卓越治疗活性是否是通过T细胞的募集、参与和重振而引发的,首先通过流式细胞术分析了T细胞亚群的频率。证实了ALG-βCDCCL25&Ad-aPDL1/Ad-aPD1处理的小鼠肿瘤组织中CD8+T细胞的浸润增强。更重要的是,正如预期的那样,在设计的 ALG-βCDCCL25&Ad-aPDL1/Ad-aPD1 组中,招募的 CCR9+CD8+ T 细胞这一感兴趣的子集也最高。ALG-βCDCCL25/Ad-aPD1、ALG-βCDCCL25&Ad-aPDL1和ALGCCL25&Ad-aPDL1/Ad-aPD1 组中肿瘤中CCR9+CD8+T细胞的百分比也有类似的提高,这也证实了CCR9+CD8+T细胞的有效招募水凝胶中的CCL25细胞。不仅如此,RER-T治疗重塑了瘤内CD8+T细胞的表型,从而产生强大的抗肿瘤免疫反应。
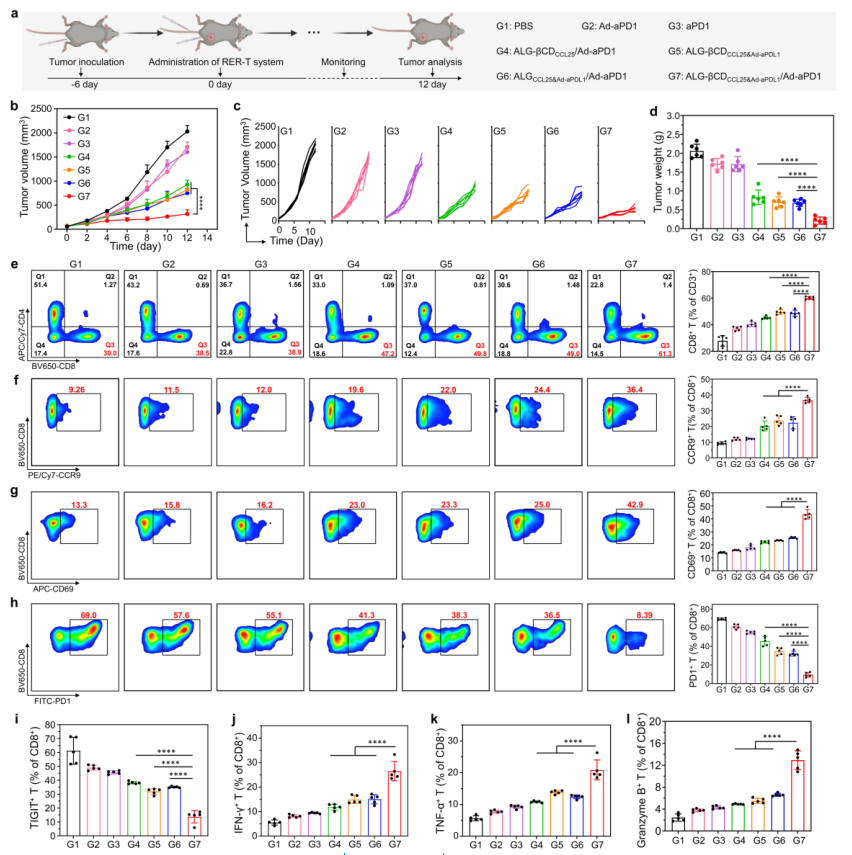
图5. RER-T系统增强的抗肿瘤作用
随着原发肿瘤模型中有效治疗效果的确认,该研究进一步探索了RER-T系统抑制术后复发的潜力。结果表明,用RER-T系统(G6)治疗的小鼠表现出显着抑制的肿瘤复发。此外,对采集的肿瘤组织的图像和重量的评估进一步直观地验证了抑制术后肿瘤复发的最佳功效。此外,治疗小鼠的体重没有明显变化,表明该治疗具有良好的生物安全性。
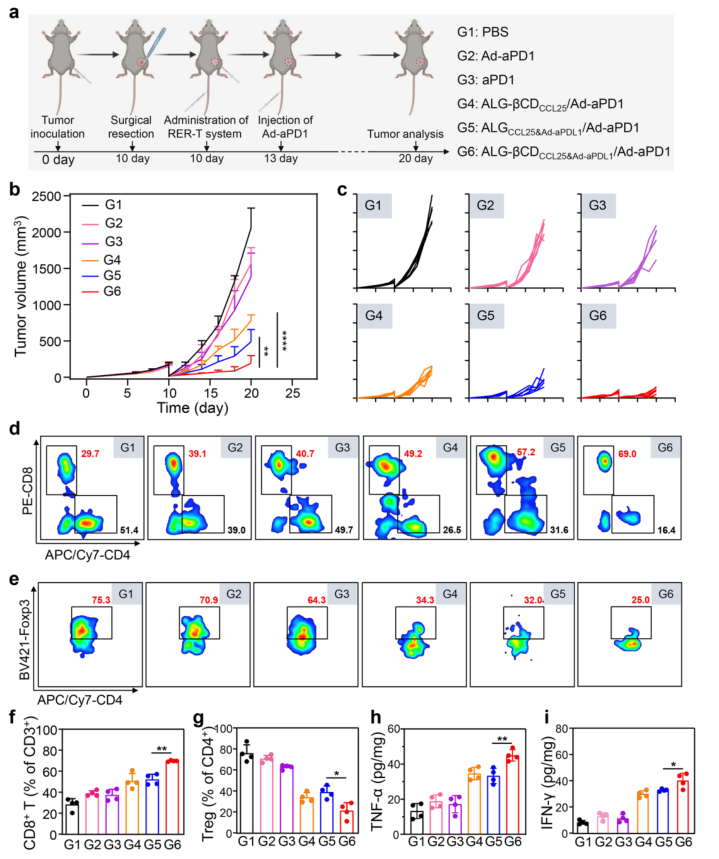
图 6. RER-T系统抑制术后复发
【小结】
总之,T细胞的募集、参与和重振的合理组合提高了治疗效果,并为增强T细胞介导的免疫治疗提供了另一种途径。此外,这项研究为T细胞抗癌功能的多级调节提供了概念证明,该功能可以轻松扩展到其他类型的免疫细胞,例如DC和自然杀伤细胞。
原文链接:
https://doi.org/10.1002/adma.202309667
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)