首页 > 医疗资讯/ 正文
材料和方法
1990年-2020年,从威斯康星医学院和约翰霍普金斯大学医院的病理档案中收集了13例具有上皮样,透明胞浆特征的孤立性纤维性肿瘤病例。每个病例有5到12个HE组织切片可供复查,且蜡块可用于所有病例的免疫组化和分子研究。临床信息是从患者的医疗记录中或通过联系转诊医生获得的。
检测的抗体包括:细胞角蛋白AE1/AE3、 vimentin、SMA、desmin、S100、CD31、CD34、bcl2、MDM2、EMA、STAT6(克隆号YE361;1:800;Abcam),在部分选定的病例中(病例7、8、10和12),未染色的组织切片用CD117抗体和DOG1抗体进行检测。其中12例病例,将取样的肿瘤细胞使用基于RNA的Archer FusionPlex进行融合基因分析。另一个病例使用约翰霍普金斯大学肉瘤MDL融合面板进行了基因融合测试。
临床病理特征
患者的临床和病理总结见表1。肿瘤发生于8名女性和5名男性,年龄在36-80岁之间(平均63岁),分别位于眼眶(3)、下肢(3)、腹膜后(2)、腹腔(2)以及颈部、骨盆、耻骨的浅表软组织(各1个)。肿瘤的大小为3.5至24.5厘米(平均为9厘米)。
9例肿瘤边界清楚,4例为侵袭性肿瘤(包括3例眼眶肿瘤中的2例),一个位于腿部的侵袭性肿瘤(病例6)需要行膝盖下截肢治疗。
位于盆腹腔的肿瘤总结如下:1例为附着于镰状韧带的腹腔内肿物(病例7);1例为附着于大肠浆膜的腹膜后肿物(病例8),尽管该肿瘤边界清楚且易于切除,但有多发、散在的腹膜种植;1例是附着于胰腺的腹膜后肿物(病例10),另外1例为附着于膀胱的盆腔深部肿物(病例13)。

组织形态学发现
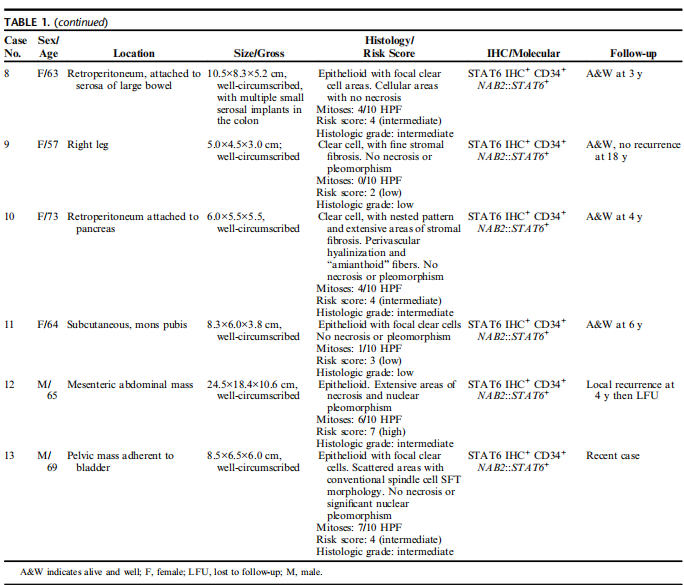
肿瘤主要由大的上皮样细胞组成,分布均匀,间质胶原纤维增生程度不一(图1)。
研究中大多数病例的特征是:低到中的组织学级别,微小至轻度细胞异型性,缺乏核的多形性和坏死,核分裂象<3个/10HPF。它们主要由大的上皮样细胞组成,细胞核从圆形到椭圆形,胞浆丰富、嗜酸性或透明(图2)。
少数病例表现为细胞异型性轻度增加,以圆形、上皮样细胞为特征,细胞核增大,核仁突出,有丝分裂活性增加(4-9个核分裂象/10 HPF)(图3)。
部分病例肿瘤间质的显著纤维化形成硬化带,分割肿瘤组织呈巢状结构(病例1、2、5、6、8和10)(图4)。
病例1、4、5均是眼眶肿瘤,显示小的肿瘤细胞聚集成群,形成类似于脑膜瘤的旋涡状结构(图5)。
7例肿瘤(病例1、3、4、5、6、8和11)显示出明显的血管外皮细胞生长模式和分支血管(图6)。
3例出现网状/微囊形态(病例5、7、8)(图7)。
在2例病例中(病例7、10)存在致密的血管周围玻璃样变区域,并伴有不规则的间质胶原沉积,让人联想到所谓的“淀粉样”纤维(图8)。
在有丝分裂计数方面,2例为0个,4例为1-3个/10HPF,2例(病例8和病例10)为4个/10HPF,病例13为7个/10HPF,病例6为9个/10HPF。
2例(病例6、12)出现坏死区域,伴脂肪和肌肉浸润;病例6表现为中度核多形性,可见大量破骨细胞巨细胞与上皮样肿瘤细胞混合。8例病例除上皮样形态外,还出现明确的透明细胞区域(病例1、3、5、8-11、13),这些区域的肿瘤细胞呈圆形,有较大的泡状核,周围有丰富、透明的细胞质(图9)。
其中的5例病例,仅局灶出现透明胞浆肿瘤细胞,伴大片嗜酸性胞质的上皮样细胞区域(病例1、3、8、11、13),其余3例患者,整个肿瘤细胞群均由透明细胞组成(病例5、9、10)。4例(病例2、6、12、13)可显示经典SFT梭形特征的区域。
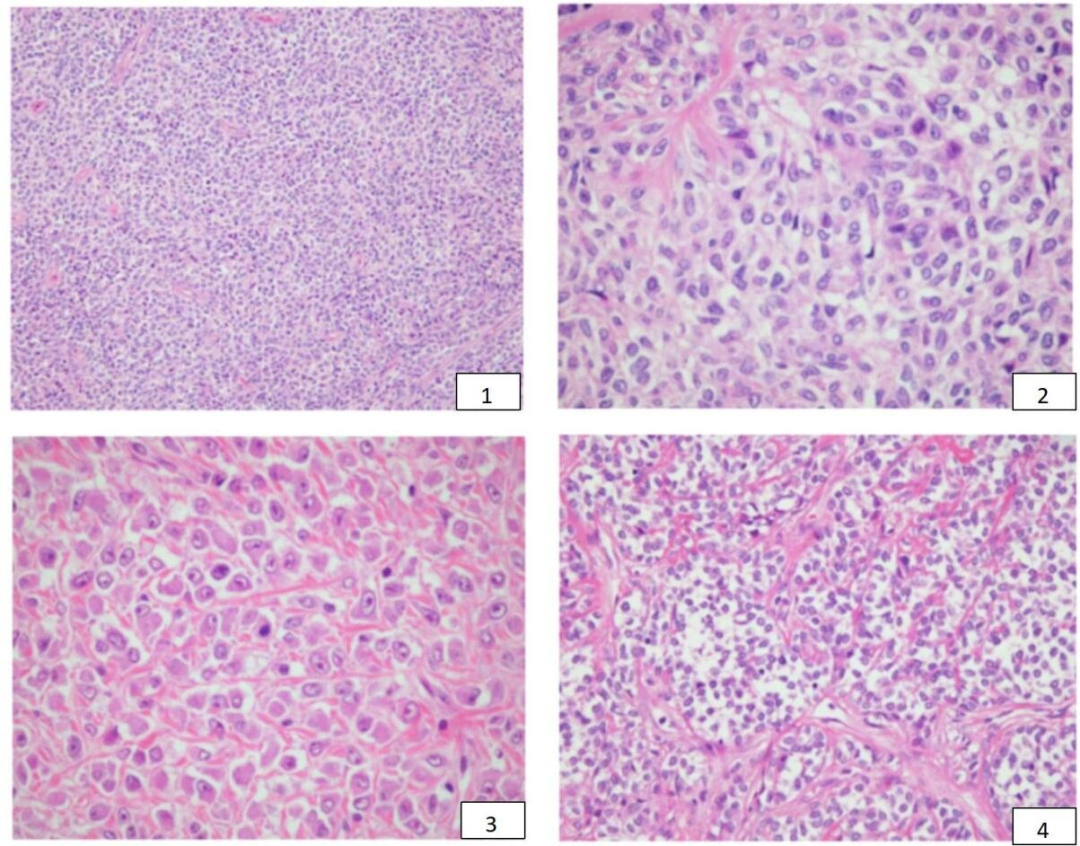
图1:低倍镜下(病例2)显示成片的、圆形、上皮样细胞,具有丰富的嗜酸性胞浆,因细胞透明而显示隐约失粘附;
图2:高倍镜下(病例2)显示上皮样细胞具有圆形的细胞核,染色质分散,核异型性小,细胞边缘见嗜酸性细胞质,胞浆透明区域明显;
图3:高倍镜下(病例6)显示一群圆形的上皮样肿瘤细胞,细胞核略大,染色质边集,核仁突出,胞浆丰富,有丝分裂象很容易识别(中心),细胞间胶原纤维增生显著。
图4:较细的纤维带将肿瘤细胞分隔成肺泡样的结构,胞浆透明。
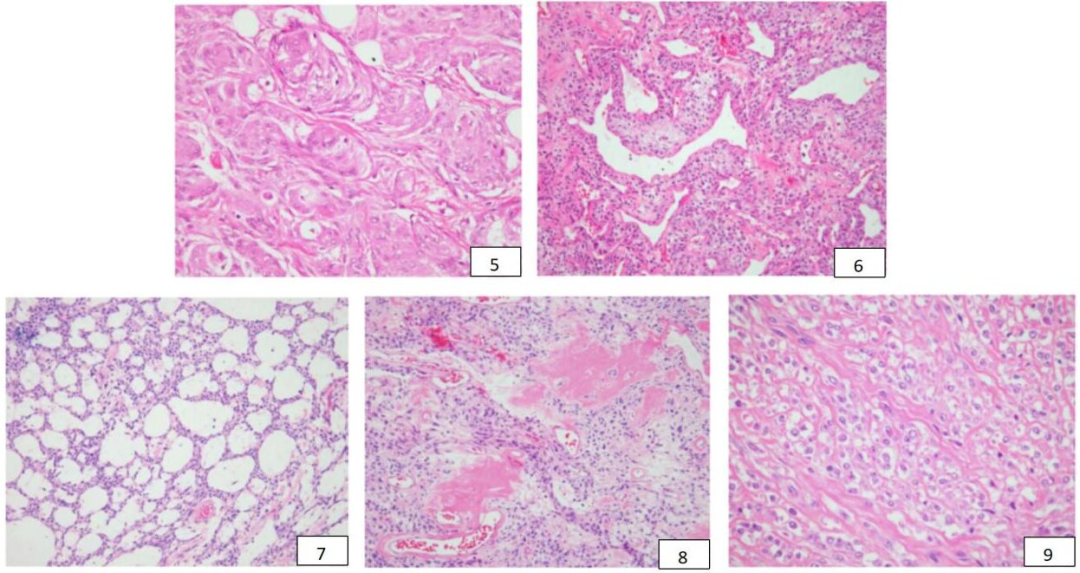
图5:眼眶肿瘤(病例1)显示肿瘤细胞旋涡状排列,类似于脑膜瘤的生长模式;
图6:血管外皮细胞生长模式,显示具有明显腔隙的分支血管,细胞胞浆透明(病例5);
图7:该肿瘤(病例7)显示出独特的的微囊性生长模式,在微囊间隙可以发现小灶胞浆透明的上皮样细胞。
图8:胶原蛋白的不规则沉积,,有时候呈星状外观,在血管周围分布明显(病例7);
图9:肿瘤细胞胞浆透明(病例10),以间质透明变性形成的精细网状结构为特征。
免疫组化
12例vimentin和bcl-2阳性表达;11/13例患者的CD34染色阳性;10/13例(病例2-5、7-12、13)的STAT6染色显示出强的弥漫性核染色;1例(病例2)表现出CD34和STAT6双阴性表达;在所有病例的肿瘤中,剩余的抗体检测均为阴性。
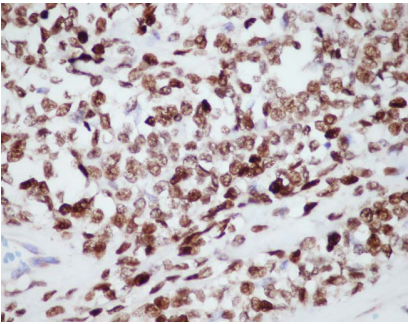
图10:肿瘤细胞核弥漫强阳性表达STAT6(病例1)。
分子病理
在所有13个(100%)肿瘤中均检测到特征性的NAB2::STAT6融合基因,并发现了4个单独的融合转录变异体(图11)。
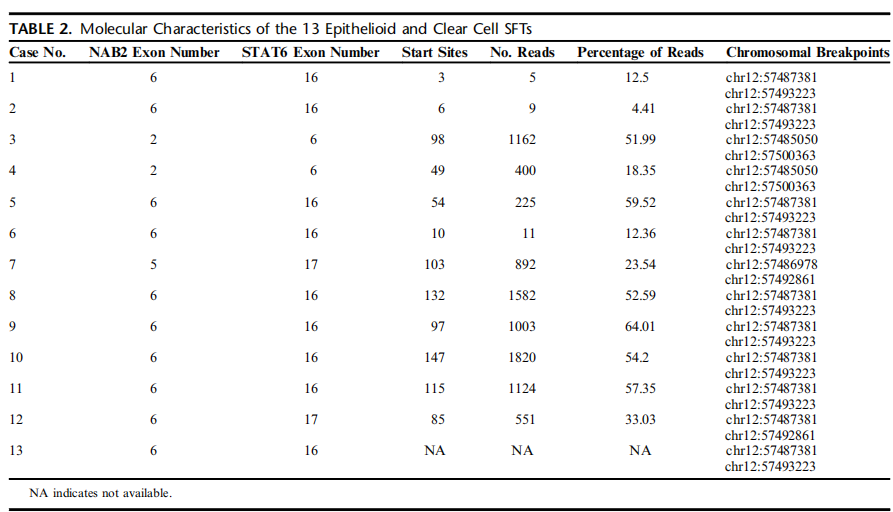
检测到9例(69%)NAB2外显子6::STAT6外显子16的融合(断点chr12:57487381和chr12:57493223);检测到2例(15%)NAB2外显子2::STAT6外显子6的融合(断点chr12:57485050和 chr12:57500363);在1例病例中检测到NAB2第5外显子和STAT6第17外显子的融合,断点是chr12:57486978和chr12:57492861(8%);1例检出NAB2第6外显子和STAT6第17外显子的融合,断点chr12:57487381和chr12:57492861(8%)(表2)。
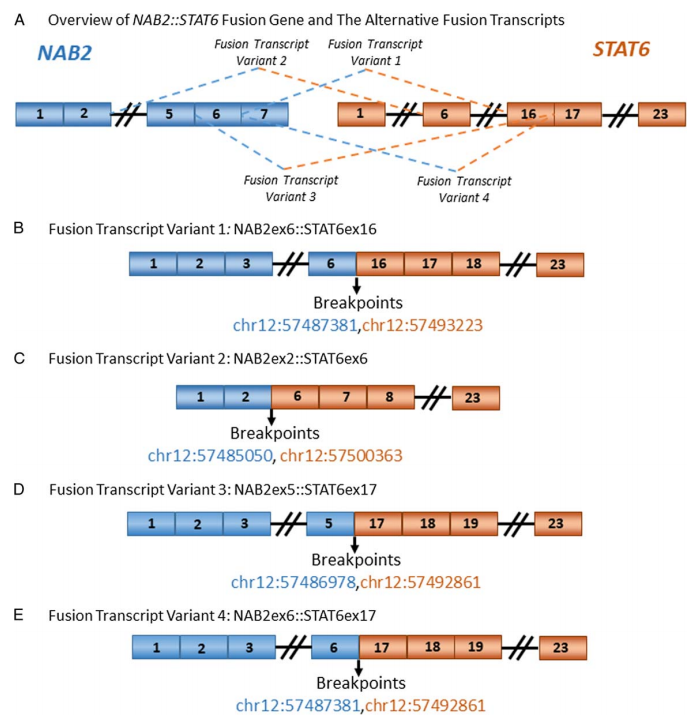
图11 A图显示了NAB2::STAT6融合基因的4个转录本变体;B图为融合得到的转录本变体1的示意图,显示NAB2第6外显子(编码5’非翻译区)与STAT6第16外显子(编码3’非翻译区)紧邻;C图为转录本变体2的示意图,显示NAB2第2外显子(编码5’非翻译区)与STAT6第6外显子(编码3’非翻译区)相邻;D图是融合转录本变体3的示意图,显示NAB2第5外显子(编码5‘非翻译区)与STAT6第17外显子(编码3’非翻译区)连接;E是融合转录本变体4示意图,显示NAB2第6外显子(编码5’非翻译区)与STAT6第17外显子(编码3’非翻译区)相连。
临床随访
本文根据Demicco等人【1】提出的改进的风险评估模型来预测SFT的转移潜能,13例病例分成低危6例,中危5例,高危2例(表1)。在6例低风险组患者中,有2例失访,3例确诊后分别在6年、15年和18年均存活且情况良好,无转移迹象;1例患者在7年后出现局部复发,随后多处转移,最终死亡。3例中度风险类别的患者在诊断后3年、3年和4年后均存活且病情良好,第4例患者在4年后出现局部复发,1例为最近的病例。
1例高危患者在8个月后发生多处转移,并在最初诊断1年后死亡。第2例高危患者在诊断4年后出现局部复发。
作者认为组织学形态与风险评估评分之间可能存在良好的相关性,然而其中也存在特例,比如病例5表现出温和的组织学特征和低级别风险评分(评分=3),但生物学行为表现为高度侵袭性,并最终死亡。
本研究病例数较少,缺乏完整的随访,这阻碍了统计学分析,因而没有观察到NAB2::STAT6转录变异体、CD34或STAT6 免疫组化的表达和临床行为之间的相关性。
讨论
一、圆形上皮样细胞组成的SFTs极其罕见,由Marchevsky【2】首次在纵隔病例中描述。之后又有7例病例报告发表,肿瘤分别发生于眼眶、坐骨肛门窝软组织、坐骨直肠窝、颈部、胸膜和中枢神经系统。Smith等【3】报道了13例头颈部上皮样形态的SFTs,其中1例表现出透明的胞浆,他们的研究发现上皮样细胞形态与复发风险正相关。Argani等【4】报告了5种具有上皮样和透明细胞形态的肾脏恶性SFTs,形态上模拟肾脏的透明细胞肉瘤,作者强调了这些肿瘤与其他以上皮样形态为特征的软组织肿瘤鉴别时所遇到的困难,有时只能通过分子检测来进行诊断。
二、本文研究中的所有肿瘤均表现出典型的NAB2::STAT6易位,迄今为止,大多数研究都支持NAB2::STAT6易位是SFT发病机制的基础。在免疫组化方面,10例STAT6的IHC染色为强阳性,3例为阴性或不确定阳性,2例CD34为阴性,STAT6阴性的SFT很少见,在一些研究中发现STAT6和CD34的表达缺失与恶性生物学行为相关,但是在本文的研究中,没有得出STAT6或CD34阴性肿瘤与生物学相关的结论,1例STAT6和CD34阴性的患者失访。目前尚不清楚STAT6的缺失是否是假阴性,还是通过其他机制的表达缺失,因此通过分子方法证明NAB2::STAT6融合可能比IHC分析更可靠,特别是对于上皮样形态的病例。
三、在鉴别诊断方面,IHC和分子检测有助于分辨形态相似的软组织肿瘤。
-
上皮样肉瘤:一种浅表软组织肿瘤,主要发生于年轻患者的四肢,CD34和细胞角蛋白呈阳性表达,分子特征是SMARCB1(INI1)基因的缺失,这可以通过免疫组化SMARCB1(INI1)的表达缺失来显示。而上皮样形态的SFT,角蛋白几乎不表达,且STAT6通常呈明确的核阳性,NAB2::STAT6融合更能明确诊断。
-
硬化性上皮样纤维肉瘤(SEF):一些病例表现为上皮样细胞片状排列,间质轻度纤维化,与上皮样SFT形态学相似,但SEF肿瘤细胞的MUC4和上皮膜抗原阳性表达,STAT6不表达,以及分子研究发现的EWSR1、CREB3L1、CREB3L2和/或FUS基因的独特重排,有助于鉴别诊断。
-
许多其他类型的软组织肿瘤如滑膜肉瘤、血管肉瘤、平滑肌肉瘤、恶性周围神经鞘膜瘤、胃肠道间质瘤、黏液炎性成纤维细胞肉瘤都可以显示上皮样形态,IHC和分子检测有助于鉴别这些肿瘤。
-
脑膜瘤:本文2例发生于眼眶内的肿瘤最初被诊断为脑膜瘤或恶性脑膜瘤,考虑到眼眶位置、靠近视神经以及肿瘤细胞的排列形态,需要使用STAT6 IHC或相关分子检测来排除脑膜瘤的诊断。
-
胃肠道间质瘤:位于腹腔内的肿瘤需要与胃肠道间质瘤鉴别,后者也可以显示出显著的上皮样形态,DOG1和CD117的染色有助于鉴别。
-
软组织透明细胞肉瘤:通常由椭圆形或梭形细胞组成,嗜酸性胞浆,在一些病例中可观察到胞质透明区域,经典的梭形细胞形态、S100蛋白和其他黑色素细胞标记物的强阳性表达将有助于诊断,在分子方面,检测到EWSR1与ATF1或CREB1的融合能证实透明细胞肉瘤的诊断。
-
血管周上皮样细胞瘤:虽然罕见,但在鉴别诊断中也应考虑,并且可以通过黑色素细胞和平滑肌标记物(如HMB45、Melan-A、MITF、SMA、desmin和caldesmon)的共同表达来区分。
-
具有透明细胞形态特征的肿瘤转移到软组织,如肾细胞癌,也应通过使用适当的免疫组化来排除。
结论
总之,SFTs很少出现上皮样和透明细胞形态,这为鉴别诊断造成了困难。基于风险分层,具有这种形态的肿瘤可能归属于低风险、中风险和高风险类别,这需要对更多的病例进行研究,才能得出这些特征的准确预后意义。参考既往文献,这种特殊形态可能在SFT恶变中被发现,因此认识这种形态对于正确诊断和对症治疗是十分重要的。
参考文献及书籍:
1.Demicco EG, Wagner MJ, Maki RG, et al. Risk assessment in solitary fibrous tumors: validation and refinement of a risk stratification model. Mod Pathol. 2017;30:1433–1442.
2.Marchevsky AM, Varshney D, Fuller C. Mediastinal epithelioid solitary fibrous tumor. Arch Pathol Lab Med. 2003;127:e212–e215.
3 Smith SC, Gooding WE, Elkins M, et al. Solitary fibrous tumors of the head and neck: a multi-institutional clinicopathologic study. Am J Surg Pathol. 2017;41:1642–1656.
4.Argani P, Kao YC, Zhang L, et al. BCOR overexpression in renal malignant solitary fibrous tumors: a close mimic of clear cell sarcoma of kidney. Am J Surg Pathol. 2019;43:773–782.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)