首页 > 医疗资讯/ 正文
[摘要]
背景与目的:神经侵犯在结直肠癌中有一定的预后价值。对于局部进展期直肠癌,在接受过新辅助放疗及根治性外科手术且经术后病理学检查证实淋巴结为阴性(ypⅠ~Ⅱ)的直肠癌患者中,肿瘤可能存在不同程度的退缩,而此时神经侵犯是否还有预后价值目前尚未见报道。本研究旨在探讨神经侵犯在新辅助放疗后淋巴结阴性的直肠癌中的预后价值。
方法:回顾性分析美国癌症监测、流行病学和最终结果(the Surveillance, Epidemiology, and End Results,SEER)数据库2000年—2018年5 222例接受新辅助放疗术后经病理学检查证实为ypⅠ~Ⅱ期的直肠癌患者的临床病理学资料和直肠癌特异性生存资料,采用卡方检验比较有无神经侵犯两组患者之间的基线资料差异,用Kaplan-Meier法和log-rank检验比较两组之间的生存差异,运用多因素Cox回归模型分析对患者肿瘤特异性生存有影响的因素。结果:该人群中有神经侵犯者329例,无神经侵犯者4 893例。与无神经侵犯的患者相比,有神经侵犯的患者中,黑种人、癌胚抗原(carcinoembryonic antigen,CEA)升高、Ⅱ期病灶、肿瘤小于5 cm和低分化的比例更高(P<0.05)。无神经侵犯的直肠癌患者的肿瘤特异性生存显著优于有神经侵犯的直肠癌患者(5年生存率:85.3% vs 68.9%),且此种生存差异在ypⅡ期直肠癌患者中更显著。多因素Cox回归模型提示有神经侵犯是新辅助放疗后淋巴结阴性直肠癌患者的独立预后因子。结论:神经侵犯与新辅助放疗后淋巴结阴性的直肠癌患者的生存密切相关,可作为此类患者的预后评判因子。
[关键词] 神经侵犯;直肠癌;新辅助放疗;淋巴结阴性;预后因子
结直肠癌是世界范围内常见的恶性肿瘤之一,其发病率居恶性肿瘤第三位,死亡率居第二位,严重威胁人类健康[1]。对于结直肠癌的治疗,目前提倡以手术为基础的综合治疗。对于局部进展期直肠癌,新辅助放化疗联合标准的全直肠系膜切除手术被证实可降低局部复发率[2]。在肿瘤生长过程中,肿瘤细胞可以沿着血管、淋巴管或神经播散[3]。既往研究[4-5]表明,神经侵犯与结直肠癌恶性病理学表型以及不良预后密切相关,此外有研究[6]表明,神经侵犯可作为结肠癌辅助化疗的预后预测因子。
然而,在接受过新辅助放疗后术后病理学检查证实淋巴结为阴性的直肠癌患者中,肿瘤有不同程度的退缩,而在此时神经侵犯是否还有预后价值,以及神经侵犯与其他临床病理学因素的相关性是否发生变化,目前鲜见研究报道。本研究通过回顾性分析美国癌症监测、流行病学和最终结果(the Surveillance, Epidemiology, and End Results,SEER)数据库相关资料,探索神经侵犯在在新辅助放疗后淋巴结阴性的直肠癌中的预后预测价值。
1 资料和方法
1.1 病例选择
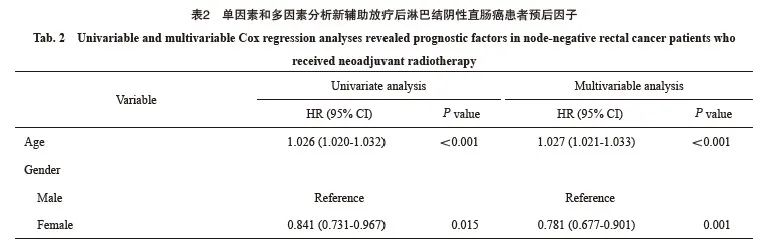
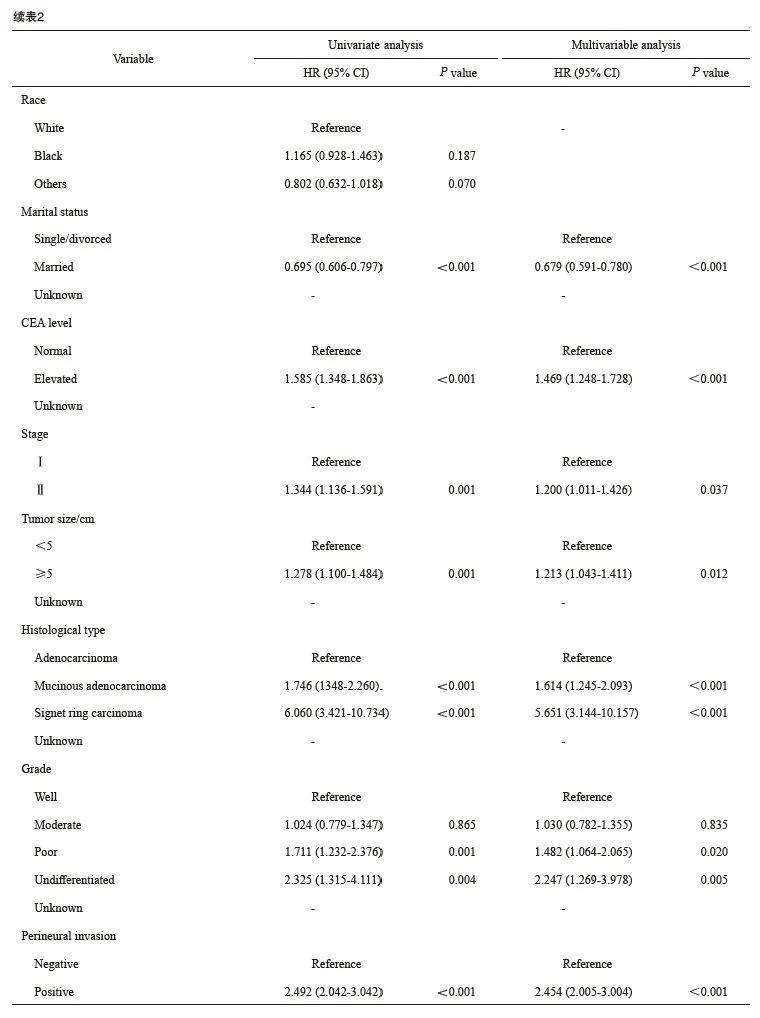
回顾性分析美国SEER数据库[7]2000年—2018年5 222例接受新辅助放疗及根治性外科手术且经术后病理学检查证实为ypⅠ~Ⅱ期直肠癌患者的临床病理学资料和生存资料,随访截止时间为2018年12月31日。纳入标准:① 接受了新辅助放疗的直肠癌患者;② 接受了根治性手术;③ 术后病理学分期为Ⅰ~Ⅱ期;④ 有明确的神经侵犯信息(2000年—2018年);⑤ 生存信息明确。变量信息提取:年龄、性别、种族、婚姻状态、治疗前癌胚抗原(carcinoembryonic antigen,CEA)水平、肿瘤大小、病理学类型、肿瘤分化、病理学分期、是否有神经侵犯、生存状态和生存时间,变量的具体定义见表1。
1.2 统计学处理
分类变量用卡方检验,连续变量用t检验。采用Kaplan-Meier法绘制生存率曲线,组间比较采用log-rank检验;多因素分析采用Cox回归模型,以识别预后因子。统计学分析通过SPSS 25.0完成,生存曲线通过R语言绘制。P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料
回顾性分析美国SEER数据库,总共5 222例接受新辅助放疗及根治性外科手术且术后病理学检查证实为ypⅠ~Ⅱ期的直肠癌患者被纳入本研究,其中有神经侵犯者329例,无神经侵犯者4 893例。ypⅠ期患者1 216例,ypⅡ期患者4 006例。与无神经侵犯的患者相比,有神经侵犯的患者中黑种人,CEA升高,Ⅱ期病灶,肿瘤小于5 cm和低分化的比例更高(P<0.05,表1)。
2.2 生存分析
生存分析结果显示,无神经侵犯的直肠癌患者的肿瘤特异性生存显著优于有神经侵犯的直肠癌患者(5年生存率85.3% vs 68.9%)(图1)。进一步的亚组分析显示,无神经侵犯的直肠癌患者与有神经侵犯的直肠癌患者在ypⅡ期人群中的生存差异显著大于ypⅠ期人群(图2、3)。多因素Cox回归模型分析显示年龄、性别、婚姻状态、CEA水平、病理学分期、肿瘤大小、组织病理学类型、病理学分级和神经侵犯是新辅助放疗后淋巴结阴性直肠癌患者的独立预后因素(表2)。
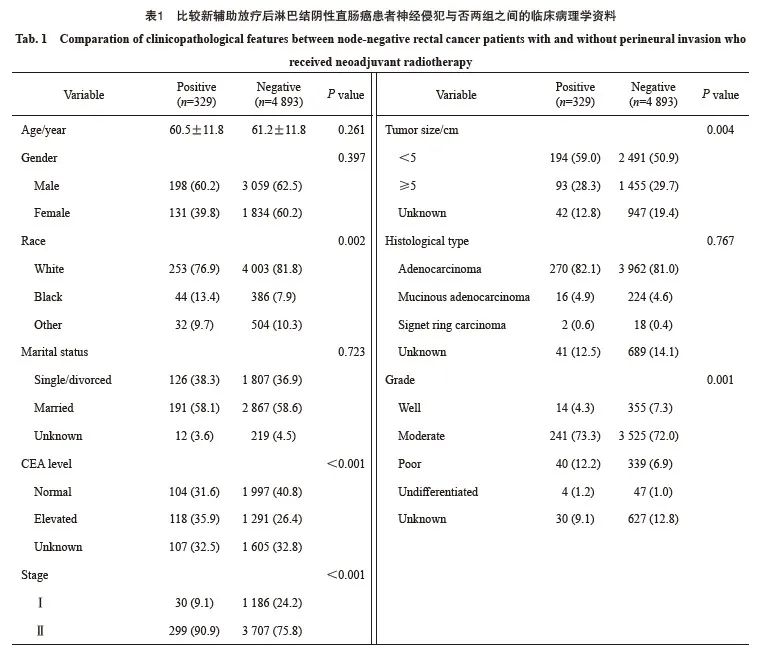
图1 新辅助放疗后淋巴结阴性直肠癌患者不同神经侵犯状态的生存曲线
Fig. 1 Kaplan-Meier survival plots of node-negative rectal cancer patients who received neoadjuvant radiotherapy according to the status of perineural invasion
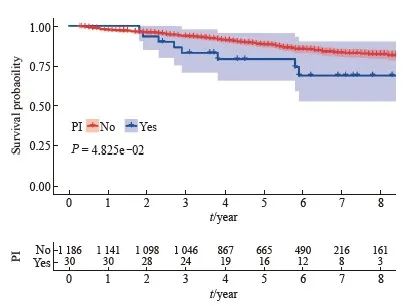
图2 新辅助放疗后ypⅠ期直肠癌患者不同神经侵犯状态的生存曲线
Fig. 2 Kaplan-Meier survival plots of yp Ⅰrectal cancer patients who received neoadjuvant radiotherapy according to the status of perineural invasion
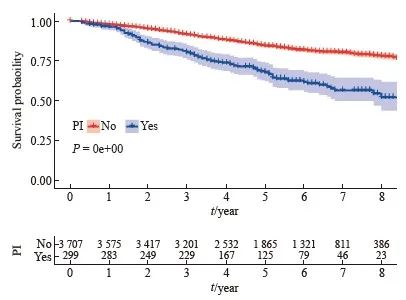
图3 新辅助放疗后ypⅡ期直肠癌患者不同神经侵犯状态的生存曲线
Fig. 3 Kaplan-Meier survival plots of yp Ⅱ rectal cancer patients who received neoadjuvant radiotherapy according to the status of perineural invasion
3 讨 论
神经侵犯作为Ⅱ期结直肠癌预后的一个高危因素,可指导Ⅱ期结直肠癌辅助化疗策略的选择。既往研究报道,在结直肠癌中,神经侵犯与更恶性的临床病理学特征相关,提示不良预后[8]。但是既往研究都是在无新辅助治疗的背景下,新辅助放疗后,随着肿块的退缩,各种临床病理学因素都有可能发生变化,神经侵犯状态也有可能改变,在新辅助放疗后淋巴结阴性的直肠癌患者,神经侵犯是否还有预后价值,目前鲜见研究报道,本研究通过回顾性分析美国SEER数据库,探讨神经侵犯在新辅助放疗后淋巴结阴性直肠癌患者中的预后预测价值,旨在对此类患者的个体化随访和辅助治疗策略提供线索。
本研究结果表明,有神经侵犯的患者CEA升高的比例更多,分期更晚,分化更低,提示有神经侵犯的肿瘤恶性程度更高,这与既往的研究[8]是一致的。研究[8]表明,存在神经侵犯与结直肠癌的不良预后密切相关。一项研究[9]针对淋巴结阴性的Ⅰ期和Ⅱ期结肠癌评价神经侵犯的预后价值,结果表明,在Ⅰ期和Ⅱ期结肠癌中均能够观察到存在神经侵犯的结肠癌患者的生存期更短。为了验证神经侵犯在新辅助放疗后淋巴结阴性直肠癌患者中是否有预后价值,我们对这类患者进行了生存分析,发现无神经侵犯的直肠癌患者的5年生存率为85.3%,而有神经侵犯的直肠癌患者的5年生存率仅为 68.9%,与无神经侵犯的直肠癌患者相比,有神经侵犯的患者增加了145%的死亡风险,两者之间的生存差异在ypⅠ期和ypⅡ期的患者中均存在,且ypⅡ期的患者中的差异更大,提示神经侵犯在ypⅡ期直肠癌患者中能够发挥更大的预后预测作用,而ypⅠ期结肠癌,由于肿瘤侵犯局限于肌层,神经侵犯发挥的作用比较局限。这些研究结果提示,在新辅助放疗后淋巴结阴性直肠癌患者中,辅助化疗可能具有一定的价值,可能会降低复发风险,此外对于有神经侵犯的患者,适当地增加随访频次可能有助于更早地发现复发转移病灶,从而能够及时地进行干预,改善患者的预后。我们的研究也存在一定的局限性,部分病例的随访时间不足,对统计事件的发生可能会有一定的影响。
综上所述,本研究探讨了神经侵犯在新辅助放疗后淋巴结阴性直肠癌患者的预后预测价值,可望为此类患者随访策略的制定提供新的思路。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SAUER R , BECKER H , HOHENBERGER W , et al . Preoperative versus postoperative chemoradiotherapy for rectal cancer[J]. N Engl J Med, 2004, 351(17): 1731-1740.
[2] HUH J W, LEE J H, KIM H R. Prognostic significance of tumor-infiltrating lymphocytes for patients with colorectal cancer[J]. Arch Surg, 2012, 147(4): 366-372.
[3] ALOTAIBI A M, LEE J L, KIM J, et al. Prognostic and oncologic significance of perineural invasion in sporadic colorectal cancer[J]. Ann Surg Oncol, 2017, 24(6): 1626-1634.
[4] CAO Y H, DENG S H, YAN L Z, et al. Perineural invasion is associated with poor prognosis of colorectal cancer: a retrospective cohort study[J]. Int J Colorectal Dis, 2020, 35(6): 1067-1075.
[5] CIENFUEGOS J A, MARTÍNEZ P, BAIXAULI J, et al. Perineural invasion is a major prognostic and predictive factor of response to adjuvant chemotherapy in stage Ⅰ-Ⅱ colon cancer[J]. Ann Surg Oncol, 2017, 24(4): 1077-1084.
[6] DOLL K M, RADEMAKER A, SOSA J A. Practical guide to surgical data sets: surveillance, epidemiology, and end results (SEER) database[J]. JAMA Surg, 2018, 153(6): 588-589.
[7] SKANCKE M , ARNOTT S M , AMDUR R L, et al . Lymphovascular invasion and perineural invasion negatively impact overall survival for stage Ⅱ adenocarcinoma of the colon[J]. Dis Colon Rectum, 2019, 62(2): 181-188.
[8] TU J H, YAO Z X, WU W Q, et al. Perineural invasion is a strong prognostic factor but not a predictive factor of response to adjuvant chemotherapy in node-negative colon cancer[J]. Front Oncol, 2021, 11: 663154.
[9] TU J H, YAO Z X, WU W Q, et al. Perineural invasion is a strong prognostic factor but not a predictive factor of response to adjuvant chemotherapy in node-negative colon cancer[J]. Front Oncol, 2021, 11: 663154.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)