首页 > 医疗资讯/ 正文
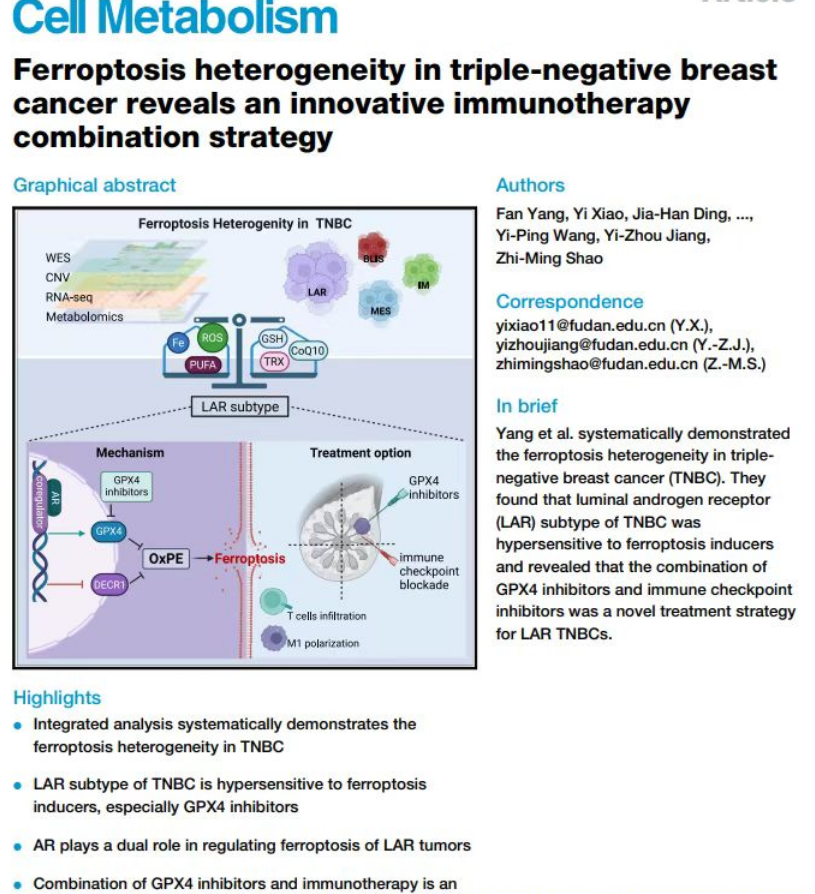
10月17日,《细胞代谢》在线发表复旦大学附属肿瘤医院乳腺外科教授邵志敏、江一舟团队的最新研究。该研究发现,“铁死亡”在三阴性乳腺癌“复旦分型”的其中一个亚型——腔面雄激素受体型(LAR)中表现更为活跃,以“谷胱甘肽过氧化物酶4”(GPX4)为核心的谷胱甘肽代谢在LAR型三阴性乳腺癌“铁死亡”调控中具有重要地位。相关研究成果10月17日在国际代谢顶级期刊《细胞代谢》(Cell Metabolism,期刊影响因子31.4)在线发表。这是该团队近两年来第三次在这本国际顶刊上发表论著。GPX4抑制剂联合免疫治疗可能成为LAR型三阴性乳腺癌的潜在新治疗策略。
代谢-免疫视角探索精准治疗新策略
三阴性乳腺癌是乳腺癌大家族中的一员,相较其他亚型,异质性高、预后差、复发转移风险高,因而成为乳腺癌研究中亟需攻克的顽固“堡垒”。2019年起,邵志敏、江一舟教授领衔团队针对三阴性乳腺癌开展了系列攻关,从“复旦分型”的提出,到FUTURE系列精准治疗临床试验的开展,团队成功将多线治疗无效的晚期三阴性乳腺癌患者的客观缓解率从10%提高到29%,改善了三阴性乳腺癌患者的预后。
然而,“复旦分型”仍需完善。部分三阴性乳腺癌,如LAR分子亚型,对现有的精准治疗策略不太敏感,仍是三阴性乳腺癌中的一个治疗难题。为此,邵志敏、江一舟教授近年来领衔团队从蛋白、代谢、免疫、微生物等多个角度不断深化“复旦分型”,探寻新的治疗靶点,以期待突破部分三阴性乳腺癌亚型的治疗瓶颈。
大样本数据呈现三阴性乳腺癌细胞“铁死亡”特征
“通过前期对三阴性乳腺癌‘复旦分型’的完善,我们已证实代谢和免疫视角下的治疗方案可能对三阴性乳腺癌的精准治疗带来明显获益。”邵志敏教授表示,“铁死亡”是近年发现的与代谢密切相关的调节性细胞死亡方式,在肿瘤研究领域表现活跃,该团队尝试从该角度入手,以发现三阴性乳腺癌治疗新突破口。
细胞“花样死亡”里,“铁死亡”是其一,因这种形式的死亡是由“铁依赖的脂质过氧化”驱动而得名,受到多条代谢通路调节。通过大样本转录组与代谢组数据研究,团队首先系统解析了三阴性乳腺癌的铁死亡特征。
研究发现,“铁死亡”相关的细胞代谢通路和代谢物均在LAR型乳腺癌中高度活跃,提示其可能是对“铁死亡”最敏感的亚型。另一方面,以GPX4为核心的谷胱甘肽代谢在LAR亚型中显著上调,是该亚型肿瘤最主要的逃避“铁死亡”的途径。
研究者通过进一步机制研究发现,雄激素受体(AR)是调控LAR亚型铁死亡的关键因子。然而AR对三阴性乳腺癌“铁死亡”的调控作用是正负双向的,既可以促进GPX4的表达协助肿瘤细胞逃避“铁死亡”,又可以增加“铁死亡”相关的不饱和脂质的合成。这可能部分解释了临床试验中AR受体抑制剂治疗LAR型乳腺癌疗效不佳的原因。
GPX4抑制剂联合免疫治疗或成治疗新靶点
团队进一步利用小鼠模型、类器官模型和回顾性临床试验数据,探索靶向“铁死亡”在LAR亚型中的临床价值。结果发现,GPX4抑制剂不仅可通过促进“铁死亡”抑制肿瘤,还可重塑肿瘤免疫微环境,使LAR亚型肿瘤“冷”转“热”。GPX4抑制剂与免疫治疗联用,可以进一步激活肿瘤微环境中的T细胞,双药治疗的疗效显著高于单药治疗。该结果表明靶向铁死亡与免疫治疗的联用,可能是LAR亚型乳腺癌的精准治疗的新方向。
“本项研究是我们三阴性乳腺癌研究体系的进一步拓展,研究模式也十分新颖”。江一舟教授表示,研究从关键临床问题出发,选择新颖角度,在充分利用多组学数据的基础上,结合扎实的实验论证,最终回归临床治疗。
“聚焦关键临床科学问题,开展真正对病人有用的研究,是邵教授对我们的一贯要求。”肖毅医生说,“作为年轻一辈有幸站在‘巨人的肩膀上’,不断拓展三阴性乳腺癌精准治疗的深度和广度,希望能为更多患者带去好消息。”
原始出处:
https://doi.org/10.1016/j.cmet.2022.09.021
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)