首页 > 医疗资讯/ 正文
[摘要] 激素替代治疗(menopausal hormone therapy,MHT)是缓解绝经后患者更年期症状的有效疗法,妇科恶性肿瘤术后患者使用MHT的安全性和有效性是临床上持续关注的重点问题。本文回顾近5年妇科恶性肿瘤术后MHT的相关临床研究,综合结果表明,早期子宫内膜癌(endometrial cancer,EC)术后行MHT不增加复发风险,且有利于提高生活质量。上皮性卵巢癌(ovarian cancer,OC)患者术后MHT对无病生存期和总生存期无不利影响,但不建议用于卵巢性索间质肿瘤等非上皮性卵巢肿瘤。宫颈鳞状细胞癌术后MHT相对安全,但关于宫颈腺癌、外阴癌、阴道癌患者术后使用MHT的研究较少,目前暂无确切结论。本综述旨在更新对妇科恶性肿瘤术后激素治疗的认识,为临床上合理选择MHT方案提供参考,以进一步提高患者生活质量。
[关键词] 激素替代治疗;妇科恶性肿瘤;子宫内膜癌;卵巢癌;医源性绝经;复发风险
绝经并非指月经的有无,而是指卵巢功能的衰竭,可分为生理性和医源性绝经[1]。医源性绝经是指由于手术或放化疗等治疗手段导致卵巢功能衰竭的现象,在妇科恶性肿瘤患者中较为常见。关于妇科恶性肿瘤术后患者的生活质量问卷显示,近90%的患者会出现泌尿生殖道症状(genitourinary syndrome,GSM)[2],但自然绝经者仅有40%~57%的患者会出现GSM[3-4]。卵巢癌(ovarian cancer,OC)术后患者出现血管舒缩症状(vasomotor symptoms,VMS)的概率是自然绝经女性的1.7倍,出现头痛症状是自然绝经女性的3.0倍[5],提示医源性绝经症状远比生理性绝经更加严重,而且对年轻患者的心理也会产生更大的负面影响。
激素替代治疗(menopausal hormone therapy,MHT)用于缓解更年期症状的疗效已得到公认[6],但考虑到MHT有导致激素依赖性肿瘤发生或复发的风险,妇科恶性肿瘤患者术后是否可以进行MHT仍然存在争议。已有研究[7]表明,自然绝经女性每天使用0.625 mg妊马雌酮(conjugated equine estrogen,CEE)和2.5 mg醋酸甲羟孕酮(medroxyprogesterone acetate,MPA)会增加患乳腺癌的风险,治疗组的风险是对照组的1.3倍。有研究[8]显示,35.9%的更年期女性在接受MHT治疗1年后,由于担心乳腺癌和子宫内膜癌(endometrial cancer,EC)的风险而放弃治疗。另有研究[9]发现,雌激素会促进雌激素受体阳性的胃癌细胞系生长,提示雌激素可能会刺激术后残留的肿瘤组织生长从而引起复发。
因此,临床上对于妇科恶性肿瘤患者医源性绝经后出现更年期症状的处理,目前仍是一个棘手的问题,处理意见仍不统一。本综述回顾了近5年妇科恶性肿瘤患者术后进行MHT的研究进展,尤其针对MHT的肿瘤风险进行重点讨论,旨在明确此类患者接受MHT的安全性和有效性,为临床提供参考。
1、妇科恶性肿瘤术后MHT的肿瘤复发风险
1.1 EC术后MHT的肿瘤复发风险
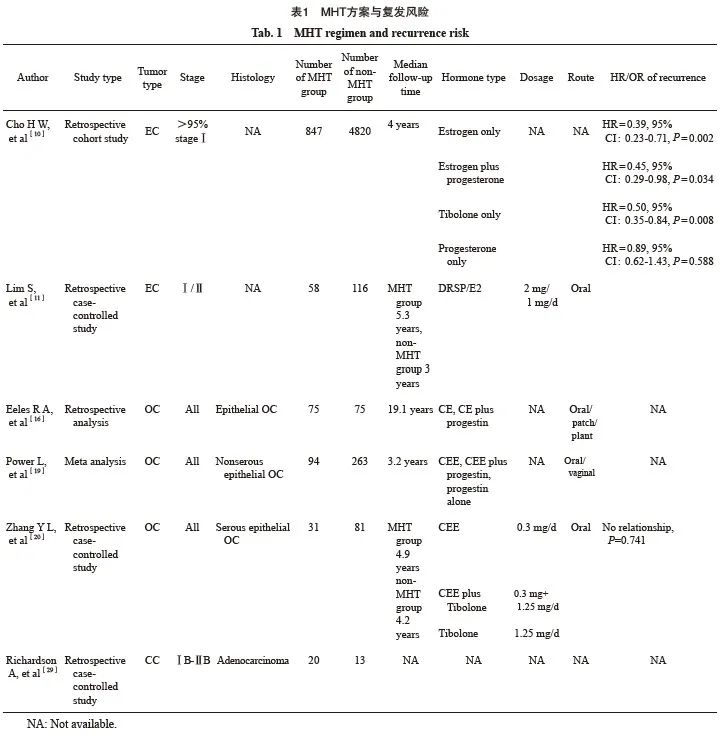
近年来,多项研究证实早期(Ⅰ/Ⅱ期) EC患者术后使用小剂量的MHT不增加复发风险。Cho等[10]对5 667例EC患者(95%为Ⅰ期患者)进行约47.5个月的随访发现,在847例(14.9%)接受激素治疗(包括替勃龙、单纯黄体酮、单纯雌激素和雌激素加黄体酮)的患者中有50例(5.9%)复发,未接受MHT的4 820例患者中有396例(8.2%)复发,单因素分析显示,MHT不增加复发风险(HR=0.62,95% CI:0.46~0.83,P=0.001),多因素分析得到了相同结论(HR=0.81,95% CI:0.31~2.10,P=0.662)。年龄大于50岁和(或)高危型(经历过化疗)EC患者的复发率较高,单因素分析结果显示,年龄大于50岁(HR=2.05,95% CI:1.62~2.63)、高危型EC(HR=24.51,95% CI:18.63~32.35)均是EC复发的危险因素,激素的使用、激素种类并未升高复发率,但孕激素无保护作用。Lim等[11]回顾性分析了MHT对Ⅰ/Ⅱ期EC患者术后更年期症状的影响,58例患者在术后8周内开始每天口服2 mg屈螺酮(drospirenone,DRSP)/1 mg雌二醇(estradiol,E2),中位随访时间64个月,116例患者未接受激素治疗,中位随访时间35个月,结果显示,每天小剂量MHT(2 mg DRSP/1 mg E2)可缓解EC患者术后的更年期症状,且不增加Ⅰ/Ⅱ期EC患者的复发率和死亡率。Di Donato等[12]的meta分析发现,早期EC患者术后MHT对患者生存的益处多于负面影响,评估标准包括无病生存期(disease-free survival,DFS)及总生存期(overall survival,OS)等。另一项有关EC患者术后MHT的meta分析[13]认为,早期EC患者术后MHT没有明显危害,晚期EC患者使用MHT的安全性较低,但其证据等级不高。因此我们认为,早期EC患者术后使用MHT可有效地缓解更年期症状且相对安全。晚期EC患者术后MHT的潜在复发风险较高,MHT收益小于风险,基于现有证据不推荐晚期EC术后患者使用MHT。
1.2 OC术后MHT的肿瘤复发风险
近年来研究发现,OC术后MHT的安全性高度依赖于肿瘤组织的病理学类型。上皮性OC占OC的90%以上,主要包括高、低级别浆液性癌、子宫内膜样癌、黏液性癌和透明细胞癌[14],其中浆液性癌占上皮性OC的80%左右,黏液性癌、子宫内膜样癌及透明细胞癌占上皮性OC的20%~25%[15]。Eeles等[16]进行的临床对照研究将来自不同国家、19个中心的150例上皮性OC患者平均分配到MHT组和非MHT组,研究中涉及到的激素包括共轭雌激素(conjugated estrogens,CE)、CE加孕激素(诺孕酮)、E2贴片和植入E2,中位随访时间19.1年,结果显示,MHT组中53例(71%)死亡,非MHT组中68例(91%)死亡,接受MHT者OS延长(HR=0.63,95% CI:0.44~0.90,P=0.011),且DFS长于对照组(HR=0.67,95% CI:0.47~0.97,P=0.032)。但该研究并没有对上皮性OC的病理学类型进行具体分类,也没有描述分期情况,对临床工作的指导存在一定的局限性。Cochrane数据库的meta分析[17]纳入了三项有关OC术后MHT的研究,包括Ⅰ~Ⅲ期共370例患者,MHT方案包括单独使用雌激素、雌激素与孕激素联合使用、单独使用替勃龙等,评估项目包括OS、术后生活质量及DFS等,结果显示,术后MHT略延长上皮性OC术后的OS,但其证据等级较低。另一项meta分析[18]纳入1 448例上皮性OC术后患者,使用的激素包括雌激素、孕激素、替勃龙等,结果显示,MHT不升高复发率(RR=0.83,95% CI:0.64~1.07)。一项针对非浆液性上皮性OC(包括子宫内膜样OC、透明细胞癌等)的回顾性队列研究[19]纳入了1995—2010年接受治疗的患者(包括接受手术或放化疗),平均年龄为57.8岁,94例患者接受MHT,其中76%的患者口服合成雌激素,7%接受阴道雌激素或阴道雌激素结合口服雌激素,大部分患者的雌激素使用剂量为0.625 mg/d,中位随访时间3.18年,结果表明,55岁以下患者使用MHT可以延长OS(HR=0.305,95% CI:0.11~0.83,P=0.021)。一项针对中国浆液性上皮性OC术后患者的回顾性研究[20]发现,在不同期别(Ⅰ、Ⅱ、Ⅲ期)、不同分化程度的患者中,不同的MHT方案不会影响OC术后患者的DFS,也不会影响复发率,共纳入112例患者,MHT组患者的中位年龄为33.5岁,对照组为31.2岁,MHT方案包括CEE 0.3 mg/d、0.3 mg雌激素加替勃龙1.25 mg/d或单用替勃龙1.25 mg/d。总体而言,目前数据显示,上皮性OC年轻患者(小于55岁)术后进行MHT相对安全可行,术后MHT可以延长患者的DFS,且不增加疾病复发率。
非上皮性卵巢肿瘤约占卵巢肿瘤的10%[21],卵巢性索间质肿瘤本质上是激素依赖性的,虽然没有直接证据证明MHT对颗粒细胞瘤幸存者的长期影响,但考虑到这些肿瘤的激素-内分泌活性特征,有学者主张应避免使用 MHT[22-23]。欧洲更年期协会指南[24]同样不推荐对该人群使用MHT,而是建议采取个体化的治疗方法。随着有效联合化疗方案的应用,有生育要求的生殖细胞来源的OC患者,无论期别,均可选择保留生育功能的手术方式,因此出现医源性绝经症状的情况相对较少,MHT数据相对较少。
1.3 宫颈癌(cervical cancer,CC)术后MHT的肿瘤复发风险
宫颈鳞状上皮癌占CC的80%~90%[25],现有的研究数据尚未发现使用激素会导致宫颈鳞状细胞癌复发风险升高[26]。宫颈腺癌占CC的10%~20%,其生物学特性类似于EC[25],有研究[27-28]已经证明,宫颈中存在雌激素和孕激素受体,并在约1/3的宫颈腺癌中呈高表达,这部分受体阳性的患者术后使用MHT的安全性是否同EC患者的情况一致,目前尚无明确研究数据。 Richardson等[29]对2000年11月—2019年9月诊断为ⅠB~ⅡB期宫颈腺癌的所有50岁以下女性患者进行了回顾性分析,将58例女性患者分为卵巢保存组(OVCON)、医源性更年期无MHT组和医源性更年期给予MHT组,分析发现MHT有益于CC中未保留卵巢的患者,与医源性更年期无MHT组相比,MHT组中女性患者的5年疾病特异性生存率为95%,而缺乏激素的女性患者仅为73%(P=0.039),即MHT略升高了宫颈腺癌患者的生存率,但该研究并没有常规记录激素的种类、剂量、使用持续时间等,且纳入的患者较少,还需要更大样本的研究来证实这一观点。
1.4 外阴癌、阴道癌术后患者MHT的肿瘤复发风险
其他妇科恶性肿瘤如阴道癌、外阴癌的发病率低,与其相关的危险因素的研究较少。既往关于上皮性癌症(如宫颈鳞状上皮癌等)的研究发现,上皮性细胞对雌激素不敏感[22],阴道癌主要的组织学类型也是上皮性[30],针对小鼠的研究发现,雌激素对鳞状细胞肿瘤的生长具有抑制作用[30],提示MHT可能不增加阴道癌、外阴癌复发的风险(表1)。
2、妇科恶性肿瘤术后MHT的注意事项
2.1 MHT的起始时机和治疗时长
针对生理性绝经女性,Stute等[32]进行的meta分析显示,生理性绝经后早期开始MHT有显著的益处。目前有关妇科肿瘤术后行MHT的相关研究[10-11,21]中,MHT的启动时机并不相同,子宫内膜肿瘤术后患者一般在术后2~12个月开始使用,卵巢肿瘤术后患者一般根据患者年龄决定。目前未见针对不同起始时机的对比性研究,临床上一般需要根据患者情况来确认开始使用激素的时机,因此无法给出统一建议。
关于激素使用的时限,现有研究推荐持续使用MHT到正常绝经年龄。关于非浆液性上皮性OC术后患者MHT的研究[19]发现,55岁以下患者术后使用激素超过12个月能够明显延长OS(HR=0.365,95% CI:0.11~0.83,P=0.021)和DFS(HR=0.242,95% CI:0.09~0.65,P=0.05)。对宫颈肿瘤患者的研究[29]发现,过早绝经的女性应在自然绝经年龄(50岁左右)之前使用MHT,防止长期雌激素缺乏引起不良后果。过早绝经的女性在无禁忌证的前提下应当进行MHT直到自然绝经年龄[33]。医源性绝经患者在接受评估后尽早使用MHT并持续至自然绝经年龄效果较好,但应用时长需结合患者情况而定。
2.2 MHT方案建议
2.2.1 MHT的剂量
关于生理性绝经女性MHT的研究[34]提示较小剂量的激素即可起到补充作用,且引起肿瘤复发、静脉血栓栓塞(venous thromboembolism,VTE)等的概率相对较低。既往针对EC术后患者的研究[11]显示,术后患者每天口服2 mg DRSP/1 mg E2不会升高EC的复发率。既往关于OC术后患者MHT的研究[17,19-20]中,激素的使用剂量也较小,雌激素使用量为0.300~0.625 mg/ d,替勃龙的使用量为1.25 mg/d。因此,我们认为在妇科恶性肿瘤术后患者中,激素使用剂量的考量原则与生理性绝经女性相同,即推荐小剂量补充。
2.2.2 MHT的种类
生理性绝经女性进行MHT时会有EC风险的担忧,在补充激素时会选择添加孕激素来保护子宫内膜,以拮抗雌激素对子宫内膜恶性增殖的促进作用,较常用的MHT方案为0.625 mg CEE+2.5 mg MPA[32-33,35],但妇科恶性肿瘤患者子宫切除术后可选择单独使用雌激素[35]。针对生理性绝经后卵巢肿瘤发生风险的研究[36]发现,雌激素和孕激素联合使用会升高卵巢肿瘤的发生风险(OR=1.48,95% CI:1.00~2.21),而单用雌激素不增加卵巢肿瘤的发生风险(OR=0.25,95% CI:0.22~0.29)。
乳腺癌的发生风险也与激素种类密切相关。一项大样本研究[7]共纳入27 347例子宫切除的女性患者,发现E-MHT(0.625 mg CEE/d)不增加乳腺癌的发生风险(HR=0.78,95% CI:0.65~0.93,P=0.005),而EP-MHT(0.625 mg CEE+2.5 mg MPA/d)增加乳腺癌风险(HR=1.28,95% CI:1.13~1.45,P<0.001)。另有巢式病例对照研究[37]显示,与单独使用雌激素或单独使用替勃龙相比,雌激素和孕激素联合使用10年及以上会明显增加乳腺癌的发生风险(OR=2.05,95% CI:1.94~2.17),孕激素如甲羟孕酮(OR=1.87)、左炔诺孕酮(OR=1.79)、炔诺酮(OR=1.88)等使用时间超过5年,乳腺癌的发生风险升高约2倍。 Kotsopoulos等[38]对BRCA基因突变携带者使用MHT后的乳腺癌风险进行了前瞻性纵向队列研究,来自17个国家、80个中心的872例BRCA1基因突变携带者均接受了卵巢切除术,术后随访约7.6年,发现MHT与乳腺癌的发生风险增加无关(HR=0.97,95% CI:0.62~1.52,P=0.89),但单独使用雌激素的患者乳腺癌累积发病率为12%,使用雌激素和孕激素联合替代疗法患者的乳腺癌累积发病率为22%。这与Marchetti等[39]的研究结论相似,预防性切除输卵管和卵巢后MHT不增加乳腺癌的发生风险,单独使用雌激素引发乳腺癌的发生风险略低于雌激素与孕激素联合使用(OR=0.53,95% CI:0.25~1.15)。
上述研究提示,对妇科恶性肿瘤术后患者单独使用雌激素不增加肿瘤的发生风险,但使用孕激素需要谨慎。
2.2.3 MHT的使用途径
MHT使用途径分为口服和经皮肤用药。经皮给药避免了首过代谢和口服制剂胃肠道吸收的问题,需要的激素剂量较小。一项巢式病例对照研究[40]显示,与口服雌激素相比,经皮肤使用雌激素的VTE风险更低。一项由美国国家癌症研究所(National Cancer Institute,NCI)赞助的大规模随机临床试验[41]表明,与口服激素(HR=2.23,95% CI:1.53-3.26)相比,经皮肤使用激素引发EC的风险更低(HR=1.59,95% CI:1.02~2.48)。一项关于瑞典女性MHT的对照研究[36]发现,口服雌激素和孕激素引发OC的风险最高(OR=1.48,95% CI:1.25~1.75),而绝经后女性局部使用雌激素不会升高乳腺癌、 EC风险[42]。因此,我们认为经皮肤局部使用雌激素是有效且安全性更高的选择。
2.2.4 MHT的使用年龄
针对EC患者术后MHT的研究[10]显示,年龄大于55岁是引起EC复发的危险因素之一。关于上皮性OC患者术后MHT的研究[19]发现,55岁以下患者使用MHT可以延长OS(HR=0.305,95% CI:0.11~0.83,P=0.021)。针对宫颈腺癌术后患者的研究[29]发现,MHT略微升高了50岁以下患者的生存率。以上数据提示妇科恶性肿瘤年轻患者术后使用MHT比年长者更适合。但上述结论可能有一定偏倚,如年轻患者发现肿瘤时处于较早期,预后本就好于老年患者。目前大多数临床试验针对的群体是较年轻的患者,因此还需要更多相关的临床研究来证实这一观点。
2.2.5 MHT不良反应的处理
在大多数针对妇科肿瘤术后患者使用激素的研究中,MHT出现不良后果或疑似出现不良趋势时,会立即停止临床试验[10,20]。因此如果临床用药过程中出现不良后果,如肿瘤复发、乳腺增生或深静脉血栓形成等情况应及时停药。如果患者的症状难以忍受,必须使用医学手段缓解,可以改用非激素治疗方法。
2.2.6 妇科恶性肿瘤患者术后MHT的随访建议
妇科恶性肿瘤术后患者是一个特殊群体, MHT过程中不仅需考虑激素使用的相关风险如VTE、卒中等,也要注重肿瘤复发风险。因此,妇科恶性肿瘤患者术后使用MHT的随访内容和频率应根据不同恶性肿瘤类型,结合生理性绝经MHT的诊治指南和专家共识的建议,以及随访情况而定。
3、总结和展望
妇科恶性肿瘤年轻患者术后出现的更年期症状迅猛、严重,对患者的生理和心理均造成极大打击,MHT是缓解症状的有效手段。既往对于妇科恶性肿瘤患者术后MHT的安全性没有统一观点,临床用药决策较难,目前仍需要开展大样本、高质量临床研究,包括对不同方案(如激素种类、剂量、给药途径、起止时间等)的对比评估,以便为临床用药提供更加可靠的依据。
[参考文献]
[1] XIE M Q, CHEN R, REN M L. Chinese guidelines for menopausal management and menopausal hormone therapy (2018) [J]. Chin J Obstet Gynecol, 2018, 9(06): 512-25.
[2] STABILE C, GOLDFARB S, BASER R E, et al. Sexual health needs and educational intervention preferences for women with cancer[J]. Breast Cancer Res Treat, 2017, 165(1): 77-84.
[3] KAGAN R S, KELLOGG-SPADT S, PARISH S J. Practical treatment considerations in the management of genitourinary syndrome of menopause[J]. Drugs Aging, 2019, 36(10): 897-908.
[4] KOZMA B, PÓKA R, SIPOS A, et al. Short-term efficacy of vaginal CO2 laser therapy as a treatment modality for genitourinary syndrome of menopause[J]. Orv Hetil, 2019, 160(41): 1617-1622.
[5] GERNIER F, GOMPEL A, ROUSSET-JABLONSKI C, et al. Menopausal symptoms in epithelial ovarian cancer survivors: a GINECO VIVROVAIRE2 study[J]. Gynecol Oncol, 2021, 163(3): 598-604.
[6] MCNEIL M. Menopausal hormone therapy: understanding longterm risks and benefits[J]. JAMA, 2017, 318(10): 911-913.
[7] CHLEBOWSKI R T, ANDERSON G L, ARAGAKI A K, et al. Association of menopausal hormone therapy with breast cancer incidence and mortality during long-term follow-up of the women’s health initiative randomized clinical trials[J]. JAMA, 2020, 324(4): 369-380.
[8] CHU K, SONG Y, CHATOOAH N D, et al. The use and discontinuation of hormone replacement therapy in women in South China[J]. Climacteric, 2018, 21(1): 47-52.
[9] WANG X M, CHEN Q Y, HUANG X, et al. Effects of 17β-estradiol and tamoxifen on gastric cancer cell proliferation and apoptosis and ER-α36 expression[J]. Oncol Lett, 2017, 13(1): 57-62.
[10] CHO H W, CHO H W, OUH Y T, et al. Effects of hormone therapy on recurrence in endometrial cancer survivors: a nationwide study using the Korean Health Insurance Review
and Assessment Service database[J]. J Gynecol Oncol, 2019, 30(4): e51.
[11] LIM S, KIM Y H, LEE K B, et al. The influence of hormone therapy with drospirenone-estradiol on endometrioid type endometrial cancer patients[J]. J Gynecol Oncol, 2018, 29(5): e72.
[12] DI DONATO V, PALAIA I, D’ANIELLO D, et al. Does hormone replacement therapy impact the prognosis in endometrial cancer survivors? A systematic review[J]. Oncology, 2020, 98(4): 195-201.
[13] EDEY K A, RUNDLE S, HICKEY M. Hormone replacement therapy for women previously treated for endometrial cancer[J]. Cochrane Database Syst Rev, 2018, 5: CD008830.
[14] BRENNAN A, BRENNAN D, REES M, et al. Management of menopausal symptoms and ovarian function preservation in women with gynecological cancer[J]. Int J Gynecol Cancer, 2021, 31(3): 352-359.
[15] Committee of Psoriasis, Dermatology Branch, Chinese Medical Association. Guidelines for the diagnosis and treatment of psoriasis in China: 2019 concise edition #[J]. Int J Dermatol Venereol, 2020, 3(1): 14-26.
[16] EELES R A, MORDEN J P, GORE M, et al. Adjuvant hormone therapy may improve survival in epithelial ovarian cancer: results of the AHT randomized trial[J]. J Clin Oncol, 2015,33(35): 4138-4144.
[17] SAEAIB N, PEEYANANJARASSRI K, LIABSUETRAKUL T, et al. Hormone replacement therapy after surgery for epithelial ovarian cancer[J]. Cochrane Database Syst Rev, 2020, 1: CD012559.
[18] LI D, DING C Y, QIU L H. Postoperative hormone replacement therapy for epithelial ovarian cancer patients: a systematic review and meta-analysis[J]. Gynecol Oncol, 2015, 139(2):355-362.
[19] POWER L, LEFAS G, LAMBERT P, et al. Hormone use after nonserous epithelial ovarian cancer: overall and disease-free survival[J]. Obstet Gynecol, 2016, 127(5): 837-847.
[20] ZHANG Y L, CHEN J H, LU W, et al. Efficacy of postoperative hormone replacement therapy on prognosis of patients with serous ovarian carcinoma[J]. Chin Med J (Engl), 2016,129(11): 1316-1321.
[21] RAY-COQUARD I, MORICE P, LORUSSO D, et al. Nonepithelial ovarian cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018,29(Suppl 4): iv1-iv18.
[22] DELI T, OROSZ M, JAKAB A. Hormone replacement therapy in cancer survivors-review of the literature[J]. Pathol Oncol Res, 2020, 26(1): 63-78.
[23] DEL CARMEN M G, RICE L W. Management of menopausal symptoms in women with gynecologic cancers[J]. Gynecol Oncol, 2017, 146(2): 427-435.
[24] REES M, ANGIOLI R, COLEMAN R L, et al. European Menopause and Andropause Society (EMAS) and International Gynecologic Cancer Society (IGCS) position statement on managing the menopause after gynecological cancer: focus on menopausal symptoms and osteoporosis[J]. Maturitas, 2020, 134: 56-61.
[25] ANGIOLI R, LUVERO D, ARMENTO G, et al. Hormone replacement therapy in cancer survivors: utopia? [J]. Crit Rev Oncol Hematol, 2018, 124: 51-60.
[26] VARGIU V, AMAR I D, ROSATI A, et al. Hormone replacement therapy and cervical cancer: a systematic review of the literature[J]. Climacteric, 2021, 24(2): 120-127.
[27] WANG J C M, BERNARD L, BOUTROSS-TADROSS O, et al. Estrogen receptor-positive adenocarcinoma of the cervix presenting during pregnancy: two case reports and review of the literature[J]. Gynecol Oncol Rep, 2022, 39: 100916.
[28] LEE S A, BAIK S, CHUNG S H. Functional roles of female sex hormones and their nuclear receptors in cervical cancer[J]. Essays Biochem, 2021, 65(6): 941-950.
[29] RICHARDSON A, WATSON L, PERSIC M, et al. Safety of hormone replacement therapy in women with a history of cervical adenocarcinoma[J]. Post Reprod Health, 2021,27(3): 167-173.
[30] ADAMS T S, ROGERS L J, CUELLO M A. Cancer of the vagina: 2021 update[J]. Int J Gynaecol Obstet, 2021, 155(Suppl 1): 19-27.
[31] BUCCHI L, PIZZATO M, ROSSO S, et al. New insights into the epidemiology of vulvar cancer: systematic literature review for an update of incidence and risk factors[J]. Cancers (Basel), 2022, 14(2): 389.
[32] STUTE P, STADLER A, HEUFELDER A. The impact of menopausal hormone therapy on overall mortality-a comprehensive review[J]. Climacteric, 2020, 23(5): 447-459.
[33] PINKERTON J V. Hormone therapy for postmenopausal women[J]. N Engl J Med, 2020, 382(5): 446-455.
[34] BABER R J, PANAY N, FENTON A, et al. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy[J]. Climacteric, 2016, 19(2): 109-150.
[35] US PREVENTIVE SERVICES TASK FORCE, GROSSMAN D C, CURRY S J, et al. Hormone therapy for the primary prevention of chronic conditions in postmenopausal women: US preventive services task force recommendation statement[J]. JAMA, 2017, 318(22): 2224-2233.
[36] SIMIN J, TAMIMI R M, CALLENS S, et al. Menopausal hormone therapy treatment options and ovarian cancer risk: a Swedish prospective population-based matched-cohort study[J]. Int J Cancer, 2020, 147(1): 33-44.
[37] VINOGRADOVA Y, COUPLAND C, HIPPISLEY-COX J. Use of hormone replacement therapy and risk of breast cancer: nested case-control studies using the QResearch and CPRD databases[J]. BMJ, 2020, 371: m3873.
[38] KOTSOPOULOS J, GRONWALD J, KARLAN B Y, et al. Hormone replacement therapy after oophorectomy and breast cancer risk among BRCA1 mutation carriers[J]. JAMA Oncol, 2018, 4(8): 1059-1065.
[39] MARCHETTI C, DE FELICE F, BOCCIA S, et al. Hormone replacement therapy after prophylactic risk-reducing salpingooophorectomy and breast cancer risk in BRCA1 and BRCA2 mutation carriers: a meta-analysis[J]. Crit Rev Oncol Hematol, 2018, 132: 111-115.
[40] VINOGRADOVA Y, COUPLAND C, HIPPISLEY-COX J. Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases[J]. BMJ, 2019, 364: k4810.
[41] LIANG Y, JIAO H Y, QU L B, et al. Association between hormone replacement therapy and development of endometrial cancer: results from a prospective US cohort study[J]. Front Med (Lausanne), 2021, 8: 802959.
[42] CRANDALL C J, HOVEY K M, ANDREWS C A, et al. Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women’s Health Initiative Observational Study[J]. Menopause, 2018, 25(1): 11-20.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)