首页 > 医疗资讯/ 正文
皮肤B细胞淋巴瘤
原发性皮肤淋巴瘤是一组异质性结外非霍奇金淋巴瘤,其中约25%来源于 B 细胞,在2018年WHO- EORTC联合分类和国际共识分类 (ICC) 中分为3个亚型:原发性皮肤滤泡中心淋巴瘤 (PCFCL)、原发性皮肤弥漫大B细胞淋巴瘤,腿型 (PCDLBCL,LT) 和原发性皮肤边缘区淋巴瘤 (PCMZL)。此外EBV阳性皮肤粘膜溃疡 (EBVMCU) 是一种最近描述的累及皮肤和粘膜的EBV+淋巴增生性疾病。
皮肤B细胞淋巴瘤 (CBCL) 的发病率一直在增加,根据SEER登记数据,目前约为每百万人4例,在男性、非西班牙裔白人和50岁以上成人中发病率最高。
近日《American Journal of Hematology》发表一篇综述,阐述了皮肤B细胞淋巴瘤3个亚型的诊断、风险分层和治疗。

诊断
CBCL的诊断和分类需要切开、切除或 4-6 mm 钻取活检,包括网状真皮和皮下脂肪,用于形态学和免疫组织化学分析(表1),并进行适当的分期评估以排除全身性疾病。使用适当的免疫组织化学染色(例如CD5、细胞周期蛋白D1)也有助于区分CBCL与系统性淋巴瘤继发性累及皮肤。
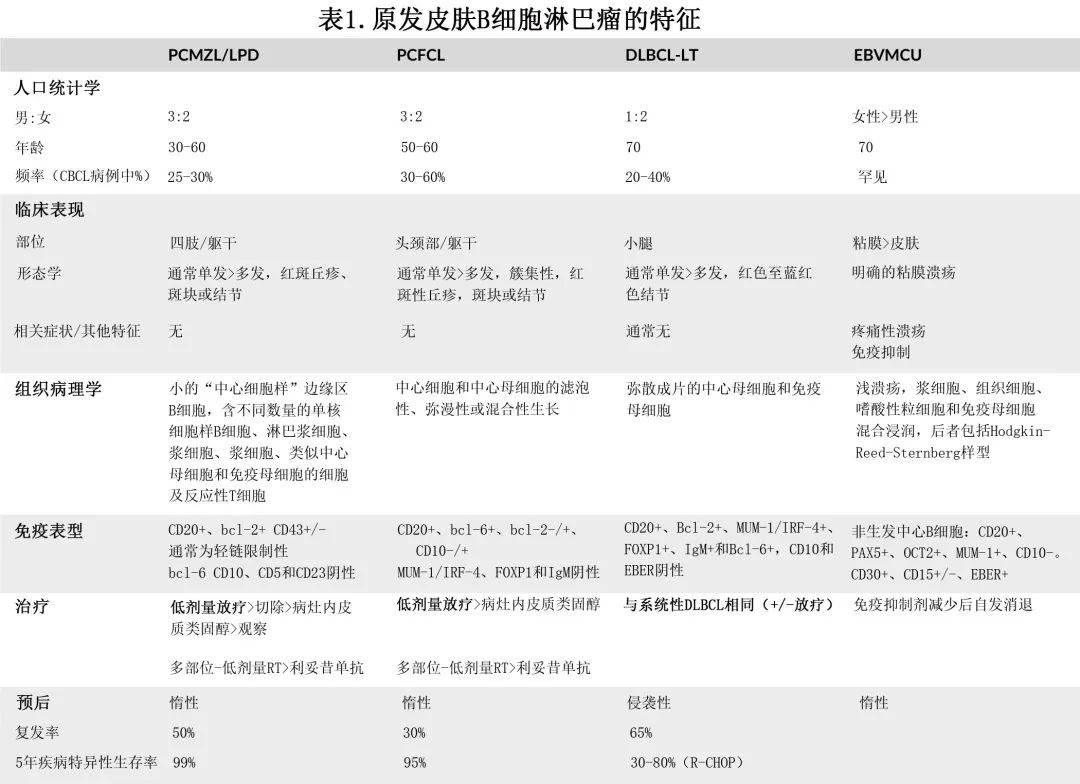
PCFCL
PCFCL多表现为孤立的紫色至粉红色丘疹(通常进行活检以排除非黑色素瘤皮肤癌)或见于中年人的前额、颈部和上背部出现多发性丘疹、斑块或肿瘤伴外周红斑边缘。虽然可观察到成组病变,但多灶性疾病不常见,包括鼻赘和瘢痕性脱发伴粉红色肿胀斑块也较少见。皮肤镜有助于区分皮肤淋巴瘤和更常见的非黑色素瘤皮肤癌。
组织病理学上,PCFCL的特征为滤泡性、弥漫性或混合生长模式,包括大中心细胞和来源于生发中心 B 细胞的可变中心母细胞。与系统性滤泡性淋巴瘤相反,大多数 PCFCL 不携带涉及 bcl-2 位点的t(14;18) 易位,免疫组化不强表达bcl-2,但少数病例中可能观察到表达。bcl-2 和 CD10强表达可能提示滤泡性淋巴瘤继发皮肤受累。PCFCL可表达bcl-6,不同程度表达CD10,且为MUM-1/IRF-4、FOXP1和 IgM 阴性,与其来源于生发中心 B 细胞一致。Zhou 等人在PCFCL(n=30) 和伴继发性皮肤受累的系统性FL(n=10) 中进行全外显子测序,与既往报道一致,大多数(73%)PCFCL不表达bcl-2,与继发性皮肤 FL 相比,通过 Ki67 表达测定,显示增殖更强。
值得注意的是,表观遗传修饰因子CREBBP、KMT2D、EZH2或 EP300 的复发性突变在继发性皮肤 FL 中常见,但在 PCFCL 中罕见。因此,在63%的继发性皮肤 FL 病例中可观察到至少两个基因的突变,但在 PCFCL 中很少观察到。与之相反,TNFRSF14在 PCFCL 中经常发生突变。因此,基因图谱可能有助于区分 PCFCL 和继发性皮肤FL。最近描述了一种涉及女性下生殖道(子宫颈和/或阴道)的新变种,与 PCFCL 具有相同的免疫表型(例如>80%为Bcl-2阴性)、遗传(例如未发现CREBBP、KMT2D突变)和临床特征(局部病变,5年总生存率为100%)。
PCDLBCL, LT
PCDLBCL,腿型多累及老年女性,表现为累及一侧或双侧小腿的快速进展的红棕色至蓝色肿瘤。肿瘤可破溃,较大的肿瘤周围可有较小的卫星灶;较少见的表现包括疣状和多色结节。基于人群的研究表明,仅限于腿部的受累不如“腿型”这一名称常见,因为其他皮肤部位的受累相当常见。这些淋巴瘤的特征为弥漫性成片的中心母细胞和免疫母细胞,保留表皮,但常延伸到真皮和皮下组织深处。
与 PCFCL 相反,淋巴瘤细胞高表达bcl-2,可能是由于基因扩增,因为在 PCDLBCL 中未观察到t(14;18)。与之相比,bcl-2过表达或 bcl-2 和 c-myc 双表达与总生存期较差相关。<20%的PCDLBCL,LT中存在 C-myc 和 bcl-2 易位(“双打击”)。大多数病例为MUM-1/IRF-4、FOXP1、IgM和 bcl-6 阳性、CD10阴性,基因表达谱类似于活化的 B 细胞。EBV 原位杂交 (EBER) 为阴性。也许并不奇怪, PCDLBCL,LT的遗传图谱与活化 B 细胞型弥漫性大 B 细胞淋巴瘤 (ABC-DLBCL)相似,在CD79B、CARD11和 MYD88 中存在NF-κB活化突变。其中体细胞 MYD88 L265P 突变似乎最常见,约为75%。疾病发病机制中存在超抗原依赖性 B 细胞受体信号传导。
PCMZL/LPD
PCMZL/LPD 患者常表现为躯干、手臂和头颈部区域的孤立性无症状粉红色丘疹,或累及躯干和手臂的红棕色多灶性丘疹、斑块或结节。虽然在欧洲观察到与伯氏疏螺旋体(Borrelia burgdorferi)存在相关性,但在美国病例中未观察到类似相关性。PCMZL/LPD 由不同程度的小“中心细胞样”边缘区 B 细胞、单核细胞样 B 细胞、淋巴浆细胞、浆细胞、浆细胞、类似中心母细胞和免疫母细胞的细胞以及反应性 T 细胞混合浸润组成。
边缘区 B 细胞特征性表达bcl-2,可表达CD43,但缺乏bcl-6、CD10、CD5和 CD23 表达。最近鉴别出两组PCMZL/LPD。大多数 PCMZL/LPD 表达类别转换的免疫球蛋白,并具有惰性病程。最近的分类系统建议,应将此类 PCMZL 视为淋巴增生性疾病 (LPD),以反映其与非典型反应性 B 细胞浸润(假 B 细胞淋巴瘤)的临床和组织病理学重叠以及极佳预后。该组的特征是 B 细胞与外周浆细胞、许多混合 T 细胞和反应性滤泡聚集。另一组组表达IgM,表现出与皮肤结外边缘区淋巴瘤相似的行为,频繁复发和皮肤外扩散。该组通常显示弥漫性浸润伴混合而非外周浆细胞和频繁的滤泡定植,更可能累及皮下组织。PCMZL/LPD 通常携带FAS、SLAMF1、SPEN和 NCOR 突变以及涉及 FOXP1 和 BCL10 的 IGH 易位。
EBVMCU
EBVMCU多表现为皮肤或粘膜(包括口咽、生殖器粘膜或胃肠道)上孤立、疼痛和轮廓清楚的溃疡。患者常由于年龄相关的免疫衰老、医源性免疫抑制(尤其是甲氨蝶呤)、实体器官移植、HIV或原发性免疫缺陷而免疫抑制。患者无其他症状,无骨髓受累、淋巴结肿大或肝脾肿大,外周血中 EBV 不增加。
组织病理学上,EBVMCU显示浅溃疡伴基础混合浸润,包括大量浆细胞、组织细胞和嗜酸性粒细胞以及由大量CD8+ T细胞组成的基质。散在分布,有大小不等的 B 细胞免疫母细胞,部分呈 Hodgkin-Reed-Sternberg样(HRS样) 外观。也可出现凋亡的浆细胞样细胞。免疫组织化学研究表明,免疫母细胞是表达CD20、PAX5、OCT2和 MUM-1 的非生发中心 B 细胞,且为CD10阴性;为CD30 阳性,可表达CD15。浆细胞可能为轻链限制性。EBV 原位杂交 (EBER) 标记免疫母细胞,包括 HRS 样细胞以及较小的淋巴样细胞。常出现血管浸润和坏死。B 细胞受体基因重排检测显示不到一半的病例为克隆性 B 细胞群;T细胞受体基因重排研究为寡克隆性或克隆性。
风险分层
国际皮肤淋巴瘤协会 (ISCL) 和 EORTC 最近提出了蕈样肉芽肿和 Sezary 综合征以外的皮肤淋巴瘤的分期建议,分期应包括病史、体格检查和胸部、腹部、骨盆和颈部(累及头部或颈部的病例)影像学(CT、PET或越来越多的PET/CT)。PCDLBCL,LT应进行骨髓活检和穿刺。在 PCFCL 或 PCMZL 病例中,ISCL/EORTC联合分期不支持常规骨髓检查,尽管约10%的滤泡中心淋巴瘤患者有骨髓受累,且在大多数患者中骨髓是皮肤外疾病的唯一部位。骨髓受累与疾病特异性生存率显著降低相关。
虽然 TNM 分期可分类描述疾病的程度,但在 CBCL 中该分期的预后价值有限,因为疾病组织病理学是风险分层的主要决定因素。一项基于人群的研究强调,组织病理学和皮肤受累部位为重要的预后因素,而国际结外淋巴瘤研究组在 PCFCL 和 PCMZL 患者中确定了3个独立的预后因素(即 LDH 升高、>2处皮肤病变和结节性病变)。将这些因素结合起来形成了皮肤淋巴瘤国际预后指数 (CLIPI)。无任何不良预后因素的5年无进展生存率为91%,而存在2-3个不良预后因素的5年无进展生存率为48%。由于绝大多数复发局限于皮肤,CLIPI无法根据总生存期对患者进行风险分层。在欧洲系列研究中,多发性皮肤病变与较差的无病生存期相关,但在北美大型系列研究中与无病生存期无关。
皮肤 B 细胞淋巴瘤风险分层的最重要因素仍是组织病理学分类。惰性CBCL(PCFCL和PCMZL)的5年疾病特异性生存率≥95%,但表达 IgM 的 PCMZL 具有更具侵袭性的病程。皮肤和血液中存在匹配的 B 细胞克隆或副蛋白血症均与 PCMZL/LPD 的皮肤复发或预后无关,生长模式、中心母细胞密度和细胞遗传学结果的差异似乎也无法为 PCFCL 提供有意义的预后信息。系统性 FL 的部分患者最初可能表现为皮肤受累(虽然罕见),但伴有低于放射学检测阈值的皮肤外疾病,存在CREBBP、KMT2D、EZH2、EP300突变(如在系统性 FL 中所观察到的)、涉及 bcl-2 基因的重排和低增殖率 (Ki67<30%) 可识别这些患者。与之不同,PCDLBCL,LT的5年疾病特异性生存率仅为约50%,bcl-2和 c-myc 双表达和 CDKN2A 缺失与生存率较差相关。体细胞 MYD88L265P突变也与较差的疾病特异性和总生存期相关。与仅表现为单个肿瘤的患者相比,累及单腿或双腿多个部位与疾病特异性生存期显著降低相关。
虽然 EBVMCU 可局部扩散或复发,但远处播散极为罕见,如果观察到,应及时考虑EBV相关淋巴增生性肿瘤。幸运的是,EBVMCU通常是局限性的,预后良好,因为大多数病例在免疫抑制减少后可消退。
治疗
由于无可用的随机对照试验,CBCL的治疗建议主要基于小型回顾性研究和机构经验。EORTC 和 ISCL 发布了与 NCCN 指南一致的共识治疗建议。在大多数情况下,最佳患者管理需要多学科讨论,包括皮肤科、肿瘤内科和放射肿瘤学。
PCFCL
对于孤立病灶患者,低剂量放疗是安全的且高度有效,完全缓解率接近100%。在多发病灶患者中,放疗似乎并不劣于多药化疗(可包含在多个放射野内)。在北美的一个大型系列研究中,单纯放疗对惰性 CBCL 的局部控制率为98%,在仅接受手术切除的患者中25%发生需要放疗的局部复发。保留放疗直至疾病复发似乎不影响疾病特异性生存或总生存期,因此,单纯完整切除,推迟放疗直至疾病复发也是合理的。也可考虑病灶内注射 [如皮质类固醇或利妥昔单抗] 或局部治疗,包括皮质类固醇、氮芥和贝沙罗汀。虽然放疗通常推荐用于孤立性病变患者,但放疗或观察(即“观察等待”)也是多发病灶患者的合理选择。此外,PCFCL患者可能表现出局部侵袭性病程(罕见),有学者认为可能转化为DLBCL,表明“观察等待”患者需要密切的临床随访。皮肤受累更广泛的患者可接受利妥昔单抗单药治疗。约三分之一的患者在放疗或利妥昔单抗单药治疗后可复发,但复发常局限于皮肤,其治疗与 PCFCL 的初始治疗相似。
PCMZL
PCMZL 患者的治疗与 PCFCL 的初始治疗相似。放疗或手术切除可实现单个或少数病灶患者的高缓解率。皮肤受累较广泛者可观察,一旦出现症状,可对病灶进行放疗或手术切除。同PCFCL一样,利妥昔单抗单药可用于症状性、广泛皮肤病变患者。建议对伯氏疏螺旋体相关 PCMZL 患者进行抗生素初步检测,但在北美患者中相关性较低。
PCDLBCL, LT
PCDLBCL,LT的自然史与系统性 DLBCL 更相似,因此在这些患者中可使用R-CHOP(伴或不伴放疗)。虽然可用报告很少,在这些患者中使用 R-CHOP 的无病生存率与高危系统性 DLBCL 患者的结果相当。许多患者的疾病局限于单一部位,并且像局限期系统性 DLBCL 患者一样接受治疗,即R-CHOP和累及野放疗。复发性疾病的管理与复发性系统性 ABC-DLBCL 相当 [例如来那度胺、伊布替尼或 tafasitamab/来那度胺]。在一项小型 II 期研究 (n=19) 中,来那度胺单药治疗复发性/难治性 PCDLBCL,LT 的6个月总缓解率为26%,但在无 MYD88L265P 突变的患者中显著更高。最近提出检查点 (PD-1) 阻断的疗效, 5例复发性/难治性疾病患者中的3例在 PD-1 阻断后达到持久缓解。
EBVMCU
对于免疫抑制相关的 EBVMCU,绝大多数在停止或减少免疫抑制后可自发消退。对于与年龄相关的免疫衰老相关的患者,以及免疫抑制减少后复发和缓解过程的患者,局灶性放疗或利妥昔单抗单药治疗均高度有效。
参考文献
Hristov AC, Tejasvi T,Wilcox RA.Cutaneous B-cell lymphomas: 2023 update on diagnosis, risk-stratification, and management.Am J Hematol . 2023 Aug;98(8):1326-1332. doi: 10.1002/ajh.26968. Epub 2023 May 22.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)