首页 > 医疗资讯/ 正文
CRISPR-Cas系统是原核生物(细菌和古菌)的用于防御噬菌体和外源遗传物质入侵的适应性免疫系统,之后被改造为新的基因编辑工具。最近,CRISPR技术已经走出实验室,在临床中修改患者的致病基因序列,为遗传疾病和癌症提供了强有力的解决方案。
在目前已鉴定的Cas蛋白中,spCas9(II-A型)和AsCas12a(V-A型)的应用最为广泛,然而,它们的蛋白都比较大(前者1368个氨基酸,后者1300个氨基酸),这超过了腺相关病毒(AAV)载体的装载极限,极大地限制了其在体内基因治疗中的应用。
近年来,V-F亚型CRISPR-Cas12f系统因其极小的体型(约400-700个氨基酸大小)和高特异性而备受关注。然而,现在报导的Cas12f系统在真核细胞中的编辑活性还相对较低,并且其较高的PAM识别特异性导致可靶向范围窄,从而限制了它们的进一步应用。因此,亟待开发新的高活性且可靶向范围更广的CRISPR-Cas12f系统。
2023年7月3日,芝加哥大学汤玮欣、赵明磊等在 Nature Chemical Biology 期刊发表了题为:An engineered hypercompact CRISPR-Cas12f system with boosted gene-editing activity 的研究论文。
该研究开发了一种工程化AsCas12f系统——enAsCas12f,其大小仅为SpCas9的三分之一,enAsCas12f显示出更高的DNA切割活性,高达野生型AsCas12f的11.3倍,并在人类细胞中广泛发挥编辑作用,在特定基因组位点上实现高达69.8%的DNA片段插入和缺失,还具有最低的脱靶编辑活性。enAsCas12f是迄今为止最高效、最紧凑的CRISPR系统之一,开启了基于CRISPR的基因编辑新领域。

近年来,科学家们开发了几种小型化Cas蛋白,例如CasX(Cas12e,986个氨基酸)、CasΦ(Cas12j,700-800个氨基酸)、Cas12f(400-700个氨基酸),以及IscB和TnpB(约400个氨基酸,被认为是Cas9和Cas12a的祖先)。其中,Cas12f由于其小尺寸和能够靶向切割DNA双链而备受关注。

2021年9月,上海科技大学季泉江团队开发了AsCas12f1(422个氨基酸)【2】。2023年4月,辉大基因杨辉团队开发了OsCas12f1(433个氨基酸)和RhCas12f1(415个氨基酸)【3】。
这几种小型化Cas12f都能够在哺乳动物细胞中实现基因编辑,具有很大的基因治疗前景。然而,将Cas12f系统作为基因编辑工具还有很大的改进空间,与Cas9和Cas12a相比,Cas12f系统切割双链DNA的效率较低,并且在靶向不同基因组位点时表现出很大的活性差异。
在这项研究中,研究团队通过理性设计来改造AsCas12f,从而获得了工程化的enAsCas12f蛋白,enAsCas12f对人类基因组造成DNA双链断裂(DSB)的效率可高达野生型AsCas12f的11.3倍。
研究团队还进一步解析了AsCas12f与sgRNA和靶标DNA的复合物冷冻电镜结构,分辨率为2.9Å,从而推进了我们对V-F型CRISPR系统的机制理解。在冷冻电镜结构的指导下,研究团队将sgRNA的长度从193nt缩短到了72nt,而不影响对DNA的靶向和切割活性。
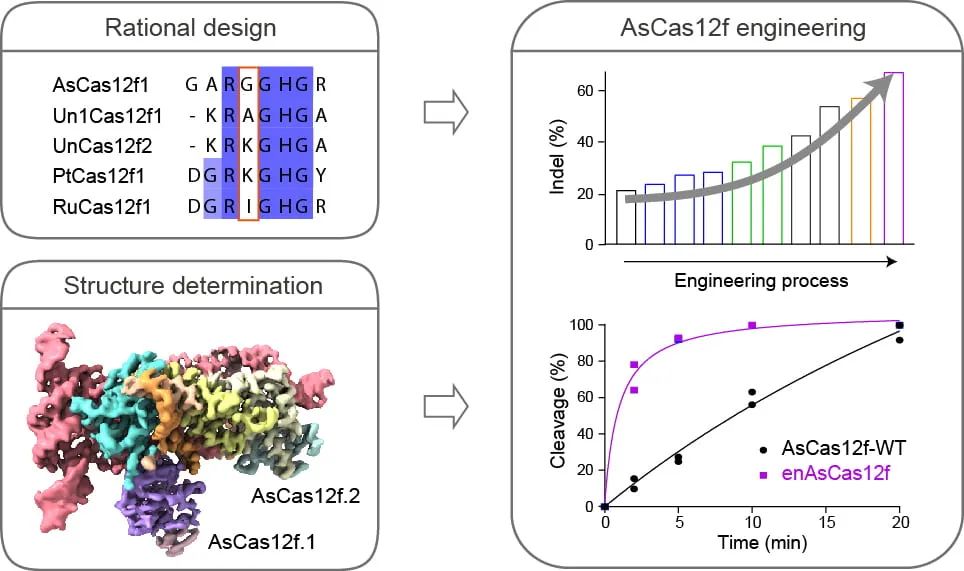
研究团队还发现,enAsCas12f不仅编辑效率更高,而且通过GUIDE-seq评估显示,enAsCas12f具有最小的脱靶编辑效率。
总的来说,该研究开发了一种工程化Cas12f系统——enAsCas12f,其编辑效率可高达AsCas12f的11.3倍,而大小仅为SpCas9的三分之一。这种经过工程化改造的超紧凑Cas12f系统能够在哺乳动物细胞中实现高效和高特异性的基因编辑,这也是迄今为止最高效、最紧凑的CRISPR系统之一,enAsCas12f开启了基于CRISPR的基因编辑新领域。
论文链接:
1. https://www.nature.com/articles/s41589-023-01380-9
2. https://www.nature.com/articles/s41589-021-00868-6
3. https://www.nature.com/articles/s41467-023-37829-7
猜你喜欢
- ASH 2022:BCMA CAR-T细胞治疗对复发/难治性多发性骨髓瘤 (RRMM) 的ORR高达100%
- JAMA 子刊:美国田纳西州儿科门诊抗生素处方符合一线指南推荐的比例
- 秋季养胃常喝这些汤,你的胃越来越健康
- npj Precision Oncology:ALK阳性间变性大细胞淋巴瘤中的循环肿瘤DNA(ctDNA)应用:用于监测和耐药突变识别的概念验证
- 枸杞和鸡蛋的功效与药用价值
- 夏天防晒吃什么 防晒饮食须知
- 科学的生活,管理好血脂!|指南速递
- 35岁女子变身“点头娃娃”,邻居以为她童心未泯,真相竟是……
- 活络神、保胃丹等大批假“港药”被查获 其中不少“回流货”
- 男性出现腰部疼痛一般都有哪些原因
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)