首页 > 疾病防控/ 正文

肥胖被定义为功能失调的脂肪组织(AT)的过度堆积,是一种主要的全球流行病,导致重要的生理和代谢相关功能障碍,包括2型糖尿病(T2D)、心血管疾病和癌症。随着这一公共健康问题的日益普遍,人们现在认识到,脂肪组织(AT)质量增大,加上血管形成不足、缺氧、巨噬细胞浸润、低度炎症和/或纤维化,都会导致肥胖的许多并发症的发生。额外的复杂性是由于AT驻留免疫细胞的失调,这是通过调节炎症和新陈代谢来维持AT动态平衡的关键。肥胖的全身性和慢性炎症反应的特征是脂肪细胞或免疫细胞(主要是巨噬细胞)浸润的脂肪细胞或免疫细胞释放细胞因子、白细胞介素(IL)和脂肪因子的改变。
白细胞介素-36(IL-36)是近年来发现的一种细胞因子,在多种炎症性疾病的调节中具有重要作用。由于目前还没有关于这种细胞因子如何调节AT稳态的数据,我们的目标是探索一种特殊的亚型,IL-36g,一种激动剂,在人类肥胖和肥胖相关的2型糖尿病以及AT炎症和纤维化中的作用。
在一项病例对照研究中,对91名参与者的血浆IL-36g进行了测定,并对31例接受减肥手术的严重肥胖症患者的减肥效果进行了评估。分析IL36G及其受体在人体相关代谢组织中的基因表达水平。体外测定炎症因子和IL-36G对人脂肪细胞和巨噬细胞的影响。
首次发现肥胖患者经Roux-en-Y胃分流术减肥后,循环中升高的IL-36g水平降低(P<0.001),内脏AT和外周血单个核细胞IL-36G基因表达水平上调(P<0.05)。我们还发现饮食诱导的肥胖小鼠附睾AT中IL36g的表达水平增加(P<0.05)。脂多糖可显著增强人脂肪细胞和单核巨噬细胞的IL36G(P<0.001),而与抗炎细胞因子孵育后IL36G无明显变化。加入IL-36g 24h后,IL-36g自身表达增强(P<0.01),主要炎症和趋化因子表达增强(P<0.01),而肝纤维化相关基因无明显变化。此外,肥胖患者脂肪细胞条件培养液还能增加单核巨噬细胞IL-36g的释放(P<0.01)和组织蛋白酶G(CTSG)的表达(P<0.05)。

图1|肥胖及其相关的T2D对IL-36G水平的影响。手术减肥的效果。(A)正常体重(NW)志愿者(n=18)、肥胖(OB)患者(n=32)和糖耐量受损/2型糖尿病(IGTT2D)患者(n=41)的空腹血浆IL-36g浓度;(B)肥胖者(n=31)Roux-en-Y胃分流术减肥前后血浆IL-36g浓度的比较。(C,D)条形图显示NW志愿者(n=6)、OB-NG(n=23)和OB-T2D(n=15)患者内脏脂肪组织(VAT)中IL36G和IL36R的mRNA水平,以及T2D患者(n=6)和非T2D患者(n=8)的脂肪细胞(n=11-13)和间质血管部分细胞(SVFC)(n=8)中IL36G和IL36R的mRNA水平。(E)检测正常对照组(n=20)、OB-NG组(n=16)和OB-T2D组(n=18-25)外周血单个核细胞(PBMC)中IL-36G和IL-36R的基因表达水平,以及按IGT-T2D阳性和阴性分为33例和28例的OB患者肝组织中IL36G和IL36R的基因表达水平。条形代表平均值±扫描电镜。在适当的情况下,用单因素方差分析(One-way ANOVA)和图基检验(Tukey‘s test)以及未配对和配对的双尾学生t检验来分析各组之间的差异。*P<0.001,**P<0.01,*P<0.05。

图2|炎症相关因子对IL36G和IL36R基因表达水平的影响。条形图显示(A,B)LPS,(C,D)TNF-α,(E,F)IL-4和(G,H)IL-13孵育24小时对人分化内脏脂肪细胞和单核细胞来源的巨噬细胞IL 36G和IL 36R转录水平的影响。未刺激细胞的基因表达水平假设为1,取值为平均值±扫描电镜(n=4-7)。组间差异分析采用单因素方差分析和Dunnetts‘s检验。*P<0.001,**P<0.01,*P<0.05。
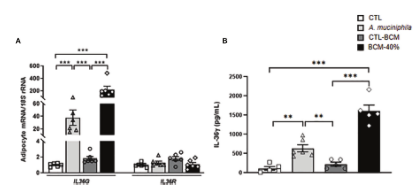
图3|(A)内脏脂肪细胞IL-36G和IL-36R的基因表达水平以及(B)与粘液阿克曼氏菌或细菌条件培养基(BCM)孵育后内脏脂肪细胞释放IL-36G的情况。条形图表示平均值±SEM。组间差异分析采用单因素方差分析,随后进行图基后检验。**P<0.01和*P<0.001,每组5~6例。

图4|脂肪细胞条件培养液(ACM)对单核细胞来源的巨噬细胞的影响。条形图显示孵育24小时的肥胖者ACM(20%和40%)对(A)IL36G、IL36R和CTSG转录水平的影响以及(B)ACM治疗后IL-36G分泌水平的影响。取值为平均±扫描电镜(n=5~6)。组间差异分析采用单因素方差分析,然后进行图基检验。*P<0.05和**P<0.01。(n=5~6个/组)。
这些发现首次为IL-36g在调节AT慢性炎症中的特性提供了证据,成为AT生物学和肥胖相关合并症之间的联系。
原文出处:Frühbeck G, Gómez-Ambrosi J, Ramírez B, et al.Increased Levels of Interleukin-36 in Obesity and Type 2 Diabetes Fuel Adipose Tissue Inflammation by Inducing Its Own Expression and Release by Adipocytes and Macrophages.Front Immunol 2022;13
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)