首页 > 疾病防控/ 正文
近年来生物3D打印的发展为体外的创造提供了新的见解。促进干细胞再生的微环境。汗腺 (SG) 主要负责体温调节,是一种高度分化的器官,再生能力有限。最近的研究集中在以干细胞为基础的疗法作为修复深部皮肤损伤后 SG 的策略。该文章讨论了来自 3D 生物打印微环境的生化因素和结构和机械线索的五种可能的调节机制,以及来自邻近细胞和血管微环境的最有希望的调节。
图1文章来源
SG很小,分布在人体各处,以调节体温。SGs 的功能障碍会导致体温过高,这与中暑甚至死亡有关。SG 是单管结构,在直管下方具有盘绕的分泌部分。分泌线圈包含三种不同的细胞类型:暗细胞、透明细胞和肌上皮细胞。暗细胞和透明细胞是分泌细胞,透明细胞分泌水和电解质,暗细胞分泌糖蛋白。肌上皮细胞机械地支持功能性腔结构。

图2参与汗腺再生的微环境因素。ECM细胞外基质、FA f-肌动蛋白、DNA脱氧核糖核酸、RNA核糖核酸
研究表明,诱导的 SGC 在不同程度的烧伤中表现出不同的修复效果,这表明 SG 再生的难度与其生态位的破坏密切相关。此外,调整组织的几何形状和结构对于指导 SG 分化和形态发生具有重要意义。因此,在体外重建 SG 生态位为诱导细胞分化和组织再生铺平了有效途径。
3D 生物打印技术通过对各种类型的生物墨水和细胞的时空控制来概括皮肤的高度组织化的组织几何形状,在提供准确和有组织的体外干细胞生态位刺激方面具有巨大潜力。
3D 生物打印生态位诱导 ESC 分化为 SGC。
有研究表明3D 生物打印生态位诱导 ESC 分化为 SGC,培养 2 周后细胞分化效率达到 >50%。
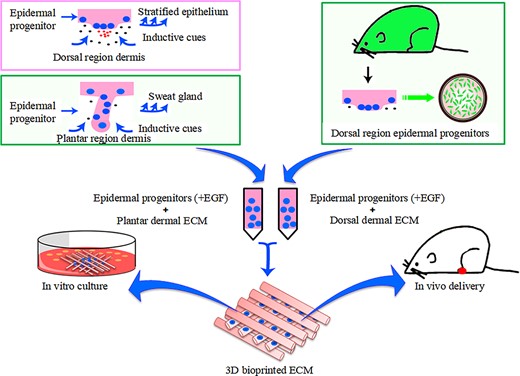
图33D 生物打印生态位诱导功能性汗腺再生
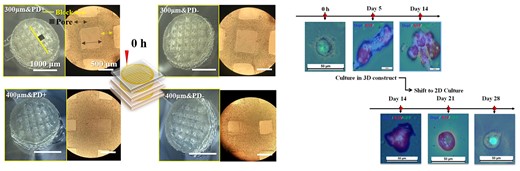
图4具有不同结构的 3D 支架及其对细胞行为和组织形态发生的影响
细胞增殖、迁移和基因表达等细胞行为取决于生态位的几何形状,这会促进细胞骨架张力并提供细胞粘附。
一般来说,制造微米级和纳米级分辨率的材料图案可以调节细胞命运,尽管很难在 3D 环境中精确地模拟 ECM 的微观结构。需要可以通过精确的几何控制和微图案设计来模拟真实结构线索的 3D 支架。
3D 打印支架的生化和结构线索协同指导 MSC 分化以促进功能性 SG 再生。
在研究潜在的分子机制时,通过蛋白质组学分析发现,胶原蛋白三螺旋重复蛋白1(CTHRC1)蛋白在SG发育过程中高表达,并作为3D支架中的生化因子;进一步的转录组学分析证明,3D结构因子通过上调Hmox1的表达,在BMSCs的分化过程中发挥着不可或缺的重要作用。基因本体功能分析表明,3D结构和可溶性因子通过激活参与SGs产生的BMP2的表达,协同启动腺体发育的GO项目和分支结构的发生。添加CTHRC1抗体拮抗生物墨水中的CTHRC1蛋白或通过抑制剂下调BMSC中Hmox1的表达会严重降低诱导作用。
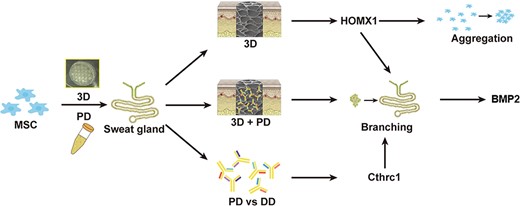
图4CTHRC1 和Hmox1在 3D 生物打印生态位中协同促进 MSCs 汗腺的命运。MSC间充质干细胞、DD真皮背侧、Cthrc1胶原三螺旋重复蛋白 1、HOMX1人血红素加氧酶 1、BMP2骨形态发生蛋白 2、PD足底真皮
血管生态位和 SG 再生相关,血管系统的重建是皮肤移植后附件再生的先决条件。
在皮肤中,SG、毛囊、皮脂腺和白色脂肪在结构上相互关联,形成一个皮肤附着单元。毛囊和 SGs 具有相似的发育模式和诱导过程的事实,以及 SGs 被血管包围的观察结果表明,血管调节对于 SGs 的生态位至关重要。SGs分泌部分的解剖结构靠近血管,围绕几个SG单位的真皮微血管网络有利于出汗,但血管内皮细胞与SGCs之间的生物通讯机制尚不清楚。
成纤维细胞、毛囊、皮脂腺和脂肪细胞与 SG 相邻,并通过分泌 Wnt、BMP2、BMP4 和其他生长因子来支持它们的形态和功能。
ECM 刚度的变化可以通过细胞粘附和细胞骨架传递到细胞核,然后诱导基因表达的交替 。
疤痕首先改变了真皮成纤维细胞的组成,使邻近的SG细胞受损,导致缺乏诱导SG再生的信号。其次,由于大量胶原蛋白的积累导致 ECM 硬度的增加阻碍了 SG 导管的出芽和形成,SG 导管需要深入真皮层并且对出汗很重要。最后,ECM 刚度的增加不利于血管生成,这对 SG 再生也是有害的。
用于再生医学的 3D 生物打印微环境的主要挑战包括如何结合协同线索以实现准确的细胞 - 基质信号传导,并同时提供一组异质的线索来概括原生微环境。例如,通过使用 3D 生物打印技术和 ECM 匀浆在体外模拟 SG 生态位以诱导 SG 再生,该研究证明了结构线索、生化因素和机械线索参与维持组织功能和驱动组织再生。
研究还假设 3D 生物打印技术的简便性将允许创建血管和相邻细胞微环境,这些微环境可以稳健且适当地概括异质细胞微环境。
所有这些关键要素通常被认为对于在体外成功再生功能齐全的器官至关重要,未来需要进一步探索其潜在机制。
原始文章:
Song Wei,Yao Bin,Zhu Dongzhen et al. 3D-bioprinted microenvironments for sweat gland regeneration.[J] .Burns Trauma, 2022, 10: tkab044.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)