首页 > 疾病防控/ 正文
图为沃森生物mRNA试验疫苗
备受瞩目的国产首个新冠mRNA疫苗(ARCoV)I 期临床结果公布,1月24日发表在《柳叶刀·微生物》杂志上。

论文详细信息请见论文链接:https://doi.org/10.1016/S2666-5247(21)00280-9,本文做初步解读
该新冠mRNA疫苗由沃森生物、艾博生物以及军事医学科学院共同开发。有关ARCoV疫苗的I期临床试验,旨在评估该疫苗初步的安全性、耐受性以及免疫原性。
临床试验主要结果及相关主要信息如下:
1.ARCoV疫苗的I期临床试验是在浙江省杭州市树兰医院进行的,该试验为单中心、双盲、随机、安慰剂对照、剂量递增。
2.试验在2020年10月30日至12月2日期间,共招募230人,之后从中随机抽取了120名符合条件的受试者,受试者是从18-59岁的健康成年人、新冠病毒感染阴性;
3.受试者随机分为6组,5个剂量水平的试验组以及安慰剂(每组20人),剂量水平分别为5 μg、10μg、15μg、20μg以及25 μg依次递增。
4.所有受试者都接受了第一次疫苗接种,有118人接受了第二剂。在接种疫苗56天内,没有报告严重不良事件,且大多数不良事件为轻度或中度。
5.发热是试验中最常见的不良反应:5 μg组中出现1例(占比为5%),10 μg组中出现13例(占比为65%),15μg组中出现17例(占比为5%),20μg组中出现19例(占比为95%),25 μg组中出现16例(占比为100%);
6.3级全身不良事件发生率,5 μg组为0%,10 μg 组为15%,15 μg 组为30%,20μg组为35%,25μg组为31%,安慰剂组为0%。(注:所谓3级不良反应,为严重的或临床上明显的,但非立即致命的,需入院干预或延长住院时间)
7.所有试验组的受试者在接种疫苗后2天内发烧消退,ARCoV疫苗第一次接种和第二次接种造成的不良事件发生率相似。
8.体液免疫包括抗RBD IgG和中和抗体在第二剂后7天显著增加,此后14至28天达到峰值。特异性 T 细胞反应在完全接种疫苗(两针接种)后 7 至 14 天之间达到峰值。
9.15μg试验组诱导的中和抗体滴度最高,大约是新冠康复患者中和抗体的两倍。
10.最后,《柳叶刀》这篇论文指出,综上所述ARCoV疫苗在5个剂量组中都是安全的、耐受性良好的,且可诱导强烈的体液和细胞免疫反应。
艾博生物是国内明星mRNA疫苗开发公司,成立于2019年1月,是一家专注于信使核糖核酸(mRNA)药物研发的临床期创新型生物医药公司。
新冠疫情发生不久后,艾博生物就启动了新冠疫苗的研发。早在2020年9月份,艾博生物CEO英博在一次大会上表示,他们已拿到了I期临床试验,但结果公布未定。
2021年4月19日,由沃森生物、艾博生物以及军事科学院军事医学研究院共同研制的新冠mRNA疫苗II期临床试验接近尾声。与此同时,他们已开始着手于新冠mRNA疫苗III期临床的海外试验。
2021年9月,沃森生物向外界发布公告称,其与艾博生物合作研发的新型冠状病毒mRNA疫苗ARCoVaX(ARCoV)III期临床试验分别获得了墨西哥、印度尼西亚药监部门的批准。
希望我们距离国产新冠mRNA疫苗不会太远。
如下为此次临床试验的关键数据:

受试者相关情况介绍
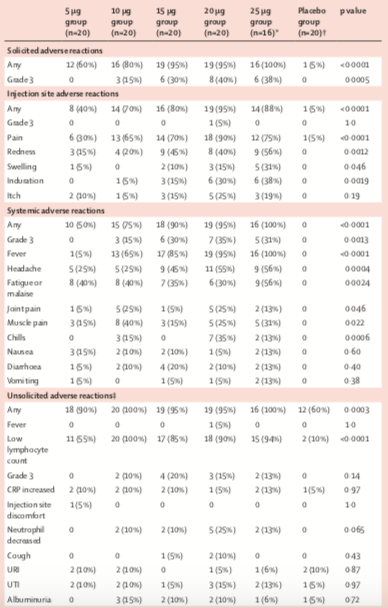
不良反应情况数据
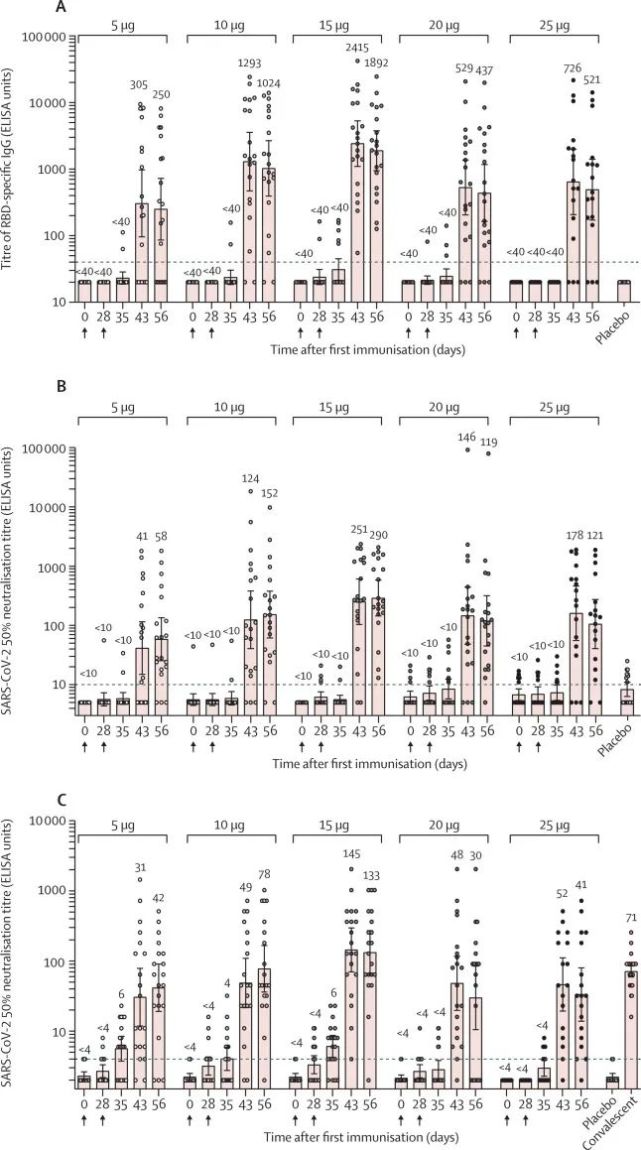
ARCoV I期试验中抗体和中和反应
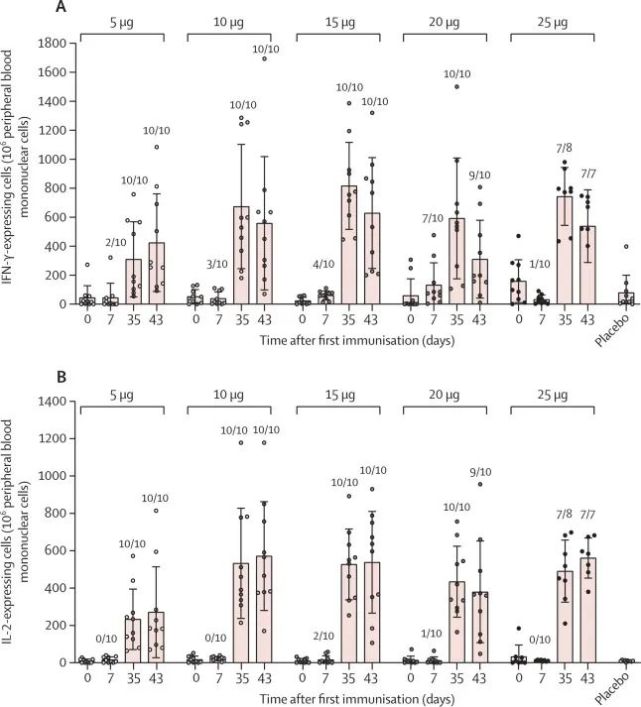
ARCoV I期试验中引起的T细胞免疫反应
主要有效性结果解读
试验结果显示,ARCoV在5种不同剂量(5ug、10ug、15ug、20ug、25ug)下均安全性和耐受性良好,且能够诱导强烈的体液和细胞免疫反应,其中15ug试验组诱导的中和抗体滴度最高,大约是新冠康复患者的2倍。这些结果支持了对ARCoV进行大规模的进一步临床测试。
对比Moderna研发的mRNA-1273两次疫苗接种后的第57天,受试者平均滴度水平超过了COVID-19确诊患者恢复期血清中的平均滴度,并且在100毫克剂量下,受试者在第57天的中和抗体水平(按几何平均滴度测量)为231.8,而COVID-19康复患者的数据为109.2,也是康复者血清中和抗体滴度的2倍多一些。
BioNTech与辉瑞合作的新冠疫苗对新冠病毒中和抗体滴度的评估表明,在接受10 g和30 g剂量疫苗接种的志愿者中中和抗体几何平均滴度(GMT)分别为168和267。这些数值是康复者血清中中和抗体滴度的1.8和2.8倍。
主要安全性结果解读
3级系统性不良事件发生率的表现如上图,5μg组、10μg组、15μg组、20μg组和25μg组分别为0、15%、30%、35%和31%,安慰剂组3级系统性不良事件发生率为0(p=0.0013)。
从安全性数据可得,艾博生物此次的试验mRNA疫苗全身性副作用发生率在50-100%,其中全身性3级副作用发生率最高为35%(20ug剂量组)。
3级系统性不良事件发生率的表现如上图,5μg组、10μg组、15μg组、20μg组和25μg组分别为0、15%、30%、35%和31%,安慰剂组3级系统性不良事件发生率为0(p=0.0013)。
从安全性数据可得,艾博生物此次的试验mRNA疫苗全身性副作用发生率在50-100%,其中全身性3级副作用发生率最高为35%(20ug剂量组)。
不过从数据上看,ARCoV的反应性(也就是发烧这些常见不良反应)比较大,这是mRNA疫苗的普遍特点和缺点。数据显示15微克组有85%的人出现发烧,30%的人是三级(39-40度的高烧)。这个比例超过了辉瑞/BioNTech与Moderna疫苗临床试验的结果。
ARCoV与现在上市的两个mRNA疫苗不同,只用了刺突蛋白的一段——RBD区域,而不是全长刺突蛋白。不过BioNTech也开发过仅用RBD的疫苗并完成了一期临床试验,在试验中,仅用RBD的BNT162b1的不良反应比例要高于全长刺突蛋白的BNT162b2(现在使用的辉瑞/BioNTech疫苗)。即便如此,18-55岁受试者中BNT162b1的30微克组发烧比例只有75%。
相较之下,Moderna一期临床试验里测了25µg、100µg与250µg三个剂量组,25µg组中和抗体滴度大约为100µg组的一半,但100µg组与250µg组相差不大。
通过公开数据,随着剂量的加大不良反应的比例也在加大,但是中和抗体水平在15µg达到最高后反而下降,在不良反应中,ARCoV还出现了淋巴细胞的下降,这是之前mRNA疫苗中都未出现的。
如何看待ARCoV不良反应?
根据ARCoV的I期临床结果,接种部位疼痛、疲劳/乏力、头痛、寒颤等其他常见不良反应的发生率相对较低。除发热外,其他症状均未达到3级。
在注射部位反应或其他系统性不良事件方面,ARCoV(15微克)发热与其他相似抗原设计的新冠mRNA疫苗在一期试验中的数据相当。
艾博生物创始人兼CEO英博在电话会上表示,相较于大家直观看到的数据,临床方案设计的重要性也值得注意。作为国内首个进入临床研究的mRNA疫苗,ARCoV的一大任务就是要在临床上把这一类技术的真实反应探索、展现出来。
临床试验过程中,发热是申办方需要主动收集的不良反应之一,但在评估、记录、和分析的过程中,不同的试验设计对退热药物使用的标准不尽相同。
具体到ARCoVs的案例,其公开的研究方案对于退热药物的使用是有明确使用限制的,直至受试者体温高于38.5°C且无法耐受时才给予口服对乙酰氨基酚进行退热治疗,而38.5°C也恰恰是触发NMPA标准3级发热的临界温度。这一定程度造成了不良反应的放大效应。
相较于此,关于发热的的后续进展可能更有关注价值。英博解释说,发热和“发烧”状态存在不小的差异,对于前者,受试者主要感知到的是体温增加,而不是像“发烧”一样的难受,这种II、III期的临床参与度也可以一定体现。
并且,发热是一过性的免疫反应。根据试验数据,90%以上受试者的发热时间在12-36小时,36小时之后所有不适感完全消失,因此,ARCoVs的风险可控, 引起的不适程度也不高。
在后续的临床中,艾博生物也借鉴了国外临床的经验,接种前或者发热前用药,使得发热问题得到很好解决。II、III期临床中,观察到的发热率有明显下降。虽然目前还未揭盲,数据还未收集完整,但举一组收到的盲态数据为例,海外III期临床盲态下的2149个案例里,发热患者比例仅有个位数。
此外,对于淋巴细胞下降的现象,艾博生物在做临床一期实验的时候,还没有其他同类疫苗数据有过公开发表,当时观察到这个现象,也非常重视,在第一时间组织专家讨论, 进行仔细的观察和研究。查阅相关资料后发现,这属于淋巴细胞的归巢现象,由于疫苗接种后激发人体免疫系统,淋巴细胞在注射部位大量聚集,所以检测全身淋巴细胞水平有所下降。这是炎症反应引起的一种正常现象。
辉瑞的新冠mRNA疫苗临床试验中,也有类似情况,免疫后第2天淋巴细胞降低明显,第8天恢复;而ARCoVs的临床试验中,受试者第4天就恢复到正常水平。
疫苗的安全性评价应建立在对大规模人群、长期的观测的基础上。I期研究的主要目的是剂量探索,且样本量较小,所以个体受试者的不良反应对整体结果影响较大。英博补充说,对于安全性评估,更建议参考II、III期临床数据。而这部分资料见诸公众,尚需要一定的时间和流程。
当被问及CDE对该产品的态度,英博表示,尽管ARCoVs的III期临床在海外开展,但每一步都保持与 CDE沟通, 临床试验的稳步进行,某种程度上反映了药品审评机构的态度,如果ARCoVs没有成功的可能性,也不会浪费更多的临床资源。
艾博生物/沃森生物新冠mRNA疫苗ARCoV全身性的副作用发生率在50%-100%,后续重点推进的三期选择的15µg剂量组的副作用发生率也高达95%。目前该疫苗已经进入临床III期,其后续试验结果的安全性及有效性还有待进一步验证。
不过值得一提的是,艾博生物开发的这款mRNA疫苗ARCoV具有出色的稳定性,可在正常冰箱温度下(2-8℃)长期保持稳定(至少6个月),这意味着mRNA疫苗可及性大大增强。相比之下,Moderna的mRNA疫苗需要在-20℃下保存和运输(在2-8℃稳定30天),而辉瑞mRNA疫苗更是需要在-70℃下保存和运输运输(在2-8℃稳定5天)。
原始出处:
Safety and immunogenicity of the SARS-CoV-2 ARCoV mRNA vaccine in Chinese adults: a randomised, double-blind, placebo-controlled, phase 1 trial. DOI: https://doi.org/10.1016/S2666-5247(21)00280-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)