首页 > 医疗资讯/ 正文
大约70%的晚期乳腺癌表达激素受体雌激素或孕激素(或两者),并且不具有人表皮生长因子受体2(HER2)过表达。在这些患者中,内分泌疗法通常是与细胞周期蛋白依赖性激酶4和6(CDK4/6)抑制剂联合使用,是晚期疾病的一线治疗的基石。与单独使用 aromatase 抑制剂疗法相比,这种治疗已被证明显著改善无进展生存期和总生存期。然而,大多数患者仍会出现疾病进展,并且治疗这些患者仍然是一个临床挑战。在 aromatase 抑制剂治疗期间出现疾病进展后,是否应该选择内分泌为基础的治疗,以及是否应该结合 CDK4/6 抑制剂,目前还不清楚。然而,选项包括单药应用选择性雌激素受体降解剂 fulvestrant,或作为联合治疗的一部分。
AKT 是磷脂酰肌醇3激酶(PI3K)-AKT-PTEN信号通路的关键节点。通过PIK3CA和AKT1的激活突变以及PTEN的失活改变,在约半数的激素受体阳性、HER2阴性的乳腺癌中发生该通路的过度激活。这些改变可能在癌症复发时存在,并且也可能是以前的治疗(包括CDK4/6抑制剂治疗)所获得的。AKT信号通路可能也在无内分泌抵抗基因突变的患者中被激活。抑制这一通路在治疗先前接受内分泌疗法的激素受体阳性晚期乳腺癌中取得了成功,这些结果得到了监管机构的批准。PIK3CA突变肿瘤中的PI3Kα选择性抑制剂alpelisib与fulvestrant联合应用在SOLAR-1试验中,以及哺乳动物雷帕霉素靶向(mTOR)抑制剂everolimus与exemestane联合应用在BOLERO-2试验中,都比单纯的内分泌疗法表现出更好的疗效。这两个随机试验都是在CDK4/6抑制剂可用之前进行的,但在一个后续的II期单组试验(BYLieve)中,研究人员试图通过alpelisib加fulvestrant来解决这种情况下的数据需求。
Capivasertib是一种口服可利用的小分子抑制剂,可以抑制所有三种AKT亚型。在临床前模型中,Capivasertib抑制了AKT,并导致下游关键靶标的去磷酸化;该药物还显示出对乳腺癌细胞系的抗增殖活性,并在临床前模型中与内分泌疗法具有协同的抗肿瘤活性。在II期FAKTION试验中,与fulvestrant单药相比,Capivasertib联合fulvestrant治疗在绝经后激素受体阳性晚期乳腺癌患者中明显改善了无进展生存期和总生存期。在这里,我们呈现了CAPItello-291的主要分析结果,这是一个III期试验,评估了Capivasertib-fulvestrant治疗在激素受体阳性、HER2阴性晚期乳腺癌患者中的疗效和安全性,这些患者的疾病在芳香酶抑制剂治疗期间或之后出现了进展,有或没有CDK4/6抑制剂的使用。
研究设计
在这项随机、双盲、安慰剂对照的III期试验中,我们以1:1的比例随机分配患者,其中一组接受口服capivasertib(每日400 mg,连续服用4天,然后休药3天)加上氟维司群(fulvestrant)(每14天肌肉注射一次500 mg,前三次注射为每28天一次),另一组接受相匹配的安慰剂加上氟维司群。一个周期定义为capivasertib或安慰剂治疗持续4周。绝经前或绝经期的妇女还在试验治疗期间同时接受促黄体生成素释放激素激动剂。根据是否存在肝转移、先前使用CDK4/6抑制剂(是或否)以及地理地区的情况进行分层随机化。
治疗持续至疾病进展(根据实体肿瘤反应评价标准[RECIST]第1.1版评估)、出现无法接受的毒性反应、撤回同意或死亡。如果有必要,capivasertib或安慰剂的剂量可以从每日400 mg两次减少到每日320 mg两次,然后再减少到每日200 mg两次。对于由于capivasertib或安慰剂引起的3级或更高级别的不良事件,或者根据临床需要的低级别不良事件,可以进行剂量减少或中断。不允许减少fulvestrant的剂量。除非由于疾病进展,否则停用capivasertib或fulvestrant的患者可以继续接受另一种药物。不允许对皮疹和腹泻进行原发性预防,但研究人员被建议在特定情况下考虑后续预防措施。
患者
符合以下条件的绝经前、绝经期或绝经后的女性或男性(大多数地区年龄≥18岁;日本年龄≥20岁),且患有激素受体阳性、HER2阴性的局部晚期(即原发性无法手术治疗)或转移性乳腺癌可以参加本试验。激素受体阳性状态被定义为雌激素受体的表达,无论伴随有无孕激素受体的表达,并且在当地进行了激素受体和HER2状况的评估。HER2阴性状态被定义为免疫组化测试中的0或1+强度,或免疫组化测试中的2+强度和原位杂交中无扩增,或如果未进行免疫组化测试,则根据美国临床肿瘤学会和美国病理学家学会的指南建议,原位杂交中无扩增的证据。患者在之前使用芳香酶抑制剂,有或没有CDK4/6抑制剂,期间必须有疾病进展;疾病进展的定义为在转移性疾病背景下芳香酶抑制剂先前治疗期间的进展,或在新辅助或辅助芳香酶抑制剂治疗结束后的12个月内治疗期间的进展。芳香酶抑制剂治疗不要求是最近的治疗。
患者允许在晚期疾病的背景下接受最多两条先前的内分泌治疗线和一条先前的化疗线。试验方案要求至少51%的患者接受过CDK4/6抑制剂治疗。要求先前治疗期间有疾病进展。排除之前接受过fulvestrant或其他选择性雌激素受体降解剂、AKT、PI3K或mTOR抑制剂的患者,以及患有糖尿病并接受胰岛素治疗或基线糖化血红蛋白水平至少为8.0%(63.9 mmol/mol)的患者。
患者需要具有可测量的病灶(根据RECIST第1.1版评估),或者至少一处可通过计算机断层扫描(CT)或磁共振成像(MRI)评估的溶骨性或混合性溶骨性-骨质疏松骨病变,并带有可通过CT或MRI评估的可辨识的软组织成分。患者在过去2周内无残疾,根据Eastern Cooperative Oncology Group的表现状况评分为0或1(在从0[无残疾]到5[死亡]的量表上),且在过去2周内没有恶化。需要有可供分子分析的肿瘤组织。通过基因测序技术(使用FoundationOneCDx试剂盒 [Foundation Medicine] 进行中心化检测)在所有国家(除中国外,使用OncoScreen Plus试剂盒 [Burning Rock Biotech])确定PIK3CA和AKT1的活化突变以及PTEN基因的失活改变。具有这三个基因中至少一处合格变化的肿瘤的患者被纳入AKT通路改变人群。没有在这三个基因中检测到合格变化或测试结果未知的肿瘤的患者被纳入AKT通路非改变人群。
终点
本研究的双重主要终点为研究者评估的总体人群和具有AKT通路改变肿瘤的患者的无进展生存期(根据RECIST,第1.1版)。次要终点包括总生存期、客观反应和安全性。患者报告的终点包括欧洲癌症研究与治疗组织(EORTC)核心生活质量问卷(QLQ-C30)。QLQ-C30以0到100的分数进行评估,分数越高表示生活质量越高。
程序
根据RECIST,第1.1版,使用CT或MRI扫描(或两者)在筛选时(随机化前4周内)、头18个月每8周一次,然后每12周一次直至疾病进展进行肿瘤评估。放射性骨扫描在筛选时进行,并根据临床需要重复进行。除非由于疾病进展,否则停止使用卡匹维替或富马酸地诺孕酮的患者将继续每8周进行扫描(根据RECIST,第1.1版评估疾病进展)。
生化学和血液学检查以及生命体征评估分别在第一和第二个周期的第1和第15天进行,并在随后的周期的第1天进行。空腹血糖水平在第一个周期的第1和第15天进行评估,然后每4周一次,直至停止使用卡匹维替或安慰剂。不良反应持续记录,直至停药30天后,并根据国家癌症研究所不良事件常规术语标准(CTCAE),第5.0版进行分级。
统计分析
本试验的样本容量为700名患者,旨在评估卡匹维替治疗对无进展生存期和总生存期的影响。主要终点将在总体人群中(542例进展或死亡事件发生时,约77%的成熟度)和AKT通路改变人群中(217例事件发生时)进行分析,假设试验人群中40%的患者存在AKT通路改变肿瘤。在假设两个人群中无进展生存期的真实风险比为0.64的情况下,我们估计该试验在总体人群中具有超过99%的统计功效,能够显示出卡匹维替-富马酸地诺孕酮组与安慰剂-富马酸地诺孕酮组之间的显著差异(双侧P<0.035),并且在AKT通路改变人群中具有91%的统计功效,能够显示出卡匹维替-富马酸地诺孕酮组与安慰剂-富马酸地诺孕酮组之间的显著差异(双侧P<0.05),剩余1.5%的α被重新分配。
总体生存期的无劣效性评估(即,风险比不支持安慰剂-富马酸地诺孕酮组)在无进展生存期主要分析时进行(附加0.01%的α惩罚)。疗效分析包括所有进行随机分组的患者。使用对肝转移的存在与否、以前是否使用CDK4/6抑制剂(是或否)和地理区域(仅在总体人群中评估)进行分层的log-rank检验对两个主要终点进行了检验。根据使用SAS 9.4版本软件(SAS Institute)的PROC PHREG程序拟合的分层Cox比例风险模型计算风险比和相关的95%置信区间,并使用Efron方法控制并列数据。根据各种因素(如AKT通路改变状态和以前是否使用CDK4/6抑制剂),进行亚组分析,并以森林图形式呈现。使用调整了随机分层因素的logistic回归模型分析两个人群中具有客观反应的患者的百分比。
安全性分析包括至少接受过一剂卡匹维替、富马替地诺孕酮或安慰剂的所有患者。安全性数据使用描述性统计方法进行总结。统计分析计划可在试验方案中获得。
结果
患者
自2020年6月2日至2021年10月13日,共有901名患者在19个国家的193个中心进行了招募;708名患者(来自181个中心)进行了随机分组,其中355名患者分配至卡匹曲塞替治疗组,353名患者分配至安慰剂治疗组(见附录图S1,详见NEJM.org)。总体人群中有289名患者(40.8%)的肿瘤存在AKT信号通路突变。在排除了106名患者(15.0%)未知突变状态的分析(没有可用样本或样本未达到规定的质量指标),602名具有肿瘤测序结果的患者中有289名(48.0%)存在AKT信号通路突变。共有313名患者(44.2%)被确认为AKT信号通路非突变型肿瘤(表1)。
表1.患者基线特征。
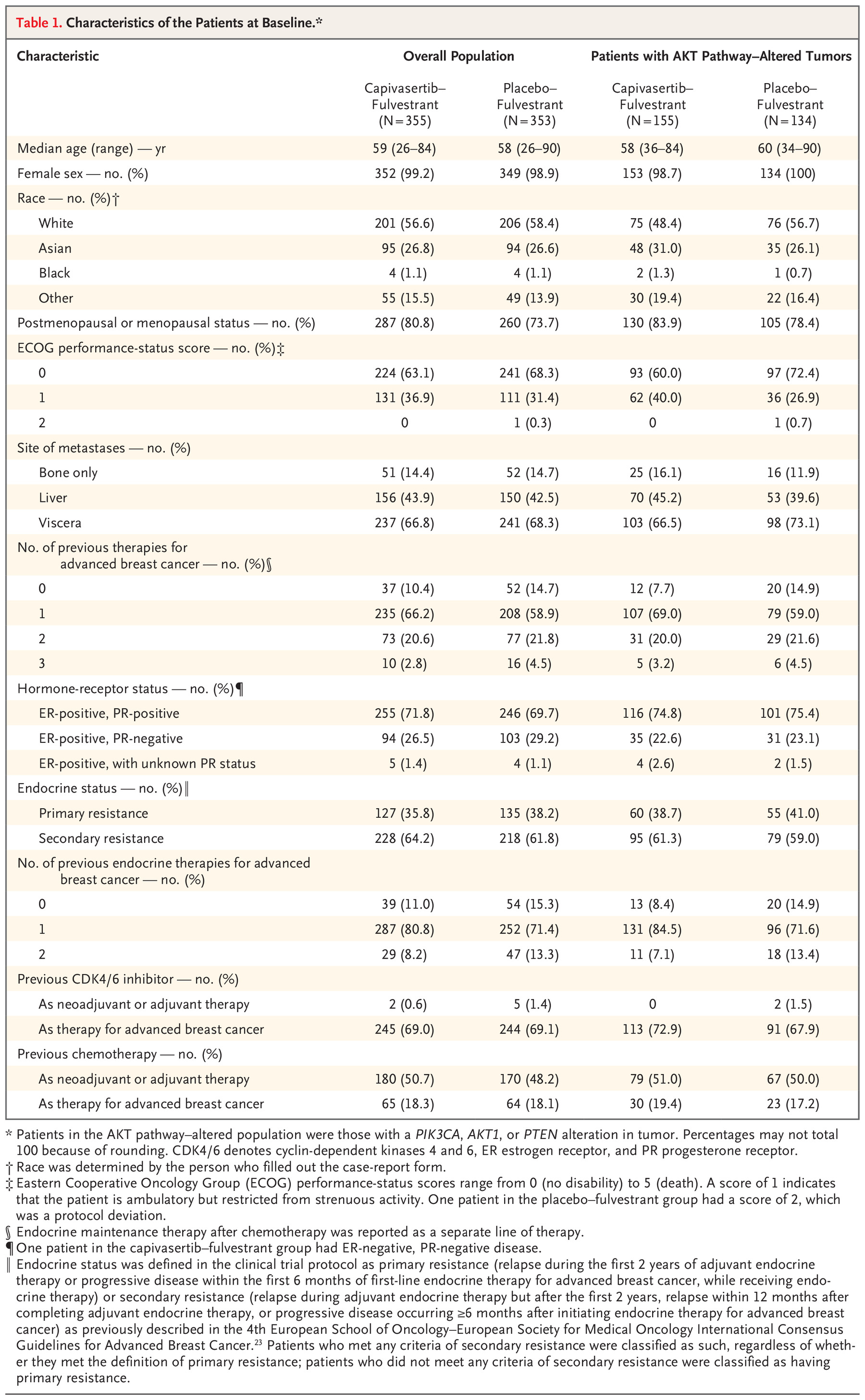
两个试验组在两个人群中的基线特征基本平衡(表1)。23患者的中位年龄为58岁(范围为26至90岁),77.3%的患者为绝经后的女性。所有患者均为HER2阴性疾病,69.1%的患者此前接受过CDK4/6抑制剂治疗,18.2%的患者此前接受过晚期癌症化疗。患者的人口统计学特征在很大程度上代表了激素受体阳性、HER2阴性乳腺癌患者的特点(表S2)。
治疗
在主要分析(数据截止日期为2022年8月15日)时,63名患者(17.7%)继续接受卡匹曲塞替治疗,而43名患者(12.3%)继续接受安慰剂治疗。卡匹曲塞替治疗的中位持续时间为5.4个月。安慰剂-氟维司群组患者接受安慰剂的中位持续时间为3.6个月。卡匹曲塞替联合氟维司群组的氟维司群治疗中位持续时间为5.8个月,安慰剂-氟维司群组的中位持续时间为3.7个月。
卡匹曲塞替治疗在292名患者(82.3%)中停止,安慰剂治疗在307名患者(87.7%)中停止。卡匹曲塞替或安慰剂停止治疗的主要原因是疾病进展,卡匹曲塞替联合氟维司群组有209名患者(58.9%)发生疾病进展,安慰剂-氟维司群组有273名患者(78.0%)发生疾病进展。
疗效
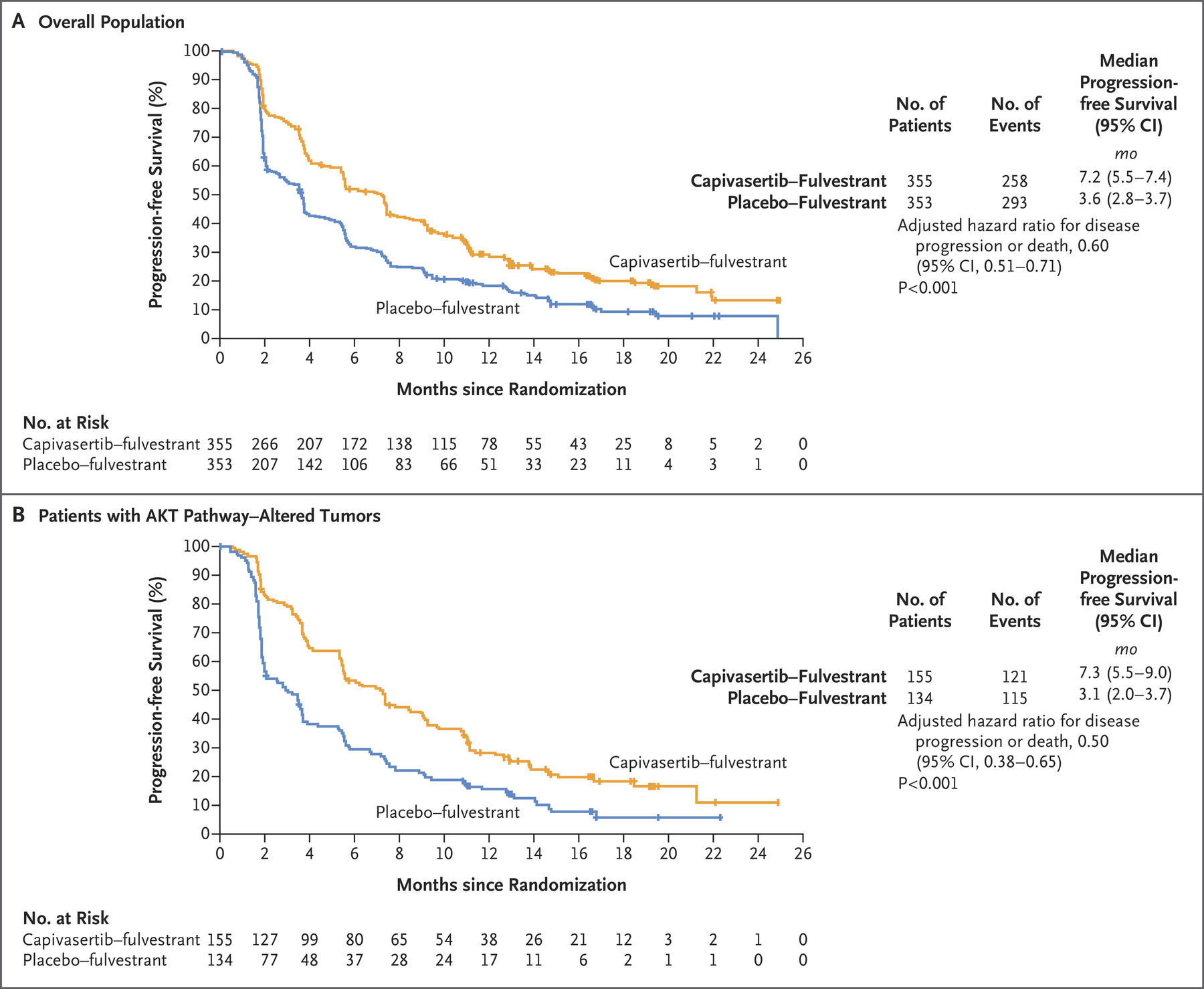
图1.全体人群和具有AKT信号通路突变肿瘤的患者的研究者评估的无进展生存期。
主要分析在发生551例疾病进展或死亡事件后进行(卡匹曲塞替-氟维司群组258例事件,安慰剂-氟维司群组293例事件)。在全体人群中,根据研究者的评估,卡匹曲塞替-氟维司群组的中位无进展生存期为7.2个月,而安慰剂-氟维司群组为3.6个月(进展或死亡的风险比为0.60,95%置信区间[CI]为0.51至0.71;P<0.001)(图1A)。在具有AKT信号通路突变的人群中,发生了236例进展或死亡事件(卡匹曲塞替-
氟维司群组121例事件,安慰剂-氟维司群组115例事件),卡匹曲塞替-氟维司群组的中位无进展生存期为7.3个月,而安慰剂-氟维司群组为3.1个月(风险比为0.50,95% CI为0.38至0.65;P<0.001)(图1B)。
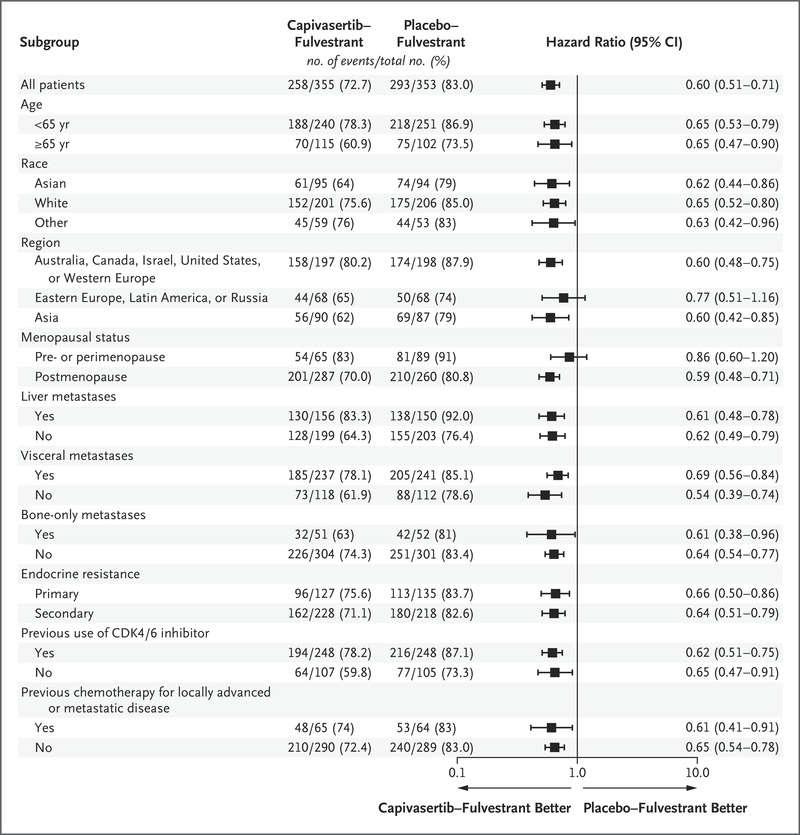
图2.全体人群中研究者评估的无进展生存期的亚组分析。
在图S2中显示了对AKT信号通路非突变肿瘤的无进展生存期的探索性分析,包括那些在下一代测序中结果未知的患者(419名患者;按照严格遵循方案分析的进展或死亡的风险比为0.70,95% CI为0.56至0.88);对于AKT信号通路非突变肿瘤的患者,排除那些在下一代测序中结果未知的患者(313名患者;风险比为0.79,95% CI为0.61至1.02);以及对于在下一代测序中结果未知的患者(106名患者;事后分析的风险比为0.52,95% CI为0.32至0.83)。图2和图S3显示了无进展生存期的亚组分析。图S4显示了具有和未接受CDK4/6抑制剂治疗史的患者的无进展生存期。还根据盲法独立中央评估进行了无进展生存期的评估,结果与研究者评估的分析高度一致,无论是在全体人群(风险比为0.61,95% CI为0.50至0.73)还是在具有AKT信号通路突变肿瘤的人群中(风险比为0.51,95% CI为0.38至0.68)(图S5)。表S3显示了具有客观缓解的患者的百分比。
安全性
表2.
总体人群中最常见的不良事件(安全人群)。
安全人群包括接受卡匹曲塞替-氟维司群治疗的355名患者和接受安慰剂-氟维司群治疗的350名患者。卡匹曲塞替-氟维司群组中报告的任何级别的最常见不良事件包括腹泻(占患者的72.4%,相对于安慰剂-氟维司群组的20.0%)、皮疹(作为一个综合术语;分别为38.0%和7.1%)以及恶心(分别为34.6%和15.4%)(表2)。任何级别的高血糖发生在接受卡匹曲塞替-氟维司群治疗的患者中的16.3%,而在接受安慰剂-氟维司群治疗的患者中的3.7%。最常报告的3级或更高级别的不良事件包括皮疹(作为一个综合术语;分别为卡匹曲塞替-氟维司群组的12.1%和安慰剂-氟维司群组的0.3%)、腹泻(分别为9.3%和0.3%)以及高血糖(分别为2.3%和0.3%)。AKT信号通路突变人群中卡匹曲塞替-氟维司群的安全性与总体人群相似。
严重不良事件发生在接受卡匹曲塞替-氟维司群治疗的57名患者(16.1%)和接受安慰剂-氟维司群治疗的28名患者(8.0%)(表S4)。由于不良事件导致的死亡在接受卡匹曲塞替-氟维司群治疗的4名患者中发生(分别由急性心肌梗死、脑出血、吸入性肺炎和败血症导致)以及接受安慰剂-富维生酸氟维司群治疗的1名患者(由于2019冠状病毒病)。根据当地调查者的评估,所有死亡事件均不被认为与卡匹曲塞替或氟维司群有关。
讨论
这项双盲、3期、随机对照试验(CAPItello-291)显示,将卡匹曲塞替添加到氟维司群治疗中,能显著改善激素受体阳性、HER2阴性晚期乳腺癌患者的无进展生存期,这些患者在之前的芳香化酶抑制剂治疗中出现进展,可能合并CDK4/6抑制剂使用或未使用。安全性资料显示,腹泻和皮疹是最常见的不良事件,因不良事件而中止治疗的发生率相对较低。
卡匹曲塞替的安全性与其他靶向PI3K-AKT-PTEN通路的药物相比,在这一患者人群中表现出色。在BOLERO-2试验中,依维莫司治疗引起口腔炎(根据CTCAE第3.0版定义),其中任何级别的事件发生率为59%,3级及以上的事件发生率为8%,尽管随后实施的指南建议使用地塞米松漱口水以管理毒副作用,降低了该事件的发生率。在SOLAR-1试验中,阿曲莫司治疗引起高血糖(根据CTCAE第4.03版定义),其中任何级别的事件发生率为64%,3级及以上的事件发生率为37%,导致了高的中止治疗率。尽管BOLERO-2、SOLAR-1和CAPItello-291试验中不良事件的发生率不能直接进行比较,因为使用了不同版本的CTCAE,并且试验之间存在固有差异,但是与卡匹曲塞替相比,口腔炎和高血糖的发生率和程度较低。CAPItello-291试验采用了卡匹曲塞替的间歇给药方案,这是在临床开发的早期选择的,部分原因是基于临床前模型,旨在最大程度地抑制AKT并优化治疗窗口。卡匹曲塞替的较低毒副作用水平和低发生率的高血糖可能反映了这种间歇给药方案。
在CAPItello-291试验中,我们发现与单独使用氟维司群相比,添加卡匹曲塞替治疗显著改善了激素受体阳性晚期乳腺癌患者的无进展生存期,这些患者在之前的内分泌治疗期间或之后出现疾病进展,可能合并CDK4/6抑制剂使用或未使用。腹泻和皮疹是接受卡匹曲塞替治疗的患者主要的不良事件。
原始出处:
Capivasertib in Hormone Receptor–Positive Advanced Breast Cancer,N Engl J Med 2023; 388:2058-2070 DOI: 10.1056/NEJMoa2214131
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)