首页 > 医疗资讯/ 正文
尽管人们认识到肠道微生物群在癌症化疗中起着临床重要作用,但对其机制的理解和转化研究仍然有限。最大化药物疗效需要深入了解微生物群如何有助于治疗反应,人体的复杂性阻碍了微生物群的调节。为了解决这个问题,武汉大学张先正教授及其团队报道了一个名为工程微生物群(EM)的3D实验模型,用于连接微生物-药物相互作用的研究和治疗决策。该研究成果以“A Microbial Community Cultured in Gradient Hydrogel forInvestigating Gut Microbiome-Drug Interaction and GuidingTherapeutic Decisions”为题发表在《Advanced Materials》期刊。该研究在体外操纵电镜,并在属/种水平上再现人类肠道微生物群,同时允许与细胞、类器官和分离的组织共培养,以测试药物反应。通过电镜对各种临床和实验药物的检查发现,肠道微生物群通过三个途径影响药物疗效:免疫效应、生物积累和药物代谢。在已发现的机制的指导下,采用定制的策略,最大限度地提高药物对具有患者来源的肠道微生物群的原位肿瘤模型的治疗效果。这些策略分别包括免疫协同作用、纳米颗粒封装和主客体复合体的形成。鉴于肠道微生物群在影响药物疗效方面的重要作用,EM很可能成为指导药物转化和临床决策的不可或缺的工具。

【多层水凝胶的设计】
合成一种具有多层结构的梯度水凝胶,使物质形成一个浓度梯度,以维持具有不同代谢需求的细菌的生存(图1a)。采用旋转涂层和光引发聚合制备多层水凝胶(图1b)。通过分层工程,获得了粘蛋白聚(4-苯二烯磺酸钠(PSS))-聚(乙二醇)二丙烯酸酯(PEGDA)肠道细菌和多烯丙胺盐酸盐(PAH)-PEGDA间隔排列的多层水凝胶(图1c)。荧光成像进一步证实了细菌与水凝胶的共存(图1d)。在已鉴定的469个化合物中,42.4%的化合物从上到下逐渐增加,16.7%的化合物逐渐减少(图1e)。由于肠道细菌产酸、耗氧,多层水凝胶也形成了pH和氧的浓度梯度(图1f)。细胞毒性实验表明,多层水凝胶的毒性较低(图1g)。
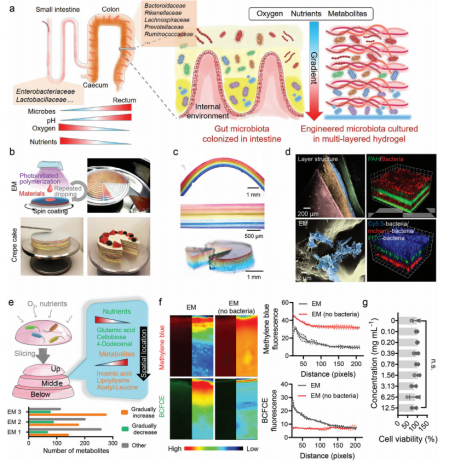
图1 EM的制备
【EM的分类组成】
在EM上进行了16S测序,并将其与液体培养群落(LCC)和水凝胶包封群落(HEC)进行了比较,经过短期LCC培养后,肠道微生物群的主要分类组成发生了显著变化(图2a)。,随着HEC的干预,一些细菌属的丰度也发生了变化,如乳杆菌属、异菌属和云杆菌科(图2b)。相比之下,EM维持了肠道微生物群的内稳态(图2c)。虽然人类肠道微生物群与小鼠肠道微生物群存在个体差异,但EM在很大程度上保留了不同患者肠道微生物群的不同特征(图2d)。PICRUSt2和BugBase的预测结果表明,EM的功能与体内肠道微生物群高度相似(图2f)。使用荧光原位杂交(FISH)探针在电镜中标记细菌。与预期的一样,具有不同代谢特征的细菌在水凝胶中分布不均匀(图2g)。因此,EM可以与需氧真核生物共培养,以研究宿主-微生物群的相互作用。
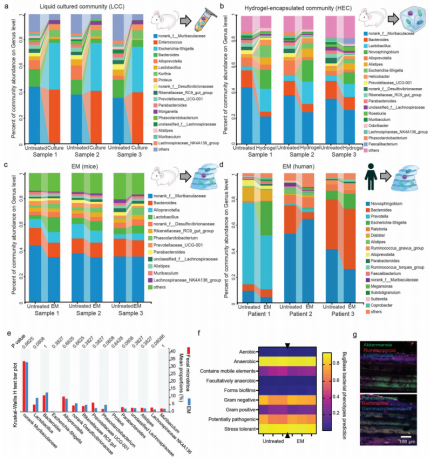
图2 EM的分类组成
【EM与宿主细胞共培养】
为了研究药物在微生物群的影响下对宿主的影响,有必要将EM与宿主细胞共培养。从六个方面评估了EM对细胞的影响:蛋白质合成、膜通透性、酶活性、抗原呈递、细胞运动性和细胞形态(图3a)。LCC处理使EGFPHEK293细胞的荧光强度降低了26.6%(图3b)。此外,在LCC处理后,膜不透性碘化丙啶(PI)的内化程度增加了2倍(图3c)。用荧光素二乙酸酯评价细胞内酯酶活性,LCC处理后酯酶活性降低了25%(图3d)。LCC和HEC提高了树突状细胞呈现卵清蛋白(257-264)表位的能力,这可能归因于细菌过度生长和功能失调的肠道微生物群引起的促炎作用(图3e)。划痕实验进一步表明,EM处理对细胞的迁移几乎没有影响(图3f)。与LCC或HEC处理的细胞相比,EM处理的细胞上触诊和微绒毛仍然均匀分布(图3g)。总的来说,在这三种模型中,EM具有最好的细胞相容性,支持与细胞进行强大的共培养(图3h)。通过将EM与分离的肠道组织共培养来评估其体外生物相容性(图3i)。肠道组织仍然保持着新鲜肠道的形态结构,肠道绒毛上覆盖着粘蛋白(Muc2)(图3j)。与新鲜肠道组织相比,在LCC培养的组织中有2700个基因的表达显著,但在EM组中仅发现了677个差异表达的基因(图3k)。反应组富集分析显示,LCC组有35个信号通路发生了变化,而EM组中只有两条途径富集,说明EM对肠道组织的影响与肠道微生物群的影响很接近(图3l)。
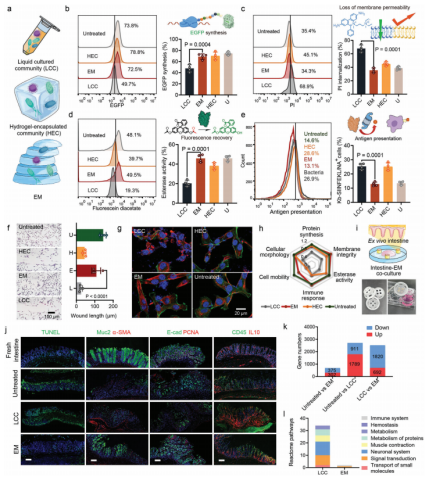
图3 宿主成分与EM共培养
【EM药物反应的研究】
作者接下来进一步研究了化疗药物对有/没有EM的肿瘤细胞的细胞毒性的差异(图4a)。与EM孵育后,米托蒽醌、甘替司匹布和CI1040的治疗效率分别降低了42%、30%和43%(图4b-e),而CB1954的治疗效率增加了60%。奥沙利铂对未处理小鼠的治疗效果优于抗生素(Abx)预处理的小鼠,而EM建模没有观察到显著差异(图4f)。在EM和肿瘤来源的类器官共培养后,奥沙利铂的治疗效果提高了,这与体内的结果一致。(图4g)。iNOS,促炎M1巨噬细胞的标志物的表达在EM处理的类器官中显著增加,提示肠道微生物群可以以免疫依赖的方式促进奥沙利铂的作用(图4h)。荧光成像也显示了米托蒽醌在细菌中的大量积累(图4i)。在小鼠中,米托蒽醌在肠道和粪便中显著富集(图4j)。分子动力学模拟结果表明,在人和大肠杆菌Hsp90中结合相似区域,构象能分别为−8.2和−7.37kal M−1(图4k)。CB1954的硝基被还原为一个氨基,可能是由于肠道微生物群中广泛表达的细菌硝基还原酶(图4l)。
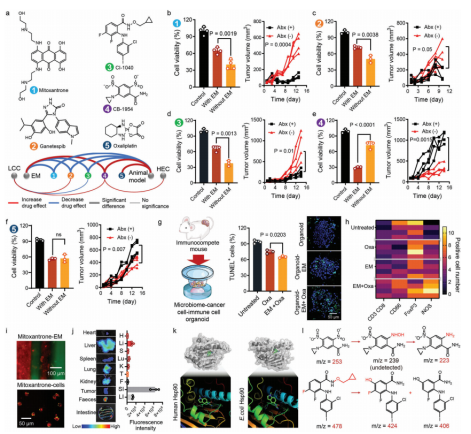
图4 药物效果的研究
【EM优化治疗方案】
利用EM,作者发现了肠道微生物群影响化疗结果的三种机制,即免疫作用(奥沙利铂)、药物生物积累(米托蒽醌、ganetespib)和药物代谢(CI1040,CB1954)(图5a)。将奥沙利铂与粒细胞巨噬细胞集落刺激因子(GM-CSF)联合治疗,治疗用人源化微生物群移植的原位结肠癌携带小鼠。检测到微弱的生物发光信号,显示协同治疗显著抑制了肿瘤的生长(图5b)。协同治疗组小鼠肿瘤大小局限于接种部位(图5c)。同时,协同处理也使CD8+ T细胞和单核细胞分别增加了16.7%和41.9%(图5d)。米托蒽醌负载纳米颗粒(Mit@PLGA)的水合尺寸为≈250nm,尺寸分布均匀(图5e)。包封策略显著减少了米托蒽醌在肠道和粪便中的积累(图5f)。随后,作者分析了Mit@PLGA对经人源化微生物群移植的乳腺癌携带小鼠的治疗效果(图5g)。分子力学模拟结果表明,β-环糊精(β-CD)和CI1040可以形成1:1的主客体复合物(CI1040⊂β-CD),亲和能为73.3 kcal mol−1(图5h),可以在分子水平上提供空间位阻。同时,CI1040⊂β-CD的细胞毒性也增加了26.5%(图5i)。在原位结肠癌小鼠模型中,CI1040⊂β-CD显著抑制了肿瘤的生长(图5j)。在EM揭示的机制指导下,成功地提高了CI1040的抗肿瘤疗效。
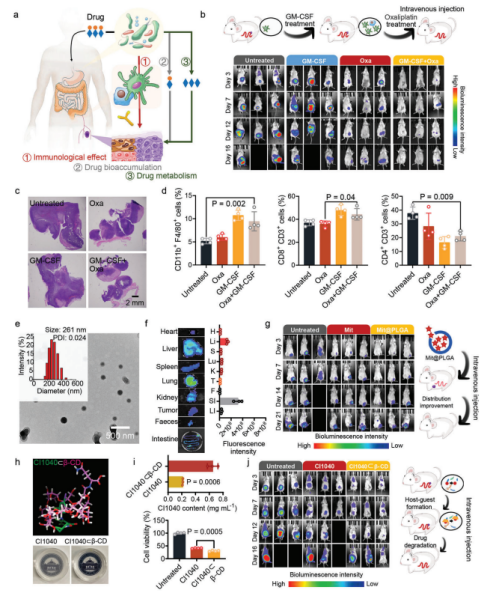
图5 优化治疗方案
【总结】
综上所述,本研究采用分层光聚合法开发了一种多层水凝胶。多层水凝胶具有异质环境,在体外稳定维持复杂肠道微生物群的分类组成。利用该模型研究了肠道微生物群对常用抗癌药物疗效的影响。在药物筛选实验中,发现肠道微生物群通过三种途径影响药物疗效:1)免疫效应,2)生物积累和3)药物代谢。对其机制的深入了解进一步指导了实验药物和商业药物的优化。在综合考虑肠道微生物群的情况下,进一步改进了米托蒽醌、CI1040、奥沙利铂的治疗方案。这些优化的治疗药物在具有患者来源的肠道微生物群的原位肿瘤模型中显示出优越的效果。
原文链接:
https://doi.org/10.1002/adma.202300977
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)