首页 > 医疗资讯/ 正文
CAR-T细胞疗法通过基因修饰患者自身T细胞识别并杀伤肿瘤细胞,在急性淋巴细胞白血病(ALL)、大B细胞淋巴瘤(DLBCL)等复发难治性血液肿瘤治疗中取得突破。FDA及NMPA批准的CAR-T产品多为第二代CAR,包含CD28或4-1BB共刺激结构域提升T细胞活性与持久性。目前,自体CAR-T制备费时且依赖患者自身免疫细胞,限制了其广泛应用和疗效稳定性。为突破此瓶颈,基因编辑技术助力开发同种异体CAR-T细胞,利用健康供体T细胞经过遗传改造,建立“现成”细胞库,可快速用于多名患者,降低生产复杂度及成本,提高治疗可及性。
本文系统总结了基因编辑同种异体CAR-T细胞的最新进展,重点分析其安全性挑战(如移植物抗宿主病[GVHD]与宿主抗移植物反应[HVGR])、关键基因编辑工具及临床试验数据,探讨未来转化方向。

同种异体CAR-T细胞主要面临GVHD与HVGR两大免疫安全风险。GVHD由供体T细胞通过其T细胞受体(TCR)识别宿主组织产生攻击,引发急慢性多器官损伤。基因编辑策略通过敲除TCR α链基因(TRAC)或β链基因(TRBC)抑制TCR表达,结合磁珠去除残余TCR阳性细胞,有效降低GVHD风险。然而,完全敲除TCR可能影响CAR-T体内存活和功能,需权衡优化。非αβT细胞如自然杀伤(NK)、γδT细胞、NKT细胞及细胞因子诱导杀伤(CIK)细胞等,因天然免疫特性而降低GVHD发生,逐渐成为研究热点。 HVGR源自宿主免疫系统对异体CAR-T细胞的识别与清除,主要由宿主T细胞识别供体细胞表面人类白细胞抗原(HLA)分子触发。基因编辑通过敲除β2-微球蛋白(B2M)阻断HLA-I表达,避免宿主T细胞攻击,但使CAR-T易被NK细胞识别。为此,融合B2M-HLA-E/G融合蛋白或保留部分非经典HLA分子增强逃逸NK细胞。针对HLA-II分子,敲除关键转录因子CIITA及相关基因降低其表达,减缓CD4⁺T细胞介导的排斥。CAR结构优化如表达免疫防御受体(ADR)亦能增强免疫耐受。
基因编辑技术概述
主流基因编辑工具包括蛋白指导的锌指核酸酶(ZFNs)、转录激活样效应核酸酶(TALENs)、天然内切酶(meganucleases)及RNA指导的CRISPR-Cas系统。其通过特异性诱导双链DNA断裂,启动非同源末端连接(NHEJ)或同源依赖修复(HDR)实现基因敲除/敲入。CRISPR-Cas9因设计简便、效率高被广泛应用,但需防范脱靶效应和染色体异常。新兴的碱基编辑(base editing)和精准编辑(prime editing)技术,无需产生双链断裂,降低基因组不稳定风险,成为未来趋势。
基因编辑的安全性管理
脱靶与基因组毒性是同种异体CAR-T应用的主要安全隐患。通用措施包括优化gRNA设计、使用高保真Cas9变体、缩短编辑暴露时间及采用核糖核蛋白递送系统。高灵敏度脱靶检测技术如DISCOVER-seq、PEAC-seq及单细胞多组学分析等,支持临床前及临床安全监控。长期随访发现CAR-T治疗后继发肿瘤风险增加,强调临床应用需严密监测和资料存档。
异体CAR-T细胞来源与亚群选择
异体CAR-T细胞主要来源包括供体外周血单个核细胞(PBMCs)、脐带血(UCB)及诱导多能干细胞(iPSCs)。 UCB T细胞具备更幼稚的免疫表型及低免疫原性,减少GVHD风险,但细胞量有限,需严格HLA匹配。iPSCs来源细胞具备无限扩增潜力和低免疫原性,且可实现均一化生产,但存在潜在肿瘤发生风险。 非传统T细胞亚群如γδT细胞、NKT细胞、CIK细胞及病毒特异性记忆T细胞(VSTs)展现天然免疫优势和低GVHD风险,部分已进入临床试验阶段,成为异体免疫细胞治疗的重要候选。
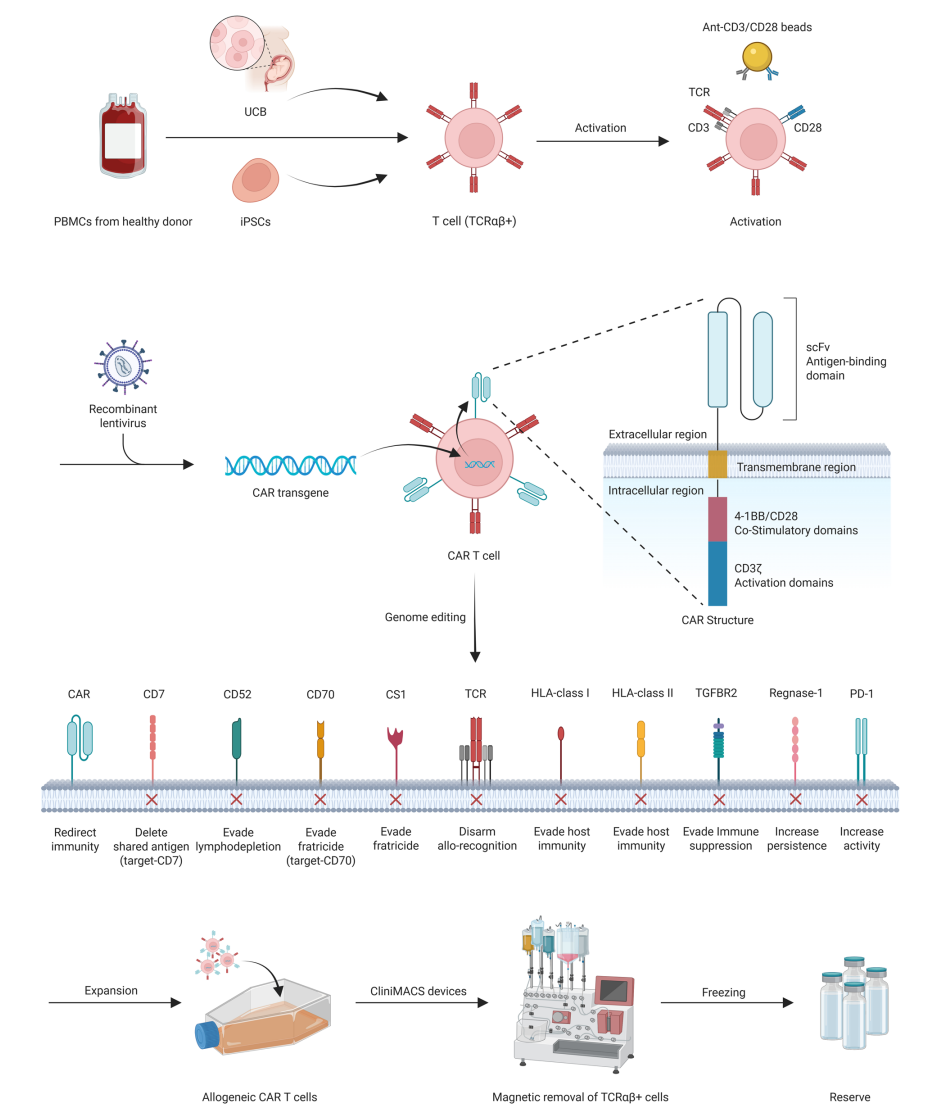
图:通用型异体CAR-T细胞的制备工艺与作用机制
基因递送平台创新
基因递送方法涵盖γ-逆转录病毒、慢病毒载体、转座子系统(如Sleeping Beauty、PiggyBac)、mRNA递送与DNA纳米载体等。近年来非整合性、低致突变风险的mRNA和DNA纳米载体技术迅速发展,为CAR-T生产提供安全高效的新路径。原位(in vivo)CAR-T细胞基因编辑技术通过靶向递送系统直接在体内转录表达CAR,极大缩短治疗周期、降低成本,并实现患者定制化,开启免疫治疗新纪元。
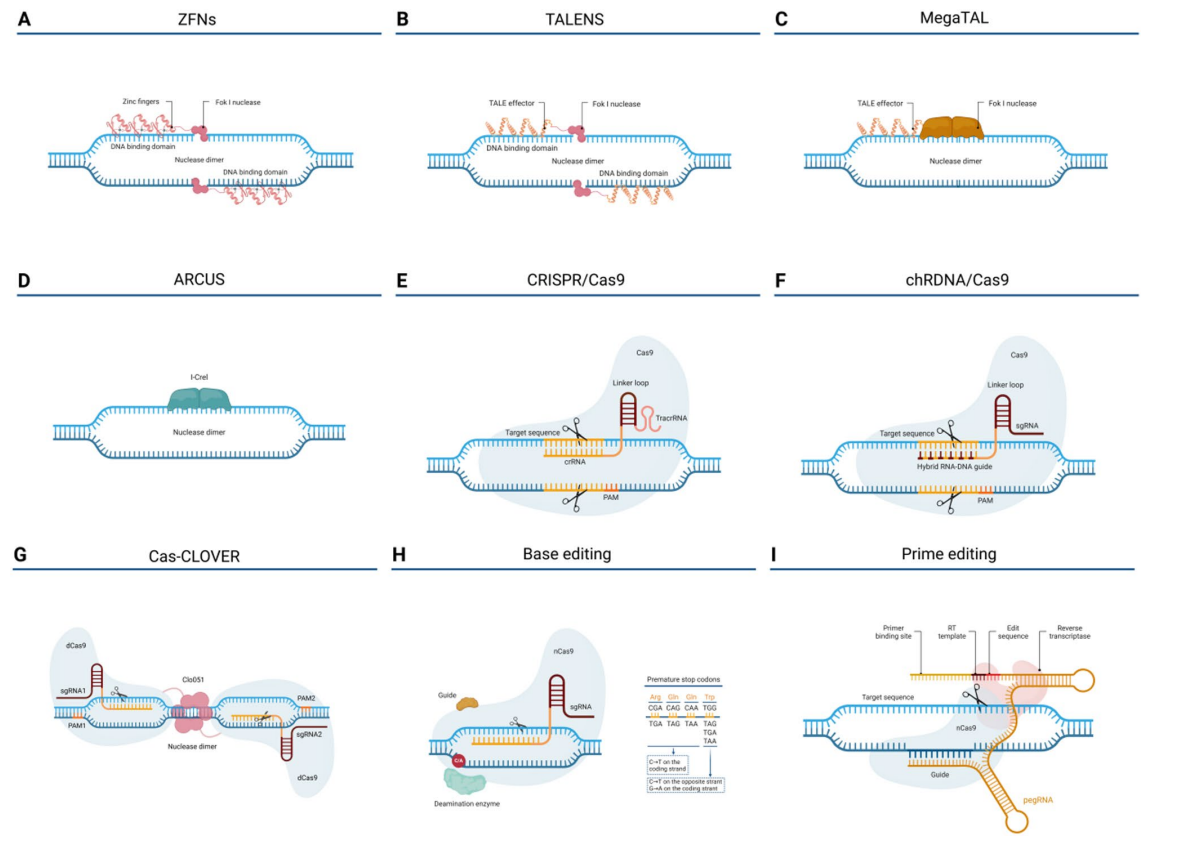
图:用于T细胞修饰的基因组编辑工具
临床试验进展
同种异体CAR-T细胞在血液肿瘤领域已取得显著疗效。针对CD19、CD22、BCMA、CD123、CD7及CD70等靶点的多款产品表现出良好安全性和抗肿瘤活性。多基因敲除(TRAC、CD52、B2M、PD-1等)结合优化的预处理方案推动疗效提升。 固态肿瘤中,TME的免疫抑制和细胞迁移障碍限制CAR-T疗效。基因编辑通过敲除TGFBR2、PD-1、Regnase-1等基因增强抗抑制能力,联合放疗、免疫检查点抑制剂和溶瘤病毒等多模态疗法,正成为研究热点。
未来展望
未来异体CAR-T发展方向包括:开发针对固态肿瘤高特异性新靶点(如Claudin18.2、GUCY2C、GPC3、ICAM-1)、多基因编辑策略提升细胞功能与耐受、结合精准免疫调节与代谢重编程,强化肿瘤穿透及持久杀伤能力。智能合成生物学设计可赋予CAR-T细胞环境感知与响应能力,实现靶向激活和微环境调控。 同时,原位CAR-T基因编辑技术将彻底革新治疗流程,降低治疗门槛,推动“现成即用”免疫细胞治疗走向临床常规。
原始出处
Su, J., Zeng, Y., Song, Z. et al. Genome-edited allogeneic CAR-T cells: the next generation of cancer immunotherapies. J Hematol Oncol 18, 90 (2025). https://doi.org/10.1186/s13045-025-01745-8
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)