首页 > 医疗资讯/ 正文
摘要:目的探索首选机械取栓在非急性症状性长节段颈内动脉闭塞(ICAO)血管内治疗患者中应用的安全性和可行性。方法回顾性连续纳入2019年1月至2023年8月在吉林大学第一医院神经内科以机械取栓为首选血管内治疗方式的非急性症状性长节段ICAO患者。收集并记录所有患者的基线及临床资料,包括性别、年龄、卒中相关危险因素(高血压病、糖尿病、高脂血症、冠心病、既往卒中史、吸烟史、饮酒史)、入院美国国立卫生研究院卒中量表(NIHSS)评分、术前改良Rankin量表(mRS)评分、最近一次症状出现至股动脉穿刺时间、影像学确诊至股动脉穿刺时间、行高分辨率MR、右侧ICAO、残端形态(无残端、锥形残端、平钝残端、不规则残端)、颈内动脉远端反流情况(眼动脉段以上、海绵窦段或床突段、海绵窦段以下)、发病机制(大动脉粥样硬化、夹层)、麻醉方式(局部麻醉、全身麻醉)、手术时长(股动脉穿刺至血管成功再通时间或最后一次造影时间)、血管成功再通患者的原始病变部位、手术操作方式(抽吸+球囊扩张、抽吸+球囊扩张+支架取栓、抽吸+球囊扩张+支架置入、抽吸+球囊扩张+支架取栓+支架置入)、是否置入支架、置入支架数量、取出栓子患者例数、观察指标等。观察指标包括血管成功再通(术后即刻血管最狭窄处管腔狭窄率<50%且扩展脑梗死溶栓分级≥2c级)率、术中并发症(远端栓塞、症状性颅内出血、动脉穿孔)、围手术期病死率、术后30d卒中复发率、术后90d mRS评分。比较血管成功再通组与血管未成功再通组患者的基线及临床资料、观察指标。根据原始闭塞部位的不同将血管成功再通患者进一步分为单纯颅外病变、单纯颅内病变和串联病变,并比较其基线及临床资料、观察指标。结果(1)共纳入65例首选机械取栓的非急性症状性长节段ICAO血管内治疗患者,其中男57例,女8例,年龄39~80岁,中位年龄59(52,65)岁。52例(80%)患者血管成功再通;围手术期4例(6.2%)患者发生术中并发症,其中远端栓塞3例(4.6%),症状性颅内出血1例(1.5%),未发生动脉穿孔事件。无患者在围手术期死亡。术后30d的卒中复发率为7.7%(5/65),术后90d mRS评分0~4分,中位评分1.0(0.0,1.5)分。(2)血管成功再通组与血管未成功再通组非急性症状性长节段ICAO首选机械取栓治疗患者的基线及临床资料、观察指标的组间比较差异均无统计学意义(均P>0.05)。(3)血管成功再通患者中,单纯颅外病变者17例(32.7%),单纯颅内病变者18例(34.6%),串联病变者17例(32.7%),单纯颅外病变患者的原始病变部位均位于颈内动脉起始部(C1段;17/17),单纯颅内病变患者的原始病变部位主要位于C4段(9/18),串联病变患者原始病变部位主要位于C1段+C4~C5段(16/17)。不同原始病变部位患者中,单纯颅内病变患者年龄更小[57(48,61)岁比60(52,64)、63(58,69)岁,P=0.050]、右侧ICAO比例更低(4/18比11/17、11/17,P=0.032),串联病变患者置入支架数量更多[2.0(1.0,2.0)枚比1.0(1.0,1.5)、1.0(0.8,2.0)枚,P=0.013]。单纯颅外病变、单纯颅内病变及串联病变患者取出栓子的患者比例分别为17/17、17/18、12/17,差异有统计学意义(P=0.024)。不同原始病变部位的患者既往史、残端形态、颈内动脉远端反流、手术方式、手术时长、麻醉方式、观察指标等方面差异均无统计学意义(均P>0.05)。结论首选机械取栓对非急性症状性长节段ICAO进行血管内治疗可能是安全、可行的。非急性症状性长节段ICAO患者的原始病变部位主要涉及颈内动脉的起始部和海绵窦段。本研究结论尚需进一步验证。
多项研究表明,血管内治疗对于症状性颈内动脉闭塞(internal carotid artery occlusion, ICAO)是安全、可行的,并可改善患者的神经认知功能[1-4]。目前,ICAO的血管内治疗方式多为直接血管成形术[1,5-8]。有研究报道,在非急性ICAO行颈动脉内膜切除术患者闭塞的颈动脉管腔中取出大量血栓[9]。临床实践中在非急性症状性ICAO患者闭塞血管的管腔中可以取出血栓。有研究表明,急性缺血性卒中行机械取栓后的血栓残留可导致血管再闭塞[10],急性心肌梗死经皮冠状动脉介入治疗后组织脱垂可导致支架内血栓形成[11]。目前ICAO的血管内治疗多为在微导丝进入远端血管真腔后直接进行球囊扩张和(或)支架置入,该操作可能导致血栓残留和组织脱垂,增加血管再狭窄和再闭塞的发生风险[10-11]。因此,对于非急性ICAO在血管成形前进行管腔内血栓清除或可降低血管再狭窄或再闭塞的发生率,从而预防远期卒中复发。然而,首选机械取栓在非急性症状性长节段ICAO血管内治疗中的应用报道相对较少。因此,本研究拟探索首选机械取栓在非急性症状性长节段ICAO血管内治疗中应用的安全性和可行性。
1 对象与方法
1.1 对象
回顾性连续纳入2019年1月至2023年8月于吉林大学第一医院神经内科行血管内治疗的ICAO患者。本研究方案经吉林大学第一医院医学伦理委员会审核批准[伦理审批号:2024年临审第(2024-478)号]。所有患者或其家属签署了诊疗知情同意书。
纳入标准:(1)年龄≥18岁;(2)经DSA证实为ICAO,即扩展脑梗死溶栓(expanded thrombolysis in cerebral infarction, eTICI)分级0级且患侧大脑半球具有通过前交通动脉或后交通动脉或眼动脉途径的侧支代偿[12];(3)非急性ICAO,定义为末次症状出现至股动脉穿刺时间>24h的ICAO;(4)症状性ICAO,定义为过去6个月内受累颈内动脉供血区发生急性脑缺血事件[13];(5)长节段ICAO,定义为从颈内动脉起始处开始,至少连续两个节段的颈内动脉在DSA图像中未完全显影;(6)以机械取栓为血管内治疗的首选治疗方案。
排除标准:(1)合并烟雾病或同侧大脑中动脉闭塞;(2)合并肿瘤或其他疾病,预期生存时间少于1年。
1.2 资料收集
收集患者的基线资料,包括性别、年龄、卒中相关危险因素[高血压病[14]、糖尿病[15]、高脂血症[16]、冠心病[17]、既往卒中史、吸烟史(终身吸烟量≥100支)、饮酒史(每月饮酒至少1次且持续饮酒1年以上)]。收集患者临床资料,包括入院美国国立卫生研究院卒中量表(NIHSS)评分[18]、术前改良Rankin量表(mRS)评分[19]、最近一次症状出现至股动脉穿刺时间、影像学确诊至股动脉穿刺时间、行高分辨率MR、右侧ICAO、残端形态(无残端、锥形残端、平钝残端、不规则残端)、颈内动脉远端反流情况(眼动脉段以上、海绵窦段或床突段、海绵窦段以下)、发病机制(大动脉粥样硬化、夹层)、麻醉方式(局部麻醉、全身麻醉)、手术时长(股动脉穿刺至血管再通时间或最后一次造影时间)、血管成功再通患者的原始病变部位、手术操作方式(抽吸+球囊扩张、抽吸+球囊扩张+支架取栓、抽吸+球囊扩张+支架置入、抽吸+球囊扩张+支架取栓+支架置入)、是否置入支架、置入支架数量、取出栓子患者例数及观察指标。
1.3 治疗过程
所有患者在术前至少口服3d抗血小板聚集药物(双抗)。手术在全身麻醉或局部麻醉下进行。置入8F股动脉鞘之后,静脉注射3000U肝素,并且每隔1h静脉注射2000U肝素,直至手术结束。(1)采用同轴技术将导引导管送至颈总动脉远端;(2)采用导引导管或长鞘对颈内动脉C1段进行抽吸取栓,若泥鳅导丝通过颈内动脉C1段时无阻碍,则同轴跟进多功能导管及导引导管至C1段远端,若导引导管通过颈内动脉起始处困难,则先将多功能导管通过起始闭塞处至C1段中段,确认血管真腔后利用300cm微导丝交换撤出多功能导管,在球囊辅助下将导引导管送至颈内动脉C1段远端,然后撤出长鞘内器械,采用20ml注射器经长鞘由远及近或由近及远负压反复抽吸;(3)采用中间导管对颈内动脉远端进行抽吸取栓,若导引导管抽吸后颈内动脉仍闭塞或仍存在血栓,则将中间导管经长鞘送入至颈内动脉远端,通过中间导管在颈内动脉C2~C4段反复负压抽吸直至无栓子取出为止;(4)采用取栓支架对颈内动脉远端进行机械取栓,若中间导管抽吸后血管转折处仍有血栓或颈内动脉远端仍闭塞,则将微导丝、微导管通过病变处送至闭塞血管远端真腔,然后将取栓支架置于病变处造影,明确病变性质并联合中间导管进行取栓,取栓操作过程中任何一步只要可取出栓子被取尽则进行第5步;(5)若取栓后颈内动脉颅内段残余狭窄狭窄率≥70%[华法林-阿司匹林治疗症状性颅内疾病(warfarin-aspirin symptomatic intracranial disease, WASID)标准[20]],则将300cm微导丝送至闭塞血管远端真腔,选择直径为正常血管管腔直径50%~80%的球囊对病变部位进行扩张,若病变血管管腔成形不佳或形成限制血流的夹层,则根据血管直径选择置入合适规格的支架;(6)颈内动脉颅内段血管成形后若颈内动脉起始处存在动脉粥样硬化性狭窄或夹层,则根据血管直径选取合适规格的球囊扩张后进行颈动脉支架置入。术后即刻造影,最狭窄处管腔狭窄率<50%且前向血流eTICI分级≥2c级为血管成功再通,即结束手术。对于血管未成功再通患者,于狭窄部位进行再次血管成形(球囊扩张或支架置入)或对远端栓塞血管进行机械取栓、动脉溶栓等补救措施后结束手术。术后双抗治疗6个月后改为单抗长期维持。
1.4 分组、观察指标及随访
所有患者根据术后即刻血管再通情况分为血管成功再通组与血管未成功再通组。血管成功再通定义为术后即刻颈内动脉最狭窄处管腔狭窄率<50%且术后即刻eTICI分级≥2c级,血管未成功再通定义为术后即刻eTICI分级<2c级。根据原始病变部位将血管成功再通患者进一步分为单纯颅外病变、单纯颅内病变及串联病变患者。比较血管成功再通组和血管未成功再通组及血管成功再通组不同病变部位患者的基线及临床资料、观察指标。观察指标包括血管成功再通率、术中并发症发生率、围手术期病死率、术后30d卒中复发率、术后90d mRS评分。症状性颅内出血定义为存在颅内出血且NIHSS评分较治疗前增加≥4分[21]。卒中复发定义为有新发的神经功能缺损或原有的症状或体征加重,持续时间>24h,并经神经影像学检查(包括CT或MR)证实有可归因的新缺血灶[22]。观察指标评定由神经内科医师于血管内治疗术中、住院期间评估,术后30d卒中复发、术后90d mRS评分通过电话或门诊随访完成。
1.5 统计学分析
使用SPSS 26.0软件对所有数据进行统计学分析。采用Kolmogorov-Smirnov方法对计量资料进行正态性检验,符合正态分布的计量资料以x-±s表示,两组间比较采用t检验,不符合正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验;分类变量以例(%)或例表示,两组间比较采用χ2检验或Fisher确切概率法。多组间比较采用Kruskal-Wallis检验。以P≤0.05为差异有统计学意义。
2 结果
共纳入65例首选机械取栓的非急性症状性长节段ICAO行血管内治疗患者,其中男57例,女8例,年龄39~80岁,中位年龄59(52,65)岁,其中血管成功再通组52例(80%),血管未成功再通组13例(20%);血管成功再通患者中,单纯颅外病变患者17例(32.7%),单纯颅内病变患者18例(34.6%),串联病变患者17例(32.7%)。血管未成功再通患者均为导丝未能到达远端血管真腔。
所有患者中,23例(35.4%)最后一次症状出现至股动脉穿刺时间≥30d,15例(23.1%)患者影像学确诊至股动脉穿刺时间≥30d。17例(26.2%)患者颈内动脉无残端,3例(4.6%)患者颈动脉远端反流至海绵窦段以下。
血管成功再通患者中4例(6.2%)发生术中并发症,其中远端栓塞3例(4.6%),3例远端栓塞患者通过补救措施(机械取栓、动脉溶栓)后血管均成功再通,未新增临床症状;术中症状性颅内出血1例(1.5%),未发生动脉穿孔事件;无患者在围手术期死亡。术后30d卒中复发率为7.7%(5/65),术后90d mRS评分0~4分,中位评分为1.0(0.0,1.5)分。见表1。
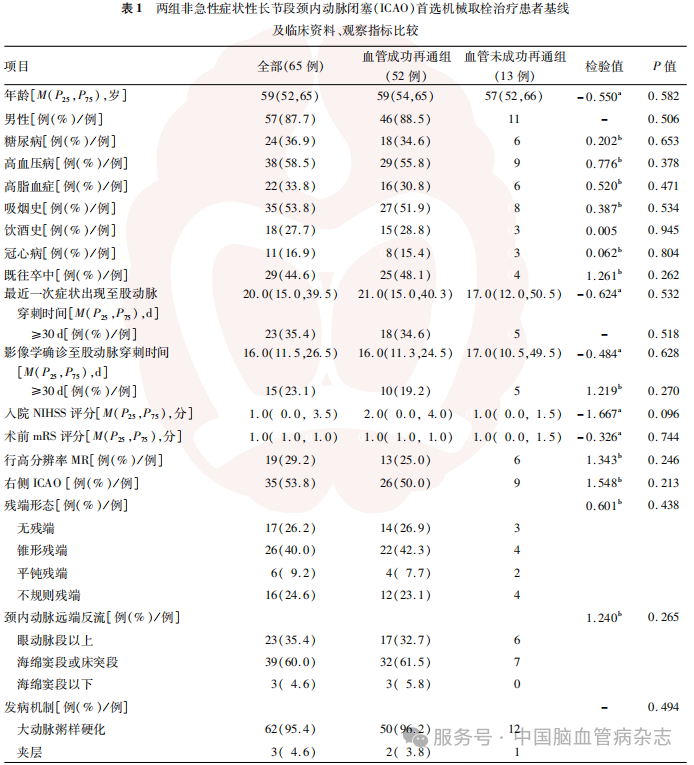
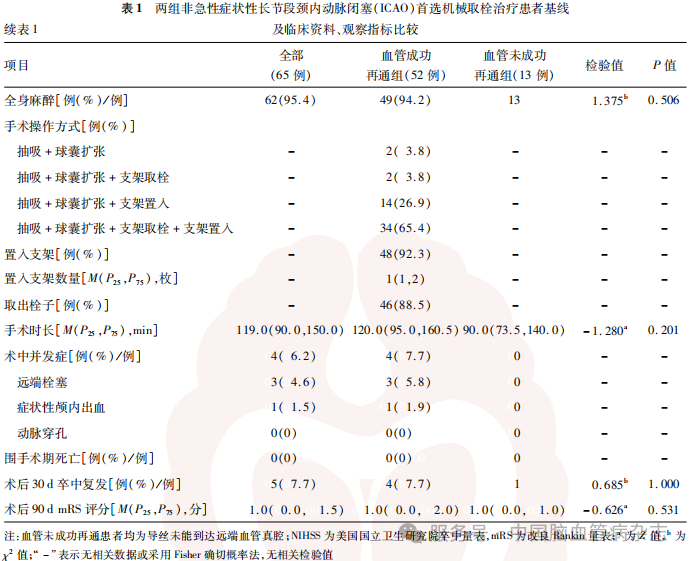
2.1 血管成功再通组与血管未成功再通组患者基线及临床资料、观察指标比较结果
血管成功再通组与血管未成功再通组非急性症状性长节段ICAO首选机械取栓行血管内治疗患者的基线及临床资料、观察指标的组间比较差异均无统计学意义(均P>0.05)。见表1。
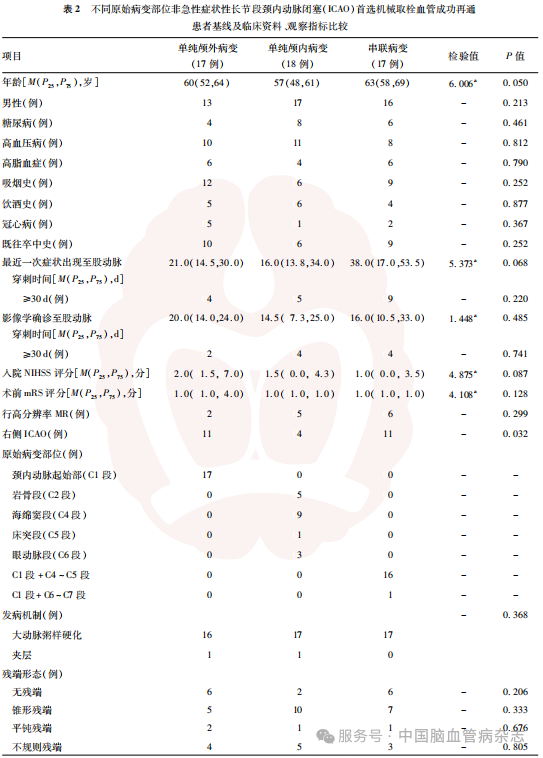
2.2 不同原始病变部位血管成功再通患者基线及临床资料、观察指标比较结果
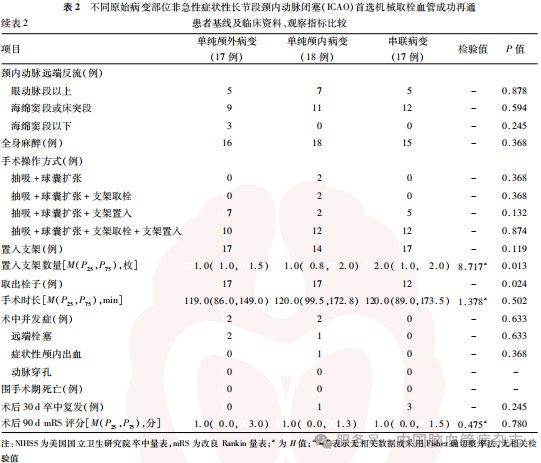
单纯颅内病变患者的原始病变部位主要位于C2、C4、C5、C6段,分别占5/18、9/18、1/18、3/18。串联病变患者原始病变部位位于C1段+C4~C5段和C1+C6~C7段,分别占16/17和1/17,单纯颅外病变患者的原始病变部位均位于C1段(17/17)。不同原始病变部位的血管成功再通患者中,单纯颅内病变患者年龄更小(P=0.050)、右侧ICAO比例更低(P=0.032),串联病变患者置入支架数量更多(P=0.013)。单纯颅外病变、单纯颅内病变及串联病变患者取出栓子的患者比例分别为17/17、17/18、12/17,差异有统计学意义(P=0.024)。不同原始病变部位的患者既往史、残端形态、颈内动脉远端反流、手术方式、手术时长、全身麻醉、观察指标等方面差异均无统计学意义(均P>0.05)。见表2。
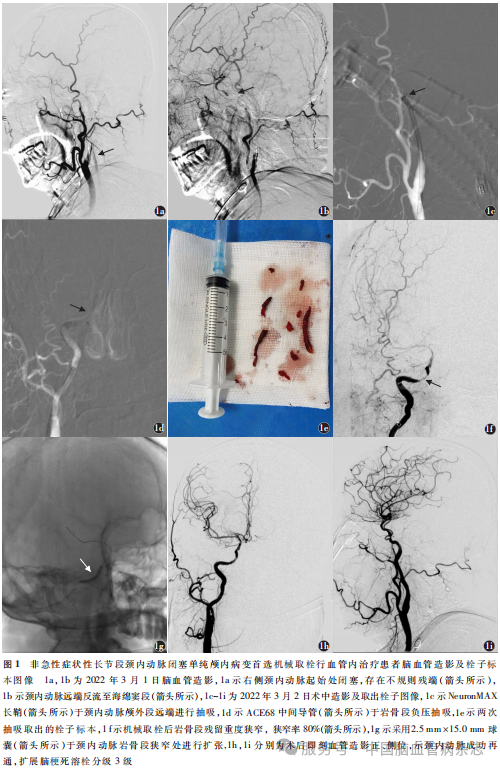
典型病例 男,48岁,主因“言语不清、肢体无力4d”于2022年2月18日入住吉林大学第一医院神经内科卒中中心。患者于入院前4d无明显诱因出现言语不清、肢体无力,表现为讲话含糊,上肢抬举费力,精细活动不灵活,下肢行走稍无力。既往高血压病史10余年,收缩压最高170~180mmHg,服用替米沙坦治疗,收缩压控制在140~150mmHg;糖尿病史10余年,使用胰岛素治疗,血糖控制不佳;脑梗死病史4个月,无明显后遗症;有饮酒史、吸烟史,否认相关疾病家族史。入院神经系统体格检查:意识清楚,构音障碍,右侧鼻唇沟变浅,左上肢肌力Ⅲ+级,左下肢肌力Ⅴ-级,左侧Babinski征阳性,余未见明显异常。入院NIHSS评分4分。入院后行营养神经、改善循环、抗血小板聚集等标准药物治疗。2022年3月1日脑血管造影检查提示右侧ICAO,存在不规则残端(图1a),颈内动脉远端反流至海绵窦段(图1b)。2022年3月2日行右侧ICAO血管内治疗,NeuronMAX长鞘(健适医疗)直接送至颈内动脉颅外段远端进行反复抽吸(图1c)。ACE68中间导管(健适医疗)于岩骨段负压抽吸(图1d),取出大量栓子(图1e)。取栓后造影显示岩骨段残余重度狭窄(狭窄率为80%;图1f)。2.5mm×15.0mm球囊(赛诺医疗)于颈内动脉岩骨段狭窄处进行扩张(图1g)。球囊扩张后造影示颈内动脉成功再通,eTICI分级3级(图1h,1i)。股动脉穿刺至血管成功再通时间140min。术中未发生并发症。2022年3月7日,患者病情平稳后出院康复治疗,出院后予口服阿司匹林100mg/次,1次/d,氯吡格雷75mg/次,1次/d,阿托伐他汀10mg/次,1次/d。出院时神经系统体格检查:意识清楚,构音障碍,右侧鼻唇沟变浅,左上肢肌力Ⅳ-级,左下肢肌力Ⅴ-级,NIHSS评分3分。术后3个月电话随访仅言语欠流利,余无明显异常症状,mRS评分1分,无卒中复发。
3 讨论
本研究探索了首选机械取栓在非急性症状性长节段ICAO患者血管内治疗中应用的安全性和可行性。研究结果显示,患者的总体血管成功再通率为80%(52/65),术中并发症发生率为6.2%(4/65),无死亡患者,对于非急性症状性长节段ICAO患者血管内治疗中首选机械取栓可能是安全、可行的。此外,本研究显示,非急性症状性长节段ICAO首选机械取栓血管成功再通患者的原始血管闭塞部位主要累及C1段[32.7%(17/52)]、C4段[17.3%(9/52)]及C1段+C4~C5段[30.8%(16/52)]。非急性症状性ICAO的外科治疗方式主要包括颈内动脉内膜切除术、血管旁路移植术、血管内治疗、复合手术。颈内动脉内膜切除术仅可处理颈内动脉颅外段闭塞[23]。与标准药物治疗相比,血管旁路移植术的优势尚未得到证实[24-26]。尽管复合手术被认为是处理长节段ICAO病变的更优选择,但目前临床研究相对较少,循证证据尚不充分,且有研究显示,与单纯颈内动脉内膜切除术相比,复合手术的并发症发生率相对较高[8.6%(28/327)比4.3%(4568/105192),P<0.01][27]。血管内治疗是目前ICAO有前景的治疗方式之一。2020年一项纳入13项研究的Meta分析显示,慢性ICAO血管内治疗后血管成功再通率为72.6%(65.4%,79.9%),围手术期并发症发生率为12.6%(65/516),术后30d内病死率为2.1%(11/516)[28]。既往的研究中,纳入长节段ICAO的患者较少,治疗方法多为球囊扩张成形后进行支架置入[1,5-8]。理论上,ICAO病变节段越长,血管内治疗手术难度越大,但本研究结果显示,首选机械取栓行血管内治疗的非急性症状性长节段ICAO患者的血管成功再通率为80%(52/65),术中并发症发生率为6.2%(4/65),围手术期无死亡患者,提示首选机械取栓在非急性症状性长节段ICAO的血管内治疗中的应用是安全、可行的。
目前关于ICAO的机械取栓研究较少。Zhou等[29]关于慢性ICAO血管内治疗的研究仅提及对于在术前高分辨MR上发现管腔内存在不稳定血栓(非增强T1序列上高信号)者先进行抽吸取栓后再行血管成形术,但并未具体说明抽吸取栓的相关操作,该研究共纳入47例患者,血管成功再通(闭塞段经支架置入后残余狭窄率<30%,且术后即刻脑梗死溶栓分级3级)率为74.5%(35/47),围手术期并发症发生率为12.8%(6/47),病死率为6.4%(3/47)。Chen等[30]针对慢性ICAO的血管内治疗提出了慢性ICAO全同轴系统(chronic ICAO with a full coaxial system, COCO)技术,该技术主要强调导丝、造影导管、中间导管、长鞘四者同轴突破颈内动脉起始闭塞病变部位,尽管该技术在手术过程中同样有取栓操作,但需在颈内动脉远端球囊扩张出现反流后再抽吸取栓,最后分别在颈内动脉远端及近端进行支架成形,该操作可能导致栓子贴壁或栓子残留。该研究纳入了49例慢性ICAO患者,血管成功再通率为89.8%(44/49),血管成功再通患者的围手术期并发症发生率为13.6%(6/44),术后6个月病死率为2.0%(1/49)。虽然该研究血管成功再通率较本研究略高,但并发症发生率也相应增加,其中2例患者术中出现了动脉穿孔,这可能与该技术未降低血栓负荷而要求将导丝先送至远端血管真腔的操作有关。Luo等[31]提出了使用取栓支架进行颅内保护的慢性动脉闭塞再通技术(chronic artery occlusion recanalization with intracranial protection using stent retriever, COSIS),该技术要求取栓前需取栓支架放置于颈内动脉末端进行颅内血管保护,但若闭塞血管近端不预先进行血栓清除,微导丝很难通过病变段到达远端血管真腔。另外,由于中间导管内有微导丝,大块的血栓较难通过负压取出。Luo等[31]应用COSIS技术治疗慢性ICAO患者的血栓取出率为65.6%(21/32),低于本研究栓子取出率[88.5%(46/52)]。本研究结果提示,对于非急性长节段ICAO患者可优先抽吸取栓,以减轻血栓负荷,增加微导丝到达远端真腔的可能性,有助于提高栓子取出率。
除了增加防止栓塞的保护策略[8,32],既往ICAO的处理方式与颈内动脉起始处狭窄的处理方式几乎相同。对于长节段ICAO,DSA影像上未显影的部分并非均为动脉粥样硬化改变,本研究结果显示,17例单纯颅外段病变患者中16例为C1段动脉粥样硬化改变,1例为夹层,单纯颅内段病变闭塞位置多位于C4段(9/18),而串联病变闭塞部位多为C1段+C4~C5段(16/17)。除原始病变部位,其余管腔并无动脉粥样硬化改变,且DSA未显影的管腔中非原始病变部位的管腔内由于血液瘀滞,多存在血栓[33]。对于非急性ICAO患者,直接行球囊扩张可导致血栓脱落,支架置入后可能发生组织脱垂,而组织脱垂与支架内血栓形成相关。一项纳入418例急性心肌梗死行冠状动脉支架置入术患者的血管内超声研究显示,术后出现组织脱垂的患者急性[支架置入后24h内;3.5%(5/142)比0.7%(2/276),P=0.035]和亚急性[支架置入后24h至30d内;4.2%(6/142)比0.7%(2/276),P=0.013]支架内血栓形成发生率均高于无组织脱垂者[11]。因此,ICAO血管内治疗中优先行机械取栓有利于充分暴露原始病变,避免血栓脱落及组织脱垂,有助于对原始病变进行精准的血管成形,减少支架置入,降低远期血管再狭窄风险。
本研究显示,不同血管闭塞部位患者中,单纯颅内病变患者年龄更小,中位年龄为57(48,61)岁,考虑可能是颈内动脉颅内段管径较颅外段小,动脉粥样硬化导致闭塞所需时间较单纯颅外病变短所致[34];另外,单纯颅内病变发生右侧ICAO比例较小,考虑可能是右侧颈动脉较左侧走行更加迂曲,由于血流动力学原因在右侧颈动脉分叉处更易形成动脉粥样硬化改变[35]。串联病变涉及近端和远端病变,因此置入支架数量更多。不同原始病变部位非急性ICAO最后一次症状至股动脉穿刺时间≥30d患者的比例差异无统计学意义。有研究显示,随着闭塞时间不断延长,ICAO管腔内的血栓会逐渐机化[36],这可能是不同原始病变部位患者取出栓子的比例存在差异的原因。
首选机械取栓在非急性症状性长节段ICAO血管内治疗的有效性方面,由于本研究纳入患者例数较少,未能得出其对预防卒中或改善神经功能存在优势的结论,未来需进一步扩大样本量以探索。
本研究存在以下局限性:第一,本研究为单中心回顾性研究,研究类型本身存在一定局限性;第二,由于样本量较小,组间比较结果可能存在一定的偏倚;第三,部分患者术前缺少CT灌注及高分辨MR检查,术前评估不足。未来还需要更大样本量的研究对本研究结果进行验证。
4 结论
本研究表明,在非急性症状性长节段ICAO血管内治疗中首选应用机械取栓是安全、可行的,非急性症状性长节段ICAO的原始病变部位主要涉及颈内动脉起始部和海绵窦段。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)