首页 > 医疗资讯/ 正文
德曲妥珠单抗是一种抗体偶联药物,最近获得美国食品药品监督管理局(FDA)批准,用于免疫组化检测HER2表达为3+的晚期实体瘤的二线治疗。临床试验表明,德曲妥珠单抗有望用于治疗晚期妇科恶性肿瘤,这类肿瘤通常预后较差且治疗选择有限。本文报告了 3 例HER2阴性(免疫组化 0)或未检测HER2状态的HER2突变型妇科肿瘤患者,从德曲妥珠单抗治疗中获得了显著获益。已获得患者参与本研究的知情同意,并通过电子病历对其病例进行了回顾。本报告描述了相关的临床、手术、病理及影像学资料。这些HER2突变型疾病患者尽管HER2免疫组化阴性(0)或未检测,因此不符合该药物当前美国食品药品监督管理局批准的治疗标准,但仍从德曲妥珠单抗治疗中获益。第一例为一名 65 岁复发性高级别子宫内膜癌女性患者,接受德曲妥珠单抗治疗后无进展生存期超过 12 个月。第二例为一名 76 岁复发性低级别浆液性卵巢癌女性患者,接受德曲妥珠单抗治疗已超过两年,且在本文投稿时仍在继续治疗。第三例为一名 52 岁复发性宫颈中肾管腺癌女性患者,接受德曲妥珠单抗治疗后获得了 15 个月的部分缓解。这些病例表明,德曲妥珠单抗可能对超出当前指南范围的更广泛患者群体有用,并提示全面基因组检测对于帮助识别可能对HER2靶向治疗敏感的患者是必要的。
背 景
转移性妇科恶性肿瘤预后较差,美国食品药品监督管理局(FDA)批准的治疗选择有限。抗体偶联药物是一类令人关注的药物,在多种妇科恶性肿瘤中具有广泛适用性。其中一个例子是德曲妥珠单抗(T-DXd),该药于2023年8月获批,用于经免疫组化(IHC)检测HER2(又称ERBB2)表达为3+(即最高水平)的任何晚期实体瘤的二线治疗。德曲妥珠单抗的曲妥珠单抗部分与肿瘤细胞表达的HER2受体结合,随后受体-药物复合物被内吞。德鲁替康(一种拓扑异构酶I抑制剂)与抗体连接,对靶细胞发挥细胞毒性作用。研究还表明,德曲妥珠单抗对肿瘤微环境中邻近的非HER2表达细胞也具有细胞毒性作用,这可能是由于德鲁替康的膜通透性和/或肿瘤微环境中存在组织蛋白酶,后者可催化细胞外连接子裂解。
DESTINY-PanTumor02 II期试验证实了德曲妥珠单抗的疗效,该疗效支持其获得FDA批准。该试验入组了肿瘤经IHC检测HER2表达为1+、2+或3+的患者。该研究已发表的数据包括40例子宫内膜癌患者、40 例宫颈癌患者和40例卵巢癌患者,均为2+或3+表达。子宫内膜癌患者的客观缓解率(ORR)为57.5%,宫颈癌患者为 50.0%,卵巢癌患者为 45.0%。HER2 IHC 3+患者的缓解情况比2+肿瘤患者更显著。在所有纳入的实体瘤中,IHC 3+肿瘤患者的ORR为 51.4%,IHC 2+肿瘤患者为 26.5%。子宫内膜癌队列的中位缓解持续时间未达到,宫颈癌队列为 14.2 个月,卵巢癌队列为 11.3 个月。在所有研究的肿瘤类型中,妇科癌症患者的获益程度最大。在其他临床试验中,德曲妥珠单抗也显示出治疗妇科恶性肿瘤的前景。例如,STATICE试验表明,德曲妥珠单抗对HER2 IHC评分为1+、2+或3+的晚期或复发性子宫内膜癌肉瘤患者有效。这些结果提示,德曲妥珠单抗可能在HER2表达更广泛的患者群体中具有潜在作用。
HER2表达通常通过IHC检测。IHC 3+表达与HER2(ERBB2)基因扩增高度相关。在高危、转移性或复发性子宫内膜癌中,最近报道的HER2过表达率(通过IHC检测)在1+或2+水平为 17.2%,在3+水平为 7.9%。然而,在一项更广泛的人群队列研究中,采用≥1+标准判定的HER2“阳性”IHC频率高达 87%。另一项分析 2042 例子宫内膜癌的研究通过下一代测序(NGS)发现,HER2扩增在各亚型子宫内膜癌中的发生率为3.8%,其中浆液性癌为8%,癌肉瘤为 7.1%,透明细胞癌为6%,子宫内膜样癌为 0.2%。该研究还指出,HER2扩增与高级别组织学和TP53突变的相关性比与肿瘤细胞类型的相关性更强。
在确定HER2靶向治疗的合适患者人群时,进一步的复杂性源于HER2表达在同一患者不同时间的活检样本中可能存在差异。一项研究发现子宫内膜癌中存在HER2表达异质性,与原发肿瘤相比,转移灶中HER2表达缺失。该数据表明,从单次活检样本确定的肿瘤遗传和分子特征可能无法代表患者的整个疾病谱,并提示对复发病例的转移灶进行重复检测可能具有一定作用。
尽管HER2过度激活可由HER2扩增引起,但也可由HER2激活突变导致。HER2激活突变更为罕见,且并不总是与IHC阳性相关。通过NGS检测到的致病性HER2突变在所有癌症类型中约占 3.5%,其中子宫内膜癌中占 2.6%。德曲妥珠单抗已获FDA批准用于肿瘤携带HER2突变的肺癌患者,报告的总缓解率为 58%。DESTINY-PanTumor01试验入组患者的标准为通过NGS或PCR检测到预设的HER2激活突变(并排除任何IHC检测HER2表达为3+的肿瘤),结果显示所有肿瘤类型的ORR为 29.4%。然而,该试验仅纳入 6 例妇科恶性肿瘤患者,目前德曲妥珠单抗尚未基于HER2基因突变获批用于妇科恶性肿瘤。本文报告 3 例HER2突变患者——1 例低级别浆液性卵巢癌、1 例子宫内膜样子宫内膜癌和 1 例宫颈中肾管腺癌——对德曲妥珠单抗应答良好。
病例1
患者女,65 岁,诊断为复发性高级别子宫内膜癌,具有浆液性和子宫内膜样特征。初始手术显示病变局限于子宫和宫颈管,但随后的CT成像显示腹股沟淋巴结肿大,符合IV期疾病。患者接受了紫杉醇和卡铂治疗,影像学检查显示完全缓解。免疫组化染色显示ER和PR呈灶性表达,p53过表达,错配修复蛋白保留。HER2免疫组化染色阴性(0+),但下一代测序(NGS)显示HER2 p.G776V致病性突变。18个月后,影像学检查显示多发盆腔和腹膜后淋巴结以及大网膜和腹膜病灶,符合转移性疾病。随后,她在一项临床试验中接受基于检查点抑制剂的治疗后获得部分缓解,但 8 个月后疾病进一步进展。紫杉醇和卡铂重新给药 3 个月,治疗部分缓解,随后接受了包括贝伐珠单抗在内的另外两线细胞毒性化疗,但疾病进展。鉴于存在激活型HER2突变,患者随后开始接受德曲妥珠单抗治疗。治疗 6 周内,CA-125从 177 降至 23,CT成像显示转移性病灶体积缩小(图1)。患者继续接受德曲妥珠单抗治疗 12 个月,影像学检查显示疾病稳定、病灶体积小,CA-125水平在正常范围内(图2)。第 17 周期后,因血小板减少和高胆红素血症暂停德曲妥珠单抗,骨髓活检显示骨髓增生异常综合征(MDS)。5 个月后的CT成像显示子宫内膜癌进展。患者开始接受单药曲妥珠单抗治疗以减少血液学副作用。截至治疗 5 个月时,患者仍在接受该治疗,疾病稳定。该患者从确诊疾病转移至目前的总治疗时长为 4 年 5 个月。
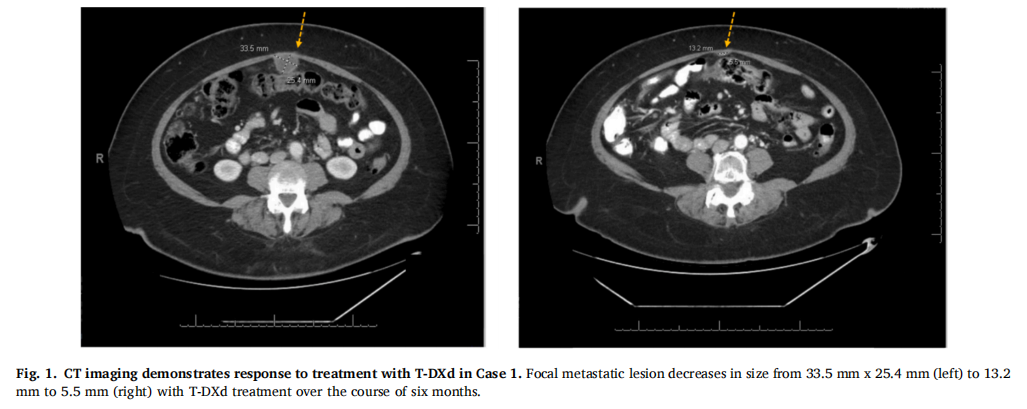
▲图1 CT成像显示病例1对T-DXd治疗有反应
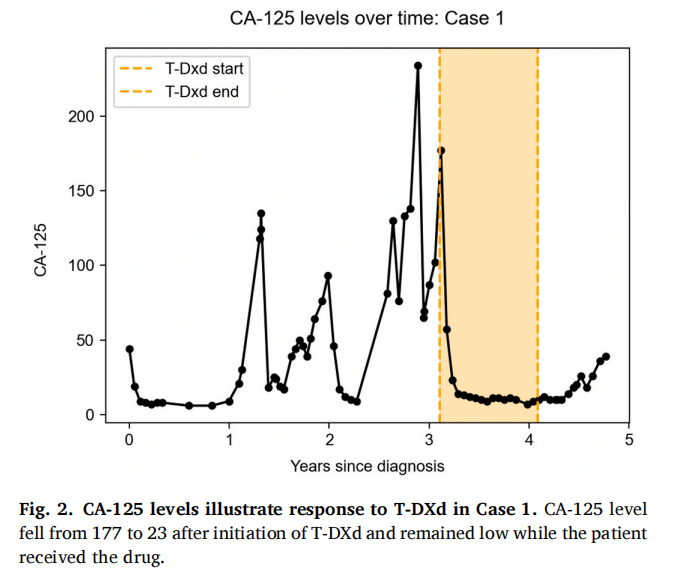
▲图2 CA-125水平表明病例1对T-DXd有反应
病例2
患者女,76 岁,诊断为复发性低级别浆液性卵巢癌,诊断性腹腔镜检查显示病灶无法切除。最初接受了两个周期的紫杉醇和卡铂治疗,随后接受了两个周期的吉西他滨和卡铂治疗,获得部分缓解。患者接受来曲唑治疗,病情稳定一年。随后,她接受了根治性肿瘤细胞减灭术,腹膜病灶被完全切除,盲肠内残留一个 2 cm的肿块。随后结肠镜检查证实结肠内存在多灶性低级别浆液性癌。在接下来的 12 个月内恢复来曲唑治疗,此时CA-125水平开始升高,重复结肠镜检查显示可能进展。随后开始口服环磷酰胺和贝伐珠单抗治疗,6 个月后疾病进展。下一代测序(NGS)显示HER2大片段缺失,包括全部第16外显子和部分第16内含子(HER2 c.1900_1946 + 854del)。第16外显子缺失导致HER2蛋白致癌性激活。约 5% 的低级别浆液性卵巢癌存在激活型HER2突变。对小转移灶进行的HER2免疫组化染色为阴性(IHC 0)。鉴于存在激活型HER2缺失,患者开始接受单药曲妥珠单抗治疗,病情稳定超过两年。随后,她在一项针对MAPK通路的临床试验中接受治疗 8 个月,期间癌症再次进展。此时,基于初始HER2突变和先前对曲妥珠单抗的良好生化应答,患者开始接受德曲妥珠单抗治疗。初始随访影像学检查显示部分缓解,系列PET扫描显示病灶摄取活性持续改善(图3)。患者接受德曲妥珠单抗治疗已超过两年,目前仍在继续。第 42 周期后,患者出现中性粒细胞减少症,需将给药频率从每三周一次调整为每四周一次。
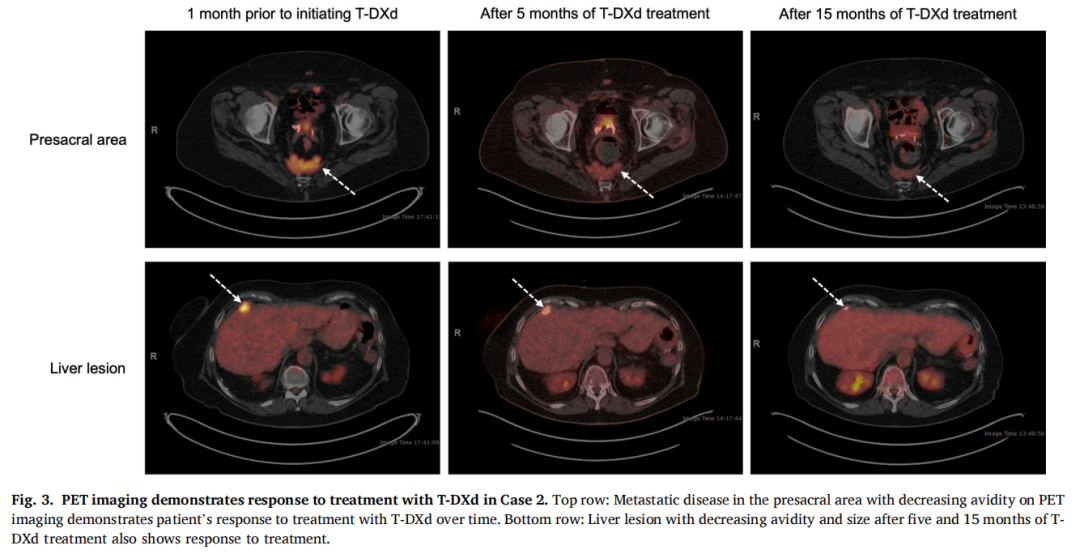
▲图3 PET成像显示病例2对T-DXd治疗有反应
病例3
患者女,52 岁,诊断为复发性宫颈中肾管腺癌。初始诊断为子宫或宫颈来源的高级别腺癌,临床分期推测为IIB期。患者接受了术前盆腔外照射放疗一个月,随后行机器人辅助全子宫切除术+双侧输卵管卵巢切除术+左侧宫旁组织切除+盆腔淋巴结清扫术。手术时盆腔淋巴结未见转移,患者术后无癌生存。患者接受了三个周期的辅助紫杉醇+卡铂化疗及阴道近距离放疗,随后失访。三年后,患者因腹痛就诊,CT成像显示癌性腹膜炎。活检证实为复发性宫颈中肾管腺癌。接受了 8 个周期的紫杉醇+卡铂+贝伐珠单抗+帕博利珠单抗治疗,获得部分缓解。之后接受贝伐珠单抗+帕博利珠单抗维持治疗一年,期间复查CT显示疾病进展,伴大网膜饼形成及癌性腹膜炎。下一代测序(NGS)显示HER2 p.I767M激活突变。未进行HER2免疫组化染色。患者开始接受德曲妥珠单抗治疗,约六周后的影像学检查显示治疗部分缓解。这种部分缓解状态持续至开始德曲妥珠单抗治疗 15 个月后疾病进展。德曲妥珠单抗的副作用包括胃肠道毒性和中性粒细胞减少症,需进行剂量调整。
讨 论
本文描述了 3 例携带HER2突变的妇科癌症患者:2 例肿瘤HER2免疫组化(IHC)表达水平为 0,1 例HER2 IHC表达水平未知,这些患者均对德曲妥珠单抗治疗产生了良好的临床应答。在这3例患者中,对于原本治疗选择有限的患者,德曲妥珠单抗治疗带来了 12-28 个月的无进展生存期。毒性反应与DESTINY-PanTumor02试验中常见的毒性反应一致。值得注意的是,病例1中的患者出现了骨髓增生异常综合征(MDS),这更可能与既往接受过四线细胞毒性化疗有关。据研究人员所知,尽管临床试验纳入了大量经过多线治疗的患者,但MDS尚未被报道为德曲妥珠单抗的已知毒性反应。
在这些病例中,德曲妥珠单抗HER2靶向治疗之所以成为一种治疗选择,是因为通过下一代测序(NGS)检测发现了HER2突变。II期SUMMIT试验探索了来那替尼(一种具有抗HER2活性的泛EGFR酪氨酸激酶抑制剂)在HER2突变、经治宫颈癌中的应用,该试验也提示通过NGS检测HER2突变可能具有临床应用价值。该试验纳入了 22 例患者,其中 18 例为腺癌,报告的客观缓解率(ORR)为 18.2%(15% 的宫颈腺癌携带HER2突变),中位缓解持续时间为 7.6 个月。DESTINY-PanTumor01试验基于NGS检测到的HER2突变纳入了多种实体瘤患者,报告的总缓解率为 29.4%,但仅纳入了 6 例妇科癌症患者。
本文 2 例患者在接受曲妥珠单抗治疗期间也出现过疾病稳定期或生物标志物应答。一项针对抗HER2药物治疗任意部位HER2突变癌症患者疗效的汇总分析显示,德曲妥珠单抗的缓解率为 60.0%,吡咯替尼为 31.0%,来那替尼联合曲妥珠单抗为 26.0%,来那替尼联合氟维司群为 25.0%,曲妥珠单抗联合帕妥珠单抗为 19.0%,来那替尼单药为 16.0%。这些结果表明,在目前的抗HER2药物中,德曲妥珠单抗的活性最强。
本文报告提供了额外证据,表明德曲妥珠单抗可能在比当前指南建议更广泛的患者群体中存在应用价值。这些病例还凸显了在识别可能对HER2靶向治疗敏感的疾病过程中出现的复杂性。虽然HER2突变总体上并不常见,但在某些妇科恶性肿瘤患者亚群中(如宫颈管癌),HER2突变更为常见。对于这一患者群体,由于常规HER2 FISH或IHC检测无法识别HER2突变,因此需要NGS或其他基因检测方法(如循环肿瘤DNA检测)。
德曲妥珠单抗为晚期妇科癌症患者提供了一种令人振奋的新型HER2靶向治疗选择;HER2突变检测应被视为分子检查的一部分,尤其是对于替代治疗选择有限的患者。
参考文献:
Choudhury DS, Kurnit KC, Yamada SD, Lee NK, Vemuri A, Barroeta JE, Rayani S, Straus CM, Fleming GF, Kim JS. Successful treatment of gynecologic malignancy with trastuzumab deruxtecan in three patients with HER2 mutations. Gynecol Oncol Rep. 2025 Oct 13;62:101974. doi: 10.1016/j.gore.2025.101974. PMID: 41158157; PMCID: PMC12554900.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)