首页 > 医疗资讯/ 正文
边缘区淋巴瘤(MZL)和华氏巨球蛋白血症(WM)属于B细胞淋巴瘤,表达CD20但通常不表达CD5和CD10,其特征为病程惰性,但均无法通过当前标准疗法(CD20单抗单药或联合方案)治愈,因此需要额外的治疗方法。BCL-2抑制已成为血液系统恶性肿瘤治疗武器库中一个有力补充,包括MZL和WM。
《British Journal of Haematology》近日发表综述,概述了目前对BCL-2凋亡通路及其在血液肿瘤发生和维持中作用的理解,总结了BCL-2抑制剂(如维奈克拉、sonrotoclax [索托克拉]、lisaftoclax [利沙托克拉]和LOXO-338)的临床前和正在进行的临床经验。

调节线粒体凋亡的BCL-2蛋白家族生物学
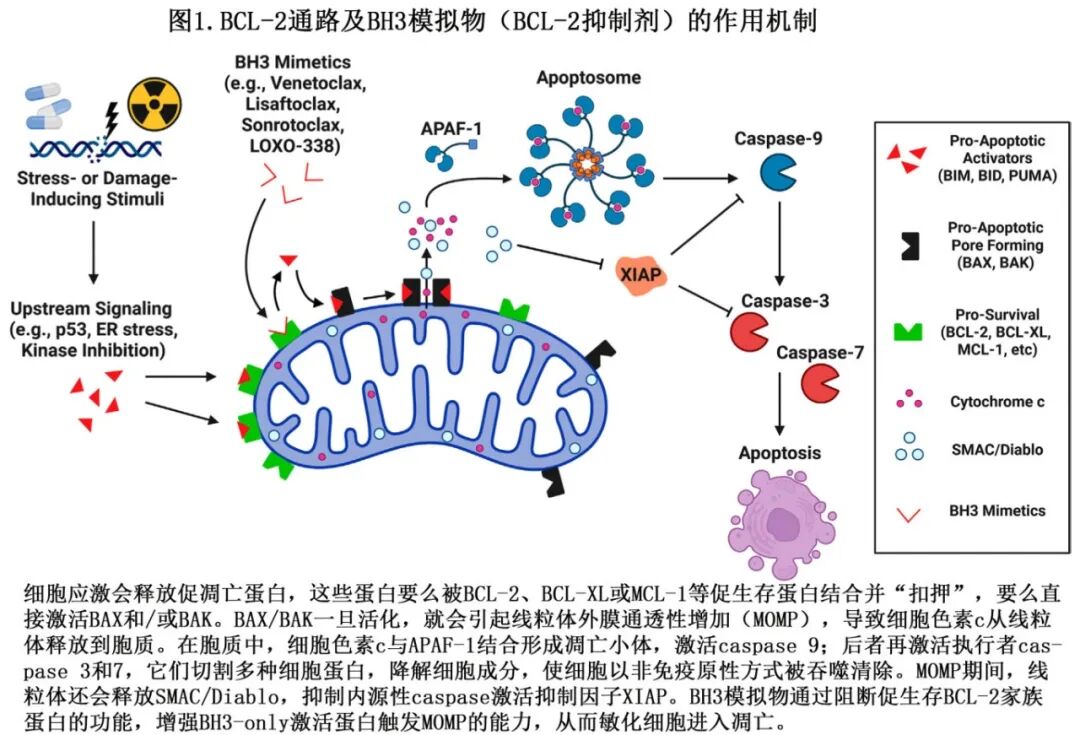
凋亡亦可称为程序性细胞死亡,可由细胞外或细胞内刺激触发,并可通过内在或外在通路运作。两种凋亡通路均汇聚于 caspase 3 和 7 的激活,从而驱动凋亡的最终事件。
BCL-2家族成员(超过20种蛋白)和内在凋亡通路的其他组分共同调节正常细胞和恶性细胞的存活。成熟B细胞通常高表达BCL-2,BCL-2过表达可以阻止细胞在应对生理和病理刺激时发生凋亡。癌细胞经常改变BCL-2的表达以避免凋亡的诱导。该家族的同名蛋白BCL-2最初被鉴定为免疫球蛋白重链基因位点的基因融合伙伴,这种融合发生在滤泡性淋巴瘤(FL)中,表现为t(14;18),并导致BCL-2转录升高。
促凋亡和促存活的BCL-2家族蛋白都定位于线粒体外膜,它们的相互作用决定细胞色素c是否从线粒体释放以启动凋亡。该蛋白家族包含一到四个同源区域,称为B细胞2同源(BH)结构域,包括BH1、BH2、BH3和BH4。促凋亡和促存活的BCL-2家族蛋白可以根据其功能和BH结构域的数量来区分。
仅含BH3结构域的蛋白(BID, BIM, PUMA, Noxa, HRK, BIK, BMF 和 BAD)是促凋亡蛋白,它们共享一个短的BH3区域,可以作为凋亡敏化剂发挥作用。这些仅含BH3结构域蛋白的一部分(BIM, BID 和 PUMA)也通过直接激活BAX和BAK而作为凋亡激活剂。一旦被激活,BAX和BAK寡聚化并在线粒体外膜上形成孔道,导致几种线粒体内容物的释放,包括细胞色素c。释放到胞质后,细胞色素c与凋亡蛋白酶激活因子1(APAF-1)和procaspase 9结合,形成凋亡小体,从而激活caspase 9。通透化的线粒体也释放第二线粒体衍生的caspase激活剂(SMAC或DIABLO),它们抑制XIAP(一种已知的caspase 3抑制剂)的活性,从而进一步促使细胞走向凋亡死亡。Caspases是丝氨酸蛋白酶,驱动细胞死亡的执行。
促存活(或抗凋亡)蛋白(BCL-2, BCL-XL, MCL-1, BCL-W 和 BFL1)包含所有四个BH结构域(BH1-BH4),并显示一个疏水表面沟槽,这对于与BH3结构域相互作用至关重要,并允许在BCL2家族内进行同源或异源二聚化。促凋亡家族成员,包括BIM, BID, BAX/BAK, Noxa等,被促存活蛋白结合和隔离。为了发生凋亡,促存活蛋白必须被促凋亡蛋白压倒。
BCL-2的BH3模拟抑制剂
促凋亡的仅含BH3结构域蛋白的过表达是由癌细胞中常见的各种应激源触发的,包括癌基因应激、DNA损伤和细胞周期检查点功能障碍。为了应对这一点,癌细胞上调促存活的BCL-2家族蛋白,以阻止被激活的BAX/BAK引起的线粒体外膜通透化(MOMP),这基本上是线粒体凋亡的关键步骤。基于这种理解,有人提出促存活的BCL-2家族蛋白,包括BCL-2,可能是癌症治疗的有力靶点。
早期靶向这些蛋白的探索主要基于筛选天然产物库,以鉴定能够结合并抑制多种BCL-2家族蛋白的小分子。尽管其中一些化合物进入了癌症临床试验,但均未显示出足够的疗效以获得批准。最近,基于核磁共振的筛选、片段化学和基于结构的药物设计的组合已进行实施,以更选择性和更强效地靶向BCL-2家族中的促存活蛋白。
BH3模拟物是设计用于模拟仅含BH3结构域蛋白功能的小分子,具有特异性、选择性和效力。BH3模拟物的特点在于它们对BCL-2家族成员(例如BCL-2, BCL-XL或MCL-1)的选择性,并通过释放促凋亡蛋白来诱导依赖于这些蛋白的细胞中BAX/BAK的激活。由于这些BH3模拟物的选择性性质,存在足够数量的其他未被抑制的促存活蛋白最终可能导致对这些药物的耐药性。BH3模拟物的作用机制如图1所示。
基于在CLL治疗中的成功,以及数据显示在伊布替尼耐药的WM细胞中BCL-2上调, BCL-2已探索作为WM和MZL的另一个潜在靶点。BCL-2通路失调导致BCL-2过表达,抑制WM中的线粒体凋亡。BCL-2也已知在MZL中由于非基因组改变而过表达。此外,抑制BCL-2活性的基因丢失是del(6q)的结果,在超过一半伴有MYD88的WM病例中发现,并且在MZL的不同亚型中也检测到不同程度的缺失。
ABT-737是第一个开发的BH3模拟物,抑制BCL-2、BCL-XL和BCL-W蛋白。ABT-263(navitoclax)是通过修饰ABT-737开发的,使其具有口服生物利用度,并能更有效地抑制同一组蛋白。在惰性B细胞淋巴瘤和复发CLL患者中,navitoclax在临床试验中显示出中等的单药有效性。然而血小板也依赖于BCL-XL存活,因此,给予navitoclax导致快速的血小板减少症。另一个具有临床数据的BH3模拟物是obatoclax mesylate (GX15-070),一种泛BCL-2家族抑制剂。然而它对BCL-2的选择性有限,临床效果最小,并且在I期试验中出现了有问题的脱靶神经精神副作用。此外,其他抑制剂如palcitoclax (APG-1252)、AT-101 (R-(-)-棉酚乙酸) 和 LP-118 也已进行过研究。
维奈克拉(选择性BCL2抑制剂)
选择性抑制剂维奈克拉(ABT-199/GDC-0199)是迄今为止唯一一个既证明有效又耐受良好,并获得FDA批准用于治疗CLL以及急性髓系白血病(AML)的BH3模拟物。维奈克拉已被广泛研究,无论是单独使用还是与其他疗法(包括BTK抑制剂和抗CD20单克隆抗体)联合使用。
维奈克拉被设计成一种BCL-2特异性和选择性抑制剂,旨在预防navitoclax常见的靶向性血小板减少症。维奈克拉对BCL-2的选择性超过对BCL-xL的100倍以上,超过对MCL-1的1000倍以上,它能结合并抑制BCL-2。基于积极的临床前证据,使用维奈克拉的临床试验于2011年开始。早期试验证明了其在WM和MZL中的中等单药活性。在所有组织学类型中,包括WM和MZL,都观察到BCL-2的高表达,但这与观察到的反应并不对应。这种缺乏对应关系并不意外,因为细胞对BCL-2的依赖性并非由BCL-2的表达决定,而是由其结合伴侣、其他促存活蛋白的表达以及BAX/BAK的存在决定。
I期研究
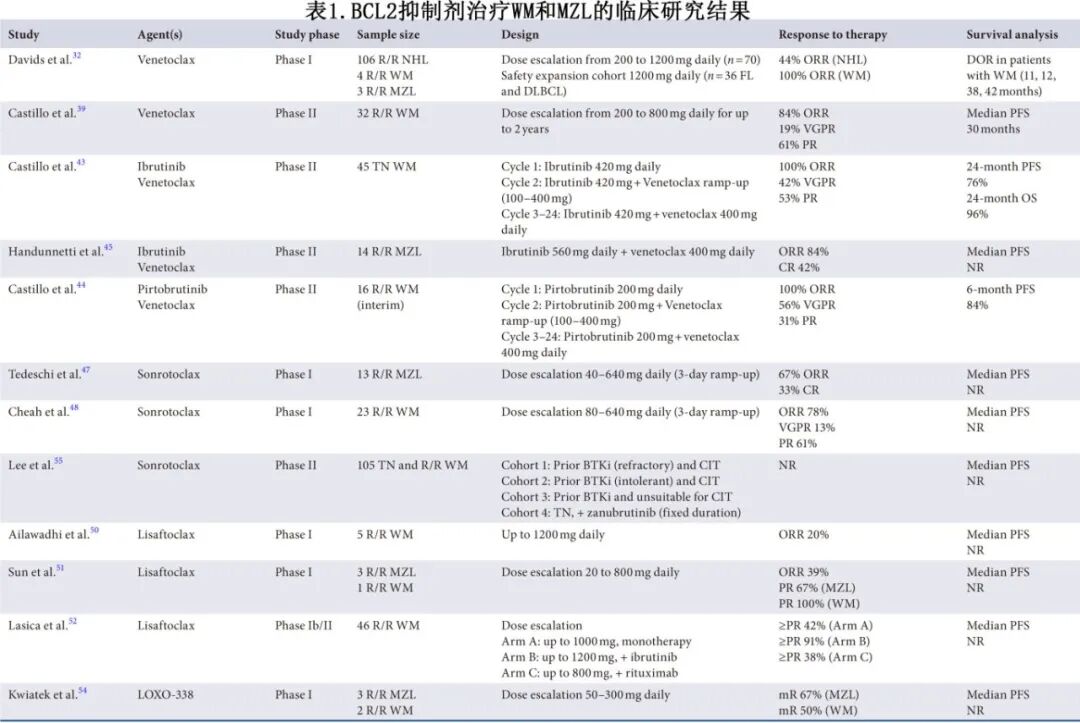
维奈克拉单药治疗复发或难治性B细胞淋巴瘤患者的首次人体研究包括了4名WM患者和3名MZL患者。维奈克拉每日给药一次,平均持续时间为5个月(范围:0.2–46.0个月)。设计了两个队列:一个剂量递增队列,包括70名患者,每日接受维奈克拉剂量从200到1200毫克;一个安全性扩展队列,仅包括FL和DLBCL患者。维奈克拉持续给药直至疾病进展、达到缓解后因计划进行干细胞移植而退出或因不可接受的毒性而退出。患者先前接受过的中位治疗线数为3线(范围1-10)。在106名复发或难治性非霍奇金淋巴瘤患者中,44%达到了客观缓解,即完全缓解(CR)或部分缓解(PR)。所有4名WM患者均达到客观缓解,分类为PR。这4名WM患者的缓解持续时间分别为11、12、38和42个月。在3名MZL患者中,总缓解率为67%(2/3),缓解持续时间分别为2个月和24个月。
这项I期研究中的大多数副作用为1级和2级,3-4级事件与剂量无关。常见的3级和4级事件包括贫血、中性粒细胞减少症和血小板减少症。选择性BCL-2抑制剂缺乏额外毒性与成人造血系统外大多数组织中明显的凋亡抵抗一致。长期给药未观察到累积毒性。
II期研究
维奈克拉单药治疗
由于在I期试验中观察到维奈克拉在WM和MZL中的单药活性,以及临床前研究表明维奈克拉可以诱导具有野生型CXCR4(CXCR4ᵂᵀ)和突变型CXCR4(CXCR4ᴹᵁᵀ)的WM细胞凋亡,因此在WM中启动了临床试验。一项多中心II期研究评估了维奈克拉单药治疗32名复发或难治性WM患者。维奈克拉起始剂量为200毫克,持续1周,随后1周400毫克,然后800毫克,总共持续2年。值得注意的是,所有患者均存在MYD88 L265P突变,17名患者存在CXCR4突变;16名患者先前接触过BTK抑制剂。总缓解率为84%,中位无进展生存期(PFS)为30个月。主要缓解率为81%,其中6名患者(19%)达到非常好的部分缓解(VGPR),19名患者(61%)达到部分缓解(PR)。CXCR4突变不影响PFS或缓解率。在先前接触过BTK抑制剂、接受过至少三线治疗以及患有难治性疾病的个体中观察到较低的缓解率。该试验中的大多数不良事件为2级或3级。与I期试验中观察到的一样,血细胞减少症,包括中性粒细胞减少症、贫血和血小板减少症,是常见的不良事件。唯一的4级事件是6名患者出现中性粒细胞减少症,1名患者出现发热性中性粒细胞减少症。只有一名高肿瘤负荷患者出现了实验室(非临床)肿瘤溶解综合征(TLS),并通过适当的支持治疗迅速缓解。该试验证实维奈克拉在先前治疗过的WM患者(包括先前接受过BTK抑制剂治疗的患者)以及患有CXCR4ᴹᵁᵀ疾病的患者中具有活性。维奈克拉在MYD88ᵂᵀ或TP53ᴬᴸᵀ WM中的活性仍有待阐明。
联合治疗
为了增强维奈克拉在B细胞淋巴瘤中的单药活性,联合方案已在多种其他癌症中进行了评估,包括CLL和套细胞淋巴瘤,这种策略也在另一项评估伊布替尼和维奈克拉联合治疗WM患者的II期研究中采用。在该试验中,初治WM患者开始接受伊布替尼420毫克单药治疗,4周后加入维奈克拉,每周递增剂量:100毫克,随后200毫克,然后400毫克,与伊布替尼联合继续治疗额外的22个周期(每周期4周)。17名患者(38%)患有CXCR4ᴹᵁᵀ疾病。VGPR率为42%。中位随访24个月时,24个月总生存率为96%,PFS为76%。由于4名患者(9%)发生室性心律失常,其中2例为5级,该试验提前终止,中位治疗时间为10个月。其他≥3级不良事件包括中性粒细胞减少症(38%)、粘膜炎(9%)和TLS(7%)。
由于在该试验中观察到室性心律失常,不推荐在WM中使用伊布替尼和维奈克拉的联合方案。然而,目前一项正在进行的II期试验正在评估维奈克拉与匹妥布替尼(一种与较少心脏不良事件相关的新型非共价BTK抑制剂)的联合使用(NCT05734495)。该多中心试验入组的前16名患者的初步数据已公布。在该试验中,第1周期(28天)开始使用匹妥布替尼200毫克单药治疗,第2周期期间加入维奈克拉,进行3周剂量递增,最大剂量为400毫克。然后继续使用匹妥布替尼和维奈克拉,总共额外22个周期。在前16名患者中,中位随访时间为6个月(范围:3-12个月)。56%的患者达到VGPR,31%达到PR,13%达到微小缓解。这些结果令人鼓舞,但仍需等待该试验的最终数据。
另一项II期试验也探索了维奈克拉与伊布替尼联合治疗MZL。14名患者入组并接受伊布替尼560毫克单药治疗,4周后,经过6周的剂量递增,加入维奈克拉800毫克。后来,由于与伊布替尼的药物相互作用,方案修订为使用最大剂量400毫克的维奈克拉。在16周时可评估的12名患者中,7名患者(58%)患有复发或难治性疾病,5名患者(42%)为初治患者。根据PET评估,16周时的总缓解率为84%(10/12),根据CT评估为58%(7/12),完全缓解率为42%(5/12)。在数据展示时,有两名患者在7个月和11个月时出现进展。七名可评估患者中的一名确认MRD阴性。本研究未观察到TLS病例。最常见的非血液学毒性是疲劳、恶心、腹泻和瘀伤,中性粒细胞减少症和血小板减少症是最常见的血液学毒性。一名患者因持续性中性粒细胞减少症而永久减少了维奈克拉剂量。目前,维奈克拉和利妥昔单抗的联合方案正在一项正在进行的临床试验(NCT06510309)中作为MZL的一线疗法使用,该试验计划招募33名患者。
索托克拉(新型BCL-2抑制剂)
与维奈克拉相比,索托克拉在白血病和淋巴瘤模型中表现出更显著的抗肿瘤活性。值得注意的是,BCL-2突变(例如G101V)可导致对维奈克拉耐药。而索托克拉的细胞毒活性比维奈克拉强五倍,且在G101V突变细胞中具有活性,可能归因于其在BCL-2的P2口袋内的新型结合机制。
I期
索托克拉已在复发或难治性成熟B细胞淋巴瘤患者中进行了探索(NCT04277637)。研究了多个剂量水平,包括40、160和640毫克,并有3天的剂量递增至指定剂量。未达到最大耐受剂量,推荐640毫克作为II期剂量。
中位随访8个月(范围:2.6–37个月),总缓解率为67%,包括13名MZL患者中的4名(33%)完全缓解。 在所有四名先前接受BTK抑制剂治疗后进展的患者中均观察到≥部分缓解。治疗中常出现的不良反应包括恶心(39%)、发热、腹泻和便秘(各31%)。最常见的≥3级治疗中出现的不良事件是中性粒细胞减少症、发热性中性粒细胞减少症和TLS(各发生在15%的患者中)。TLS发作在静脉补液和支持治疗后24小时内缓解。
在2025年欧洲血液学协会会议上公布了23名复发或难治性WM患者的经验。先前治疗的中位线数为3线,14名患者先前接触过BTK抑制剂。中位随访22个月,3名患者(13%)达到VGPR,14名患者(61%)达到PR,中位PFS未达到。六名患者死亡:四名死于疾病进展,两名死于感染。≥3级贫血发生率为22%。
II期
一项针对复发或难治性WM患者的国际II期索托克拉研究目前正在进行中(NCT05952037),先前接受过BCL-2导向治疗的患者被排除在研究之外。大约将招募105名患者接受索托克拉单药治疗。这些患者将根据其WM对BTK抑制剂耐药、对BTK抑制剂不耐受或不适合化学免疫治疗来选择。队列4包括先前未治疗的WM患者,接受索托克拉和泽布替尼的联合治疗。
利沙托克拉
利沙托克拉优先结合BCL-2并破坏BCL-2:BIM复合物,从而诱导依赖于BAX和BAK的caspase介导的凋亡。在来自各种血液肿瘤(如多发性骨髓瘤、WM和CLL)的细胞系和肿瘤细胞中,利沙托克拉显示出强大的抗癌作用。促死亡蛋白BIM和Noxa在利沙托克拉治疗后增加。在体内,当与利妥昔单抗或苯达莫司汀和利妥昔单抗联合使用时,利沙托克拉显示出增加细胞死亡。在来自伊布替尼耐药WM的患者来源异种移植瘤(PDX)中,利沙托克拉也显示出活性。
I期
利沙托克拉首先在一项I期试验中进行评估,该试验包括52名CLL和其他血液恶性肿瘤患者,其中有5名WM患者。在这项研究中,每日最大剂量为1200毫克,对于中或高危TLS患者,从20毫克开始缓慢递增剂量。在该试验中,没有患者发生TLS。在5名WM患者中,只有一人达到微小缓解。该试验中的不良反应与其他BCL-2抑制剂相似,如血细胞减少症、胃肠道症状、头痛和疲劳。
另一项利沙托克拉的I期试验进行,入组了31名复发或难治性非霍奇金淋巴瘤患者,包括三名患者为MZL,一名患者为WM。在该试验中,患者接受利沙托克拉剂量范围从20到800毫克。患者先前接受过的中位治疗线数为4线(范围1-14)。在高达800毫克的剂量下未观察到剂量限制性毒性,推荐的II期剂量为600毫克。中位治疗周期数为四个周期,所有类型淋巴瘤的总缓解率为39%。三名MZL患者中的两名和一名WM患者达到了部分缓解。超过10%患者出现的治疗相关不良事件包括血小板减少症、中性粒细胞减少症、白细胞减少症、贫血、高尿酸血症、高磷血症、高甘油三酯血症和腹泻。
一项探索利沙托克拉在WM中使用的开放标签Ib/II期多中心试验最近已完成(NCT04260217)。对于TLS高危患者采用3天剂量递增方案,剂量范围从400到1200毫克。在该试验中,患者被纳入三个组:A组,复发或难治性WM患者接受利沙托克拉单药治疗;B组,初治WM患者接受利沙托克拉和伊布替尼联合治疗;以及C组,利沙托克拉和利妥昔单抗联合用于BTK抑制剂初治WM患者。报告了入组的46名患者的初步数据,剂量分别高达1000毫克(A组)、1200毫克(B组)和800毫克(C组)。A、B、C组的中位治疗时间和主要缓解率分别为11个月和42%、23.5个月和91%以及11.5个月和38%。3级或以上治疗中出现的不良效应包括中性粒细胞减少症(15%)、血小板减少症、白细胞减少症、TLS(各4%)以及贫血、体重减轻和感染性休克(各2%)。
LOXO-338
LOXO-338是一种口服BCL-2抑制剂,旨在实现对BCL-xL的选择性,以避免因抑制BCL-xL相关的血小板减少症。LOXO-338优先抑制BCL-2/BAK相互作用,对BCL-xL/BAK和MCL1/BAK的抑制效力较低。LOXO-338在纳摩尔水平抑制来自FL和DLBCL的细胞系的增殖。每日给药一次的LOXO-338在FL小鼠异种移植模型中显示出剂量依赖性的肿瘤生长抑制。
I期
LOXO-338在一项剂量递增的I期研究中进行了评估,该研究针对至少接受过两种先前治疗的B细胞恶性肿瘤患者。该药物口服给药,采用3+3设计,剂量范围从50到300毫克每日,直至疾病进展或出现不可接受的毒性。包括27名患者(10名CLL和17名NHL),其中3名患有MZL,2名患有WM。两名MZL患者和一名WM患者获得了微小缓解。3级或更高级别的不良事件包括贫血、中性粒细胞减少症、血小板减少症和COVID-19。
讨论
基于以上数据,BCL-2抑制剂已成为WM和MZL患者的治疗选择。此外,它们作为单药治疗以及与抗CD20单克隆抗体或BTK抑制剂联合的临床开发仍在进行中(表1)。
BCL-2抑制剂的安全性特征与化学免疫治疗、蛋白酶体抑制剂和BTK抑制剂报告的不良事件相比具有优势。BCL-2抑制剂治疗尚未与IgM燃瘤(flares,如利妥昔单抗所见)、髓系肿瘤的发生(如苯达莫司汀所见)、神经病变(如硼替佐米所见)或出血风险增加、心律失常、停药症状或治疗停止后疾病快速反弹(如BTK抑制剂所见)相关联。但BCL-2抑制剂治疗带有特定的不良事件,包括血细胞减少症、胃肠道症状和感染风险增加。一个显著风险是TLS。然而,WM和MZL中TLS的发生率低于CLL中观察到的发生率。
关于疗效,BCL-2抑制剂在WM和MZL中似乎有效且能诱导持久缓解。然而相对而言,这种疗效率和缓解持久性低于化学免疫治疗或BTK抑制剂。然而,大多数关于BCL-2抑制剂的疗效数据是在先前接触过化学免疫治疗和BTK抑制剂的患者中报告的,这可能部分解释了观察到的较低疗效。临床试验正在评估BCL-2抑制剂在更早期环境中的应用,包括维奈克拉联合利妥昔单抗,以及索托克拉联合泽布替尼,作为WM的一线治疗。另一项评估在一线治疗后使用维奈克拉联合匹妥布替尼的试验正在进行中。NCCN认可维奈克拉作为复发或难治性WM患者的一种治疗选择,但尚未对MZL患者做出认可。
基于以上所述,对于先前接触过化学免疫治疗(且不符合BTK抑制剂条件)或共价BTK抑制剂(且不符合化学免疫治疗条件)的WM患者,维奈克拉将作为二线治疗的合理选择,或者作为先前接触过化学免疫治疗和共价BTK抑制剂的WM患者的三线治疗。在这些情况下,匹妥布替尼也是安全有效的。尚未进行维奈克拉和匹妥布替尼之间的比较研究,但两种药物的缓解率和持久性似乎相似。
在给药方面,BCL-2抑制剂有望实现全口服、非化疗、固定疗程的治疗,特别是与其他药物联合使用时,可能对患者的依从性产生积极影响,降低毒性,允许再次治疗的可能性并降低成本。
新型BCL-2抑制剂如索托克拉、利沙托克拉和LOXO-338可以克服对维奈克拉的耐药机制,并提供更高的疗效和更低的毒性。它们目前的临床开发主要针对晚期复发疾病。然而,根据疗效和毒性率,预计将在更早的治疗线中进行开发。
结论
BCL-2抑制剂在WM和MZL的治疗中已显示出显著活性,预计它们将在这些疾病中继续使用。它们很可能在未来这些疾病的治疗中发挥作用,无论是作为单药还是联合疗法。
参考文献
Sarosiek S, Suarez U, Fernandez-Turizo M, Sarosiek KA, Castillo JJ. BCL-2 inhibition in Waldenström macroglobulinaemia and marginal zone lymphoma. Br J Haematol. 2025;00:1– 9. https://doi.org/10.1111/bjh.70208
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)