首页 > 医疗资讯/ 正文
01 病史:
女性,51岁,因“发现右乳结节5天”入院。
02 辅查:
乳腺彩超示:右乳2点钟可见1.8*1.2*1.1cm低回声结节,形态不规则,非水平增长,边缘不光整,内部回声欠均匀,结节内可见高回声晕,CDFI示结节边缘可见血流信号,弹性评分5分。双侧腋下未见明显肿大淋巴结回声。
诊断:右乳结节,4C类;
乳腺MRI平扫+增强:乳腺MRI血管成像(图1):双侧乳腺呈c型,低背景强化,右乳内上象限见一长T1、混杂T2信号肿块,形态不规则,大小约21mm×12mm×14mm,边缘可见毛刺,增强后明显强化,周围可见增多、增粗血管影,时间-信号曲线呈Ⅱ型,弥散受限,ADC值约1.0×10-3mm2/s。双侧腋窝未见明显增大淋巴结。
影像意见:右侧乳腺内上象限肿块(BI-RADS 4C)。
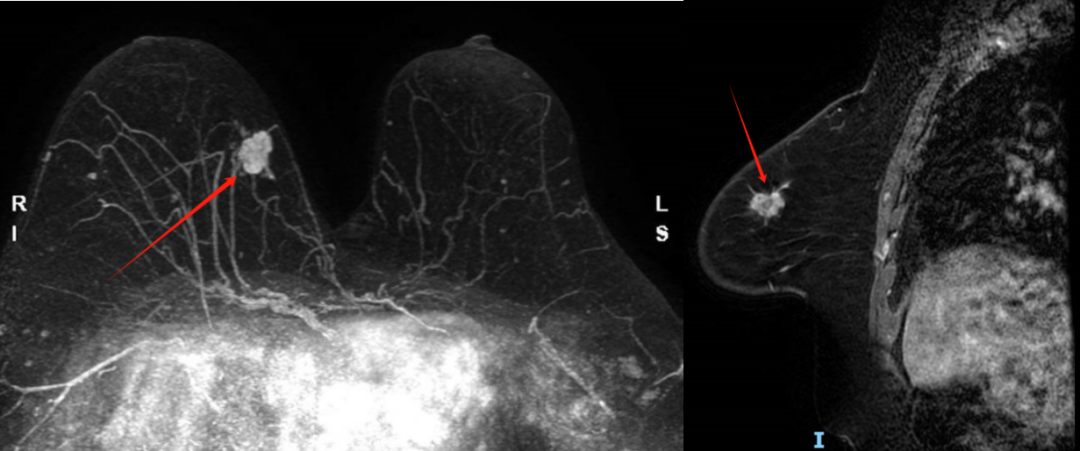
图1 乳腺MRI示右乳内上象限见一长T1、混杂T2信号肿块,形态不规则,边缘可见毛刺,增强后明显强化(左:横断面;右:矢状面)。
03 组织病理活检:
3.1大体肉眼观:
第一次常规穿刺右乳肿块:灰白穿刺组织3条,长10-16mm,直径1mm。
第二次术中冰冻(图2):灰黄组织,85*55*25mm,局部见一灰白结节,18*15*8mm,切面灰白,实性质中,与周围分界欠清。
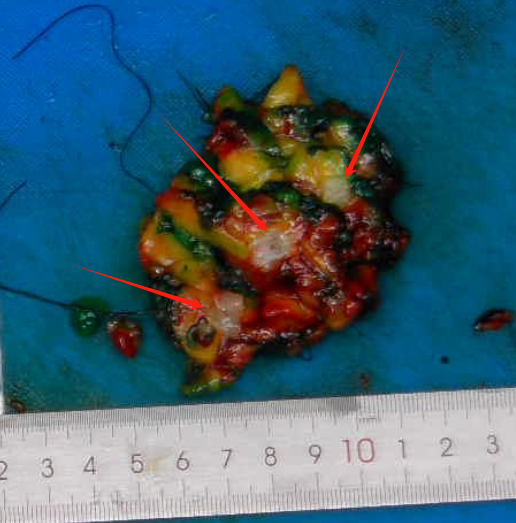
图2 大体观,局部见一灰白结节,切面灰白,实性质中,与周围分界欠清。
3.2镜下观:
第一次右乳肿块穿刺标本中(图3-图5),低倍镜下穿刺组织中见肿瘤细胞排列成片状,巢状,索状、管状结构或单个细胞浸润间质,部分区域可见黏液样间质。
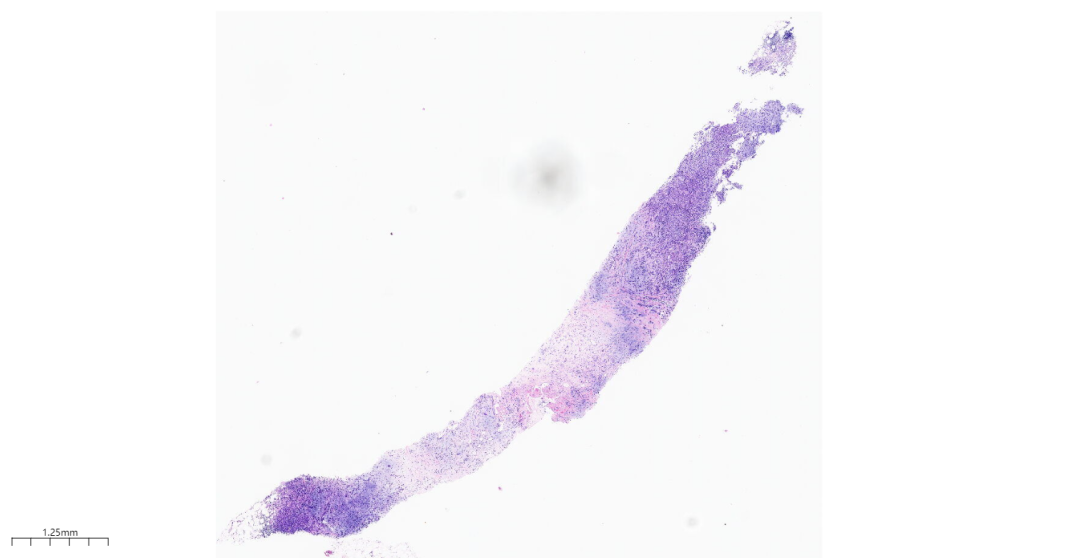
图3 第一次左乳肿块穿刺穿刺组织。
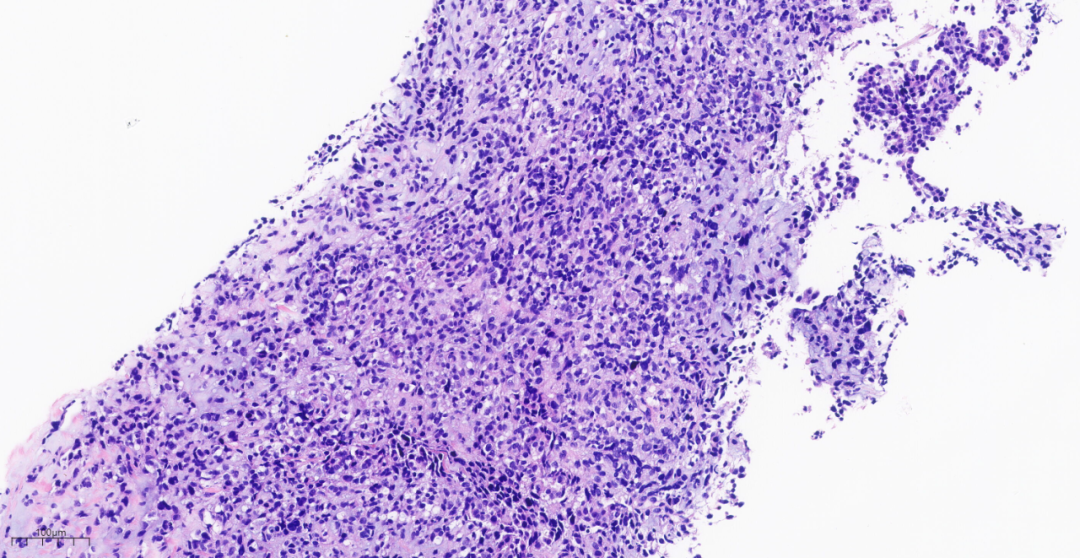
图4 乳腺穿刺组织局部见肿瘤细胞排列成片状,巢状或单个细胞浸润间质。
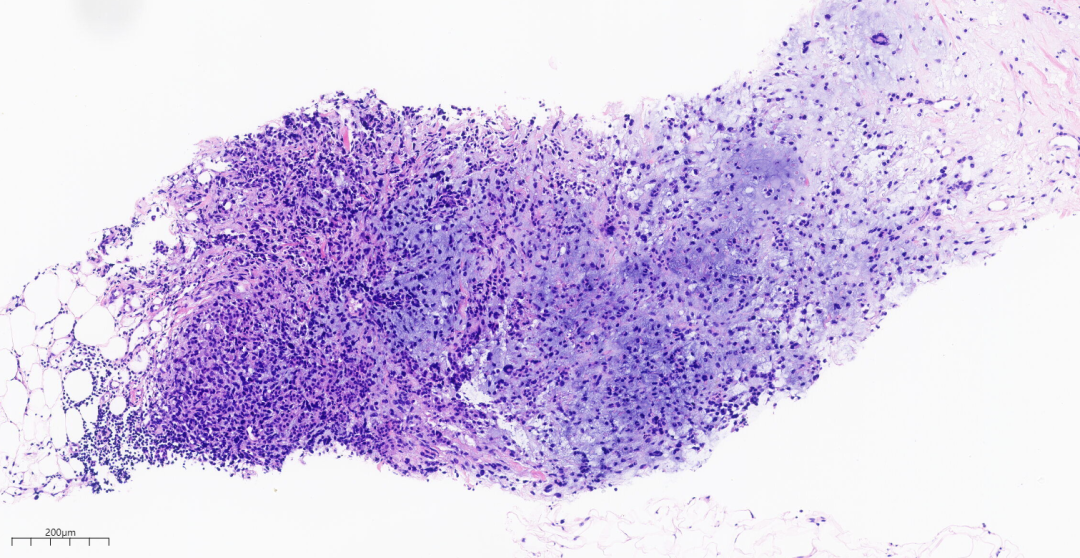
图5 乳腺穿刺组织见肿瘤部分区域可见粘液样间质。
第二次术中冰冻切片(图6-图8)及石蜡组织中(图9-图16):
低倍镜下,乳腺小叶结构消失,见膨胀性、结节状、浸润性生长的实性团块,呈推挤性边界,部分区域可见肿瘤组织侵及周围脂肪组织。
中倍镜,肿瘤细胞排列成片状,巢状,索状、管状结构或单个细胞浸润间质,结节内均有不同程度的产生基质,基质成分黏液样,部分区域伴有透明软骨呈小结节状分布于黏液样背景中。结节周边可见浸润性癌成分直接过渡为黏液软骨样基质。肿瘤细胞于肿块周围较多,而中间软骨样基质区域逐渐减少。
高倍镜下,部分肿瘤细胞中到高度异型,中等大小,胞质丰富,呈嗜酸性或透亮,细胞核圆形、卵圆形,大小不一,染色质粗糙,核仁不明显,核分裂象易见;部分肿瘤细胞呈腺样,细胞质丰富红染,部分胞质内可见大小不等的空泡,空泡内可见红染小球,细胞核呈小至中等大小,形状不规则,染色深,部分可见小核仁,呈中核级改变。

图6 乳腺冰冻的冰对组织见肿瘤细胞分布在间质中。
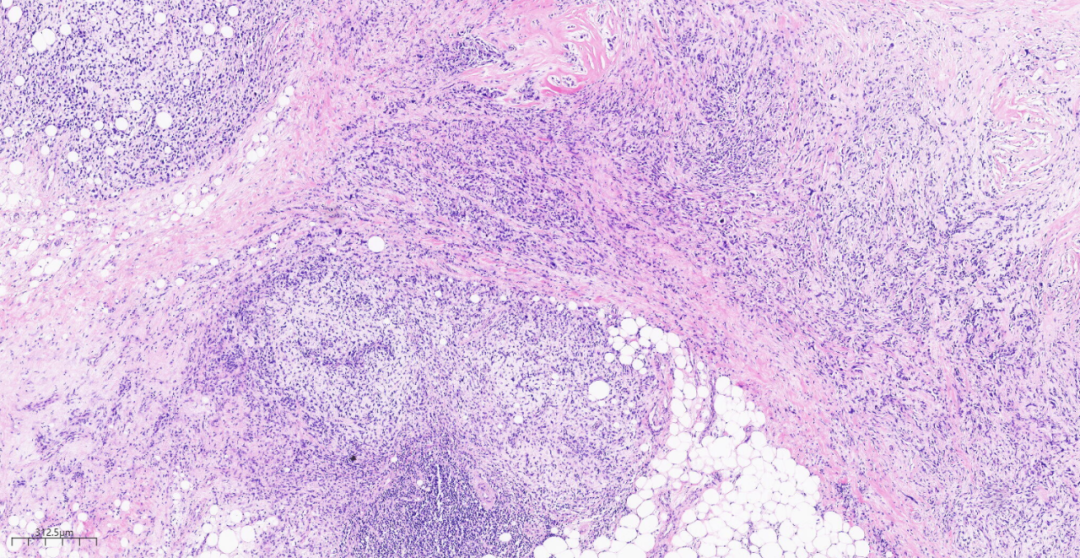
图7冰对组织中,见肿瘤细胞呈索状及巢状。
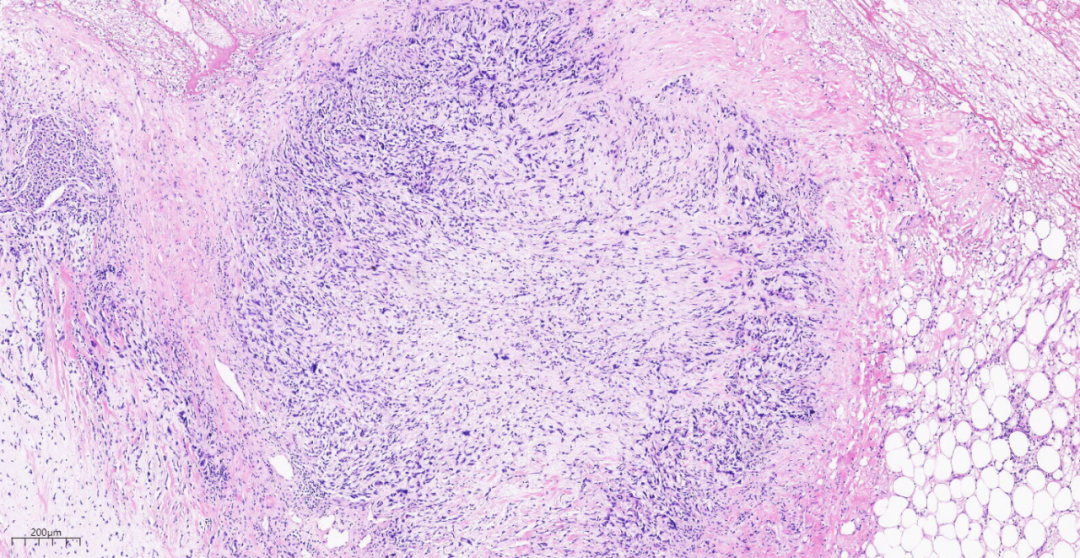
图8冰对组织中局部间质黏液样变。
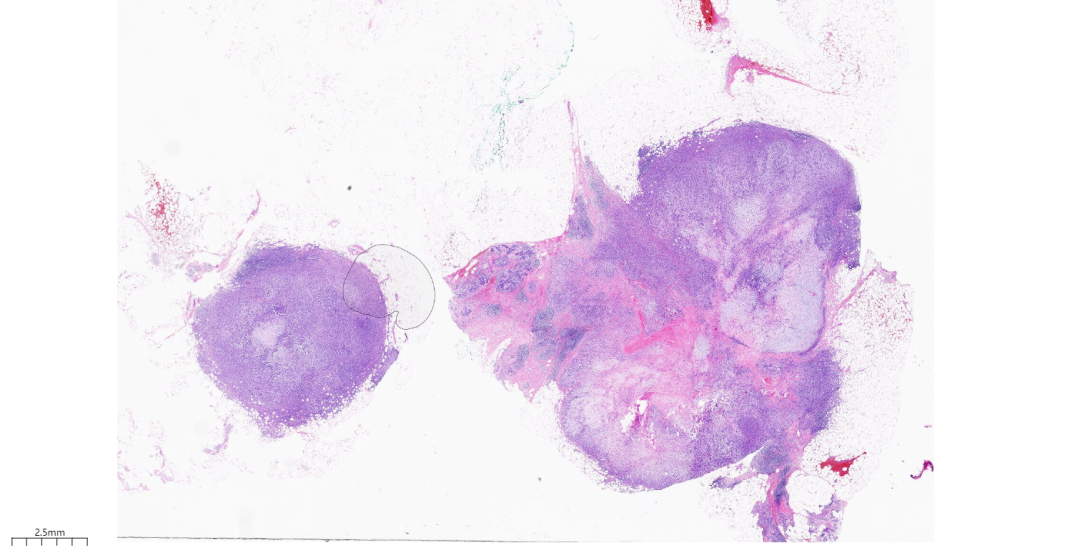
图9低倍镜下,乳腺小叶结构消失,肿瘤呈结节状生长。
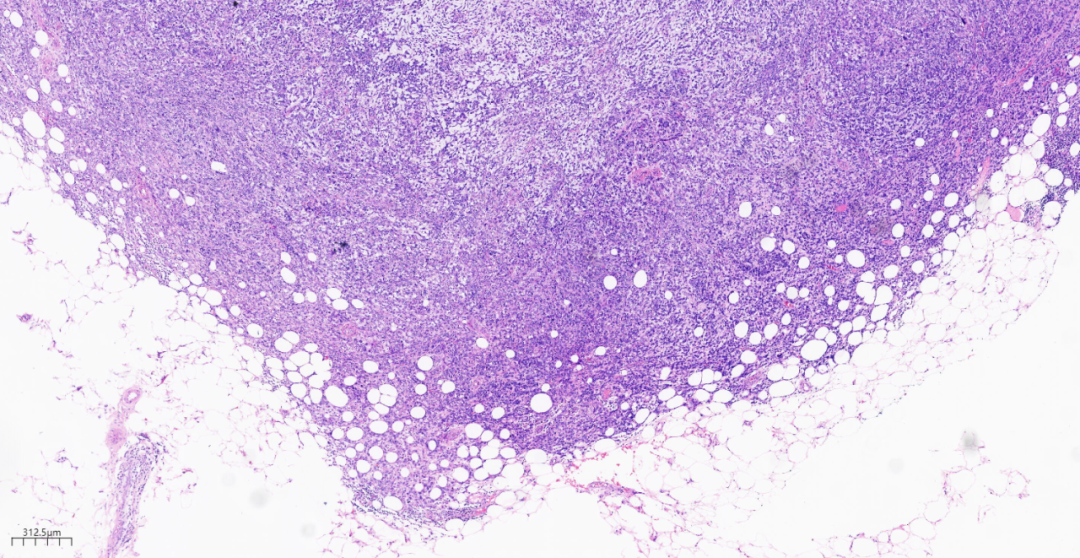
图10部分区域可见肿瘤组织向周围脂肪组织浸润性生长。
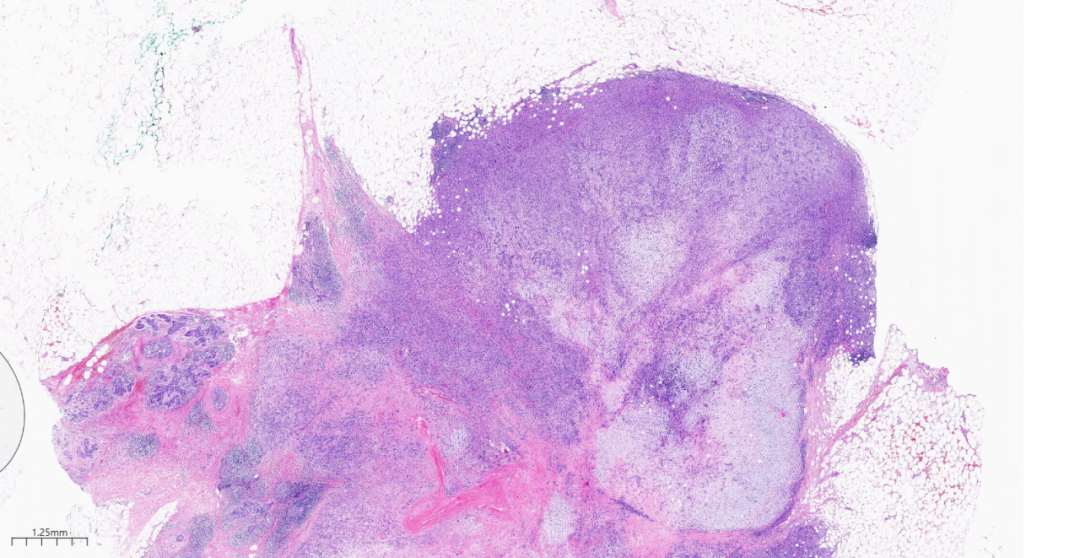
图11肿瘤细胞周围密集,而中间软骨样基质区域密度逐渐减少。
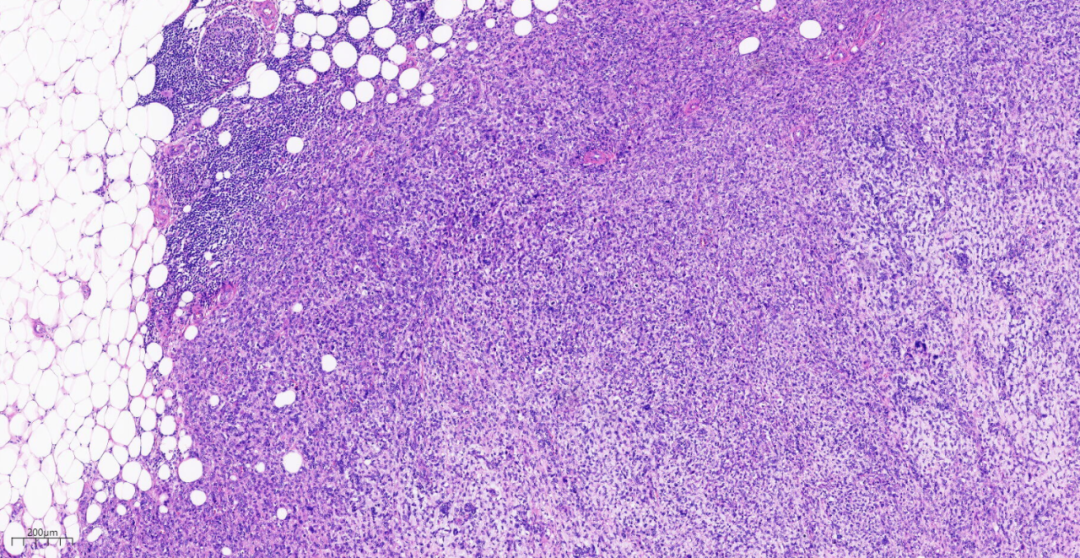
图12 中倍镜,肿瘤细胞排列成片状。
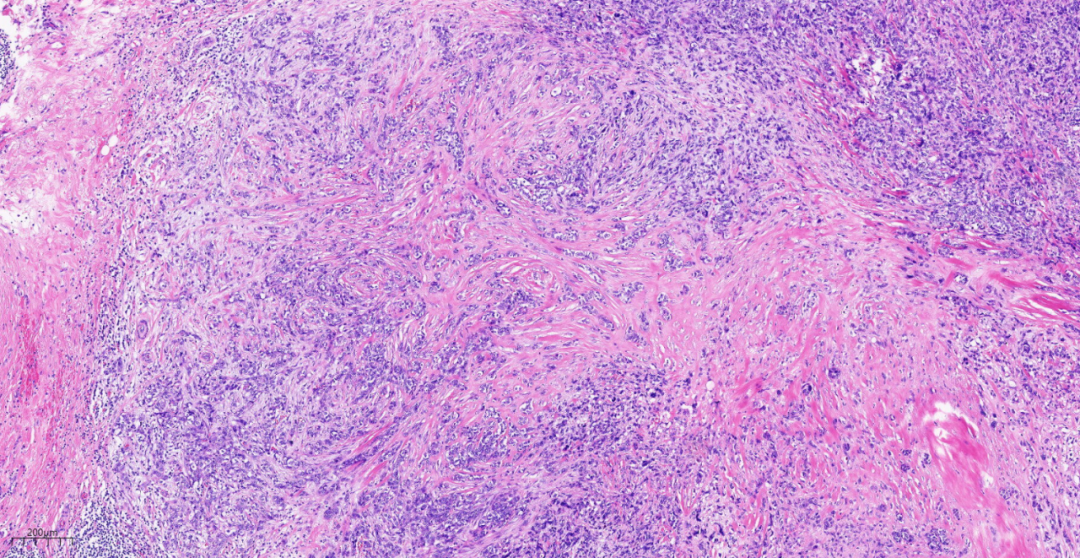
图13 肿瘤细胞排列成巢状,索状,周围见间质反应。
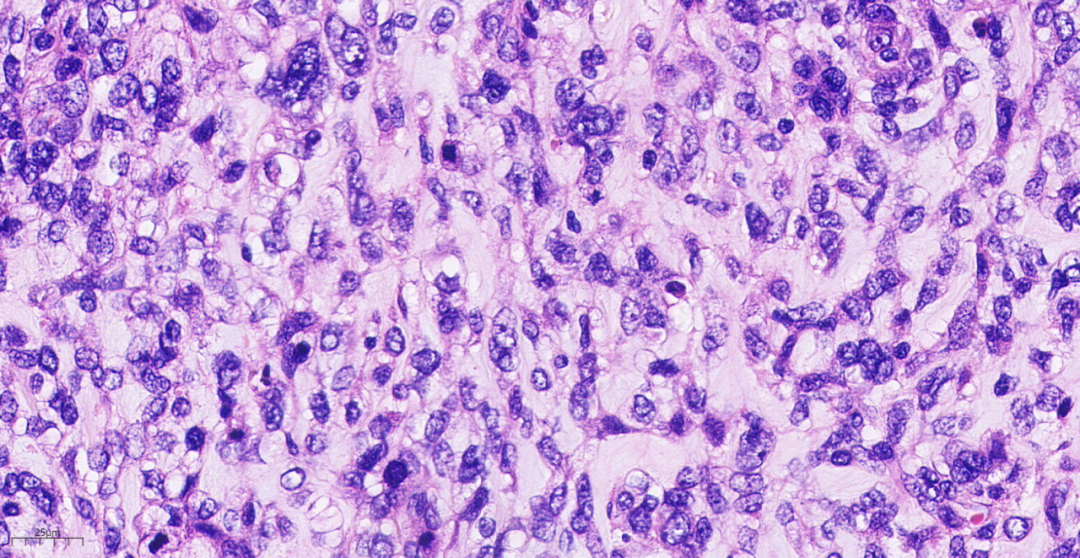
图14 结节内均有不同程度的产生黏液样的软骨样基质。
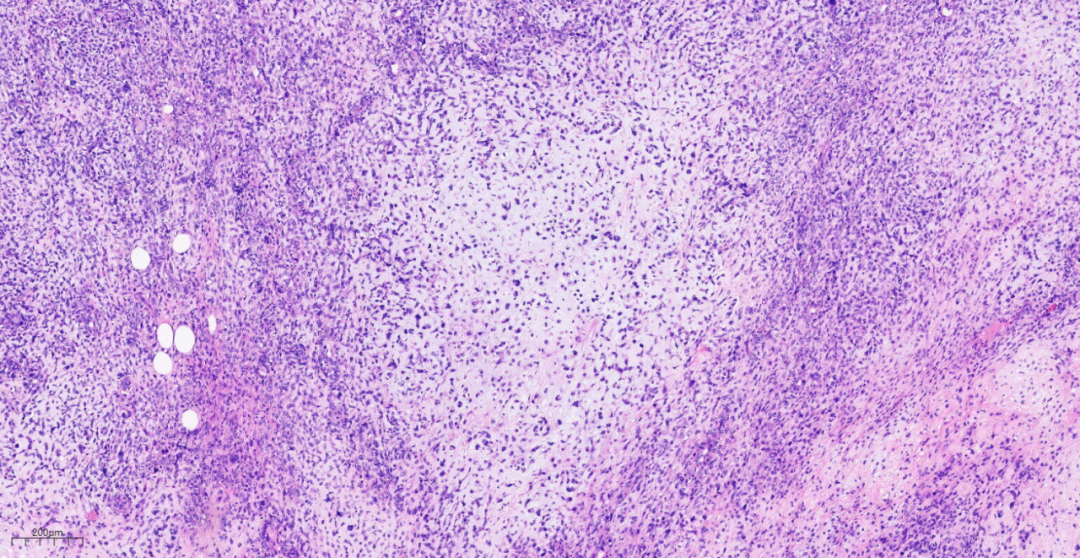
图15 伴有透明软骨呈小结节状分布于黏液软骨样背景中。
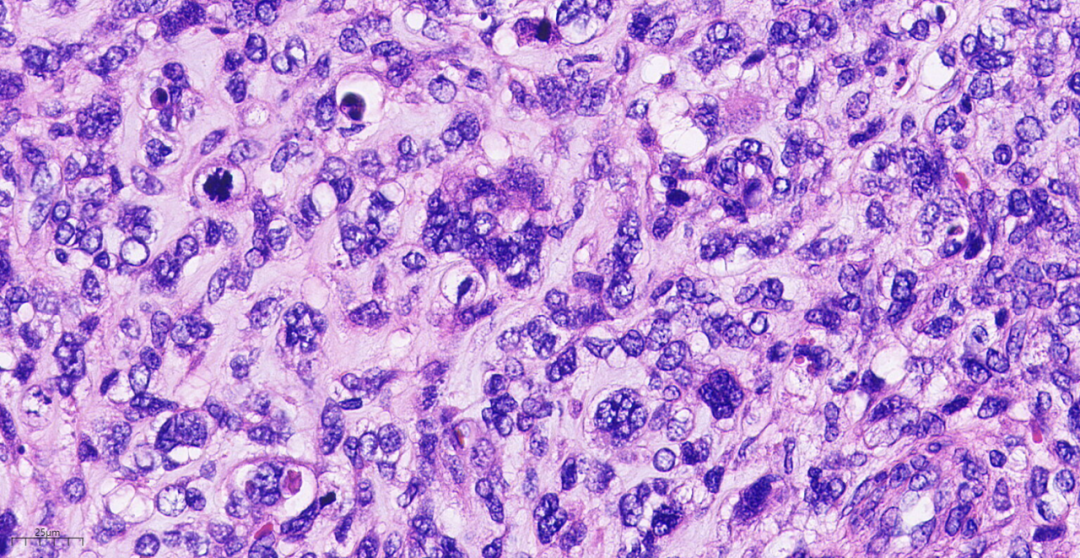
图16高倍镜下,细胞中到高度异型,细胞核圆形、卵圆形,大小不一,染色质粗糙,核仁不明显,核分裂象易见,胞质丰富。
3.3免疫组化(图17-图22)
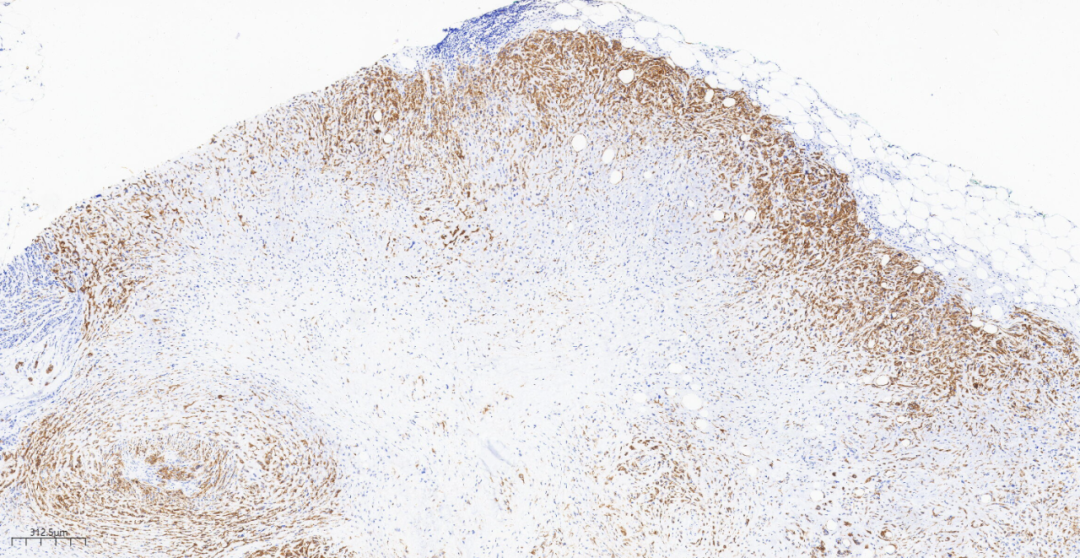
图17 免疫组化示周围密集肿瘤细胞CK(+),中间软骨样分化区域散在阳性.
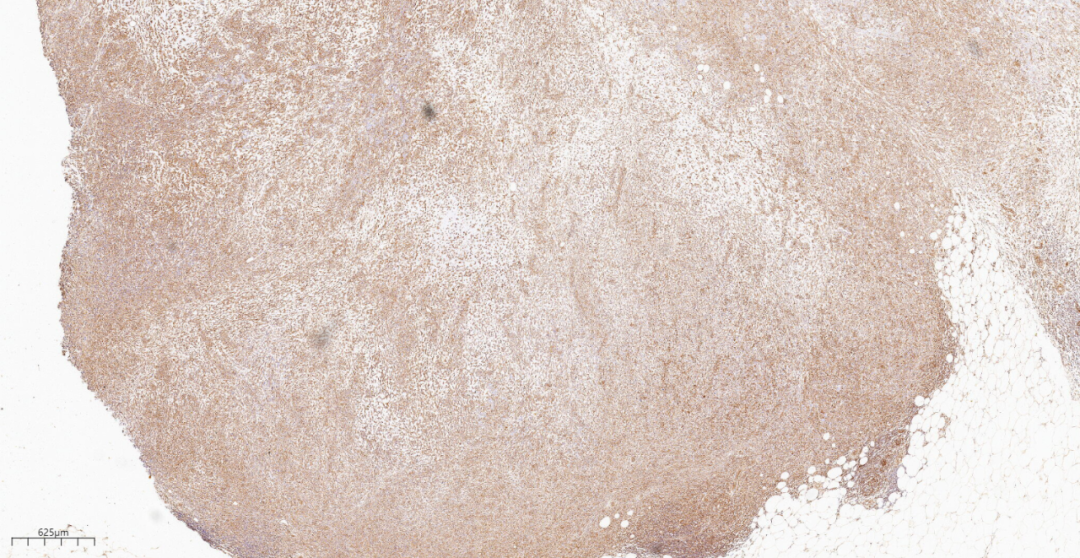
图18 免疫组化示大部分肿瘤细胞Vimentin(弥漫+).
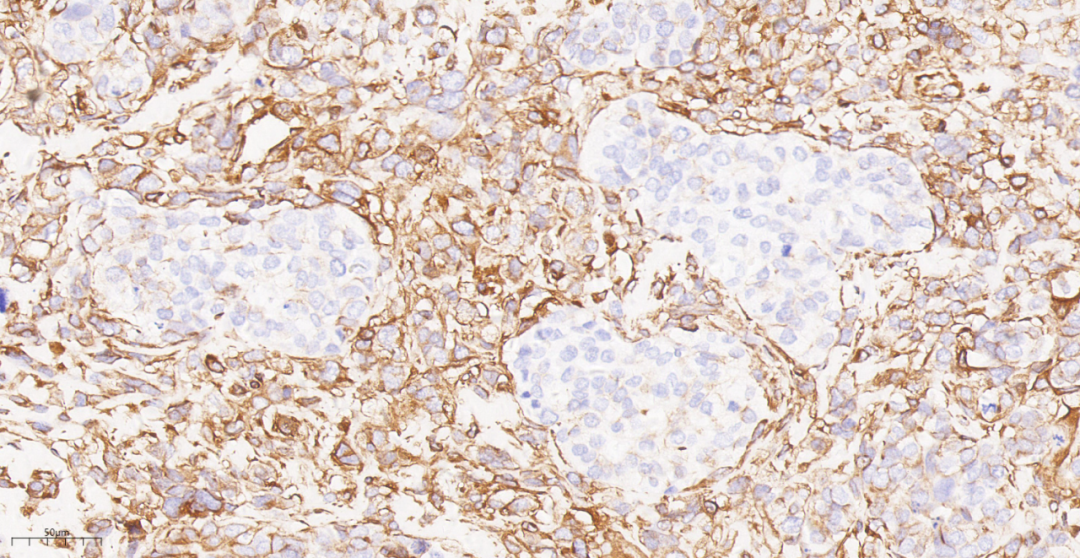
图19 免疫组化示部分肿瘤细胞Vimentin(-).
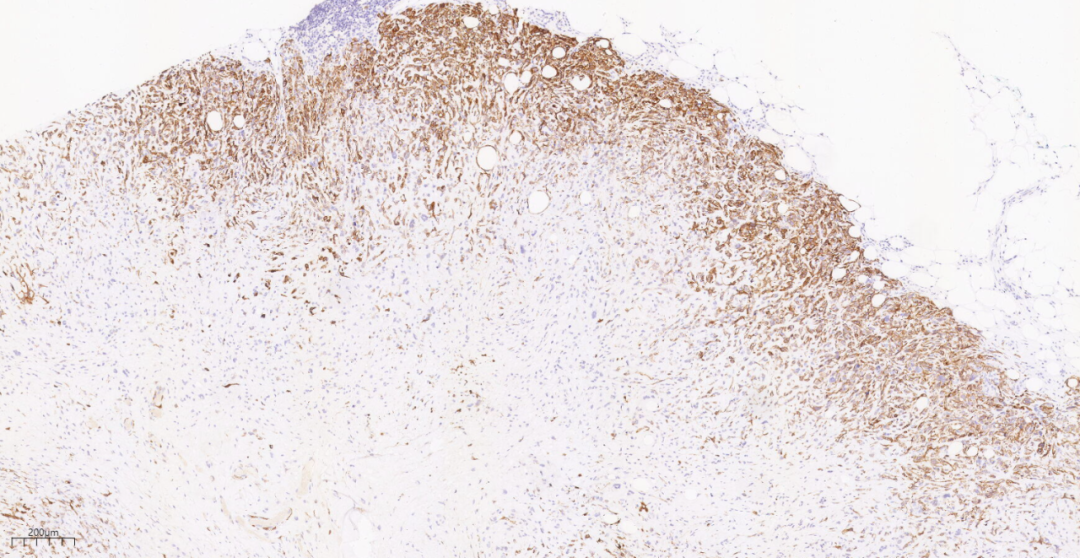
图20 免疫组化示肿瘤细胞CK5/6(+).
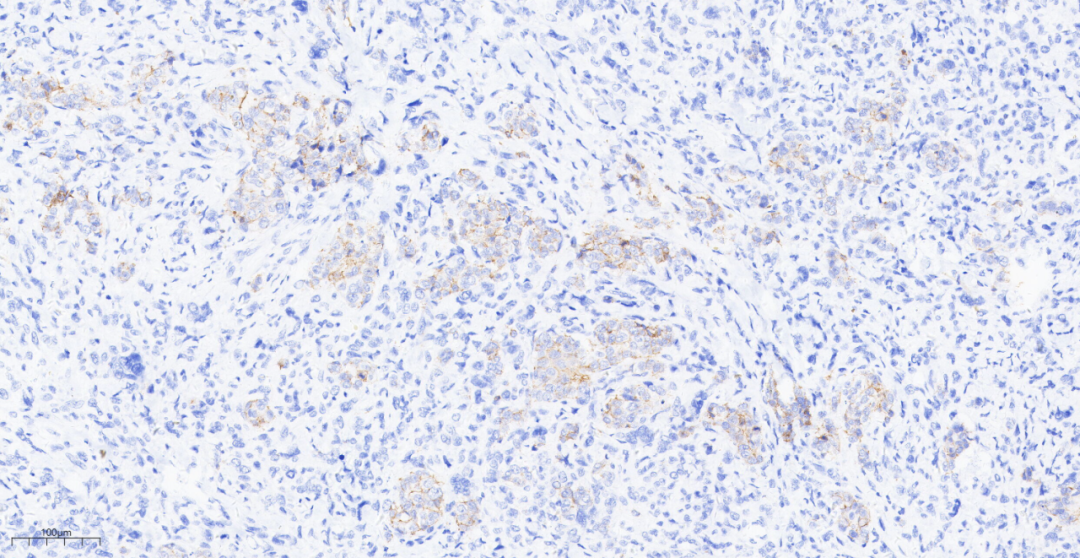
图21 免疫组化示化生性癌E-cadherin(-),而浸润性导管癌E-cadherin(膜+).
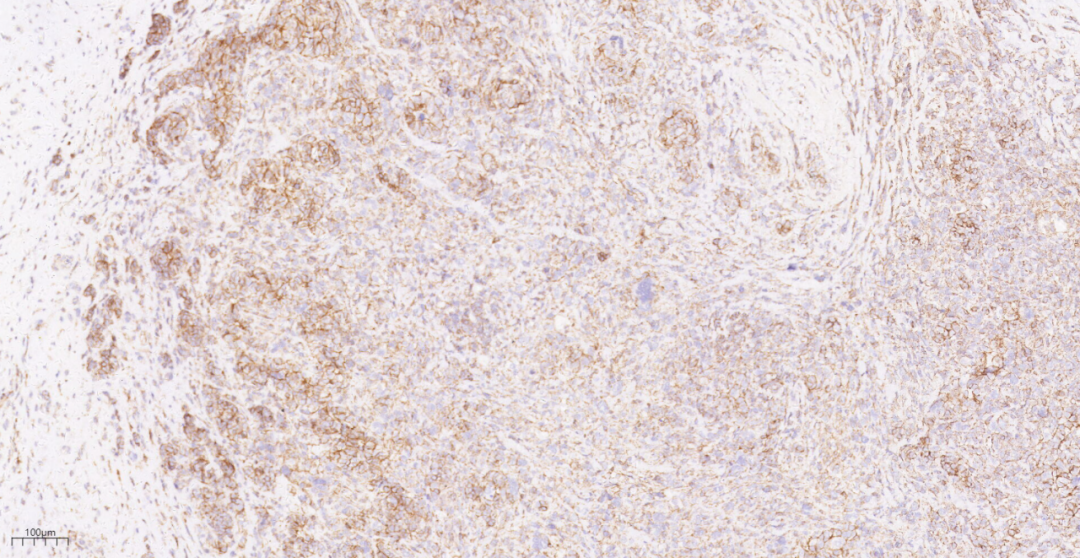
图22 免疫组化示化生性癌P120(不完整膜+/-),而浸润性导管癌P120(膜++).
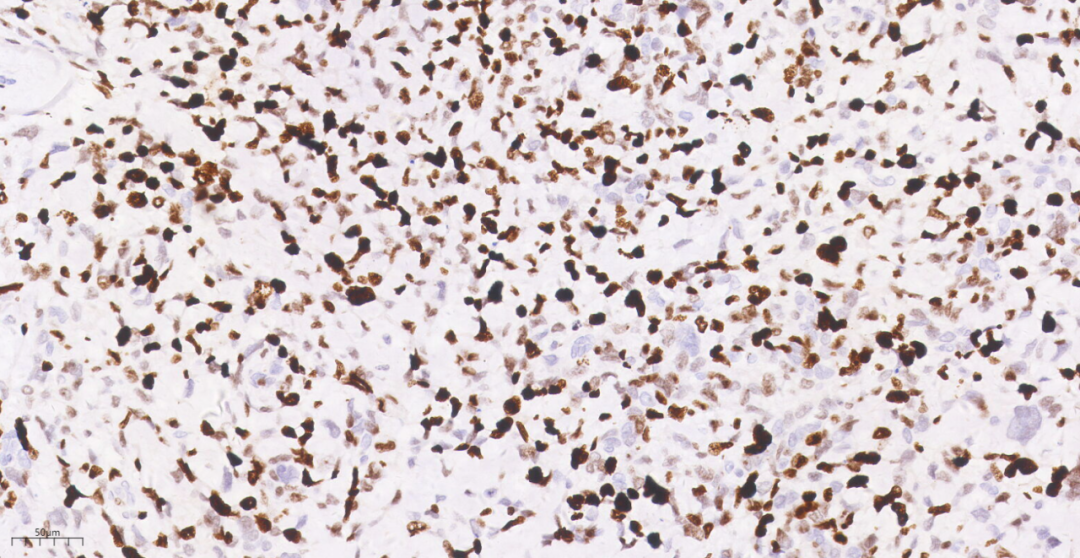
图23 免疫组化示肿瘤细胞Ki-67(50%,+).
免疫组化示
化生性癌成分:圆形、梭形肿瘤细胞CK(部分+),Vimentin(+),CK5/6(+),E-cadherin(-),P120(不完整的膜+/浆+),S-100(部分+),IDH-1(部分+),SMA(部分+),ER(0),PR(0),HER2(0),Ki-67(50%,+);
浸润性导管癌成分:周围散在巢团腺样肿瘤细胞CK(+++),Vimentin(-),E-cadherin(膜+),P120(膜+),CK5/6(+),SMA(-),S-100(-),IDH-1(-),ER(0),PR(0),HER2(0),Ki-67(50%,+);
结合CK5/6、Calponin标记结果提示肿瘤实质内肌上皮细胞缺失。
04 病理诊断:
(右)乳腺浸润性癌+特殊类型的混合型癌(伴软骨样分化的化生性癌占70%,浸润性乳腺癌 非特殊类型 2级占30%)。
讨 论
01 背景:
乳腺化生性癌(metaplastic breast carcinoma,MBC)是一组定义为向鳞状上皮和/或间叶方向分化为特征的恶性肿瘤,在乳腺癌中占比不足1%.较非特殊型乳腺癌,其侵袭性更强,预后差。根据WHO(2019)乳腺肿瘤分类标准,MBC分为低级别腺鳞癌、纤维瘤病样化生性癌、梭形细胞癌、鳞状细胞癌、伴间叶分化的癌和混合性癌。ICD编码为8575/3。
乳腺产生基质的癌( matrix-producing carcinoma,MPC),又称乳腺分泌基质的化生性癌,是 MBC中更为少见的一种组织学亚型,由Wargotz和Norris学者于1989 年首先提出并命名,其形态学特征是由浸润性癌直接过度为黏液软骨样和/或骨样基质,而不存在介于其间的梭形细胞肉瘤样区或破骨细胞。2012版及新版(2019版)乳腺肿瘤 WHO 分类把MPC归人伴间叶分化的 MBC,新分类中对MPC只进行了简略的组织学描述,但没有对其临床病理特点单独展开阐述,国内外文献多为个案或小样本病例报道,且对其预后报道各不相同。
02 MPC的临床病理特征:
2.1临床特点
乳腺MPC发病年龄27~84岁,平均年龄50岁,临床表现为一侧乳腺迅速扩大、边界较清楚的无痛性肿块,乳房肿块与其他浸润性癌无区别。MPC的细胞起源尚不清楚,超微结构分析支持肿瘤细胞为上皮和肌上皮来源可能,电镜下可见桥粒样连接、肌动蛋白微丝和张力微丝。也有学者推测其可能起源于一种具有多种分化潜能的乳腺干细胞。
2.2影像学
CT扫描和磁共振成像表现为低密度肿块,具有周围环状结构增强的特点。
2.3病理学特征
肉眼观:
大体多为结节状肿块,界限较清,少部分周围有不规则浸润,肿瘤大小通常2~4 cm。最大达20 cm,切面灰白、灰红,质较硬,部分有胶样外观,可有钙化及骨化,中央可有囊性变或出血、坏死。
镜下观:
乳腺MPC镜下多呈单结节或多结节状,部分呈浸润性生长,组织学特征性表现为浸润性癌直接向软骨/软骨黏液样基质过渡.无介于中间的梭形细胞化生区。新分类中提出即使有灶状梭形细胞区也不能排除诊断MPC。
根据肿瘤细胞的分布方式,结节可分为周围型和弥漫型:
①周围型:结节周边肿瘤细胞丰富,瘤细胞呈巢团状、腺管样小梁状及条索状浸润性生长,由外向内肿瘤细胞逐渐减少,黏液软骨样基质逐渐增多,结节中央可伴出血、坏死、囊性变。
②弥漫型:结节内在黏液软骨样基质背景中肿瘤细胞分布较均匀,从外向内细胞密度无明显差别。
根据是否伴其他浸润性成分可分为单纯型和混合型:
①单纯型MPC是指肿瘤完全由化生性成分构成。
②混合型则是指肿瘤由癌和化生性成分共同构成,一般癌的成分大于10%组织学类型多为2/3级非特殊型浸润性癌(IBCNST),也可见浸润性小叶癌、黏液癌,或起源于微腺性腺病的浸润性癌等。
有一种以上成分组成的MPC,一般不推荐使用“混合性”MPC诊断名称,只需在报告中注明组织学类型及所占比例即可。这与含有不同组织学亚型的MBC使用“混合性MBC”不同。MPC由于肿瘤细胞形态多样及丰富的细胞外基质,细针穿刺涂片较难明确诊断,即使粗针穿刺标本也由于组织有限,鉴别诊断困难,通常作为描述提示性诊断,不建议直接诊断,需在手术标本中综合评估。单纯型MPC在术中冰冻时容易被误诊为黏液纤维瘤、多形性腺瘤等良性病变,因此需格外警惕,并对剩余组织充分取材,仔细寻找上皮性成分,避免漏诊。
免疫表型及特染:
乳腺MPC免疫表达通常呈基底样亚型,即ER、PR、HER2均为阴性,CK5/6和EGFR阳性表达,但也有少部分病例可表达ER或PR或HER2,也有病例不表达CK5/6和EGFR, S-100常阳性,肌上皮标记物阴性或少量阳性。大部分P53显示突变型。肿瘤细胞包括伴发的其他浸润性癌成分,表现为上皮和间叶标记物双向表达(CK+、Vimentin+)。有文献回顾归纳了900余例MBC免疫组化的表达情况.其中50例MPC免疫组化表达情况分别为:panCK 98%,Vimentin 98%,EMA 94%,p63 79%,S-100 9l%,EGFR 72%,ER 3%,PR 4%,HER2 2%。E-cadherin和P120阳性表达不一, 最近发现SOX10具有诊断价值,在大多数软骨样(产生基质的)特征的化生性癌中表达。
特殊染色:软骨黏液样基质AB-PAS特殊染色呈淡蓝色。
分子遗传学:
乳腺MBC有复杂的分子遗传学改变。包括基因突变、拷贝数变异等。MBC中最常见的突变基因是P53, 突变率为58.7%,但其突变频率低于其他三阴乳腺癌(约88%)。PIK3CA是MBC中第二常见的突变基因,突变率为32.8%,PIK3CA突变多见于梭形细胞癌和鳞状细胞癌,在MPC 发生率约为15%;除了PIK3CA突变,与该通路相关的其他基因包括PTEN、PIK3R1、NF1、HRA和KT1等在MBC中有少量突变.
03 鉴别诊断 :
乳腺MPC主要应与以下肿瘤相鉴别:
(1)其它类型化生性癌:不产生软骨粘液样基质,且MPC一般没有梭形细胞成分,混合性化生性癌往往具有多种成分,免疫组化和形态容易鉴别。
(2)伴中央无细胞区的浸润性癌(central acellular carcinoma,CAC):低倍境下呈结节状,肿瘤周围细胞丰富而中央细胞稀少,与周围型MPC相似。但CAC肿瘤富细胞区与中央区无明显移行,周围与近中央区瘤细胞大小较一致,中央为嗜酸性玻璃样变的胶原或坏死.周围型MPC富细胞区与中央区细胞逐渐减少细胞由大变小,伴有明显的嗜碱性软骨黏液样间质。MPC有粘液软骨样基质,从有细胞区到无细胞区为逐渐过渡,且表达S-100和SOX10,而后者则是突然坏死,转化没有过渡。
(3)恶性叶状肿瘤:恶性叶状肿瘤上皮为良性,有叶状结构,恶性叶状肿瘤可伴异源性的骨或软骨分化。但特征性的分叶状结构,分布较为规律的良性导管上皮,上皮周围瘤细胞更为致密以及瘤细胞不表达上皮标记如CK、EMA和CK5/6。
(4)原发或转移性软骨肉瘤:单纯型MPC需与软骨肉瘤相鉴别,乳腺原发软骨肉瘤罕见,且无上皮成分。有学者认为认为“乳腺骨/软骨肉瘤”实际上是缺乏或仅含少量IBC-NST成分的MPC,充分的组织取材、使用一组上皮标志物来确认肿瘤的上皮分化有助于MPC的诊断。
(5)黏液癌:一般间质为粘液,无软骨样基质,细胞为低核极,通常ER,PR阳性,S-100和SOX10阴性。MPC的基质成分较多时,易误诊为黏液癌,特别是穿刺活组织检查标本,此时可以加做免疫组织化学(ER、PR、HER2、CK5/6、CK14及S-100)和阿辛蓝染色(黏液软骨样基质呈蓝色),必要时完整切除肿块。
(6)产生细胞外黏蛋白的浸润性小叶癌:其黏液成分可能与MPC基质相混淆,但其显示浸润性小叶癌形态,ER、PR和HER2表达,缺乏E-cadherin表达 。 [ 14 ]。
(7)乳腺多形性腺瘤:多形性腺瘤也有黏液软骨样基质,但是多形性腺瘤细胞异型性小,形态温和,缺乏浸润性癌成分。
04 治疗及预后 :
MPC几乎全部为三阴性乳腺癌,对内分泌治疗及靶向HER2治疗反应有限,其治疗手段一般是手术联合放化疗。近年来,新辅助化疗也应用于MBC的治疗,与其他类型MBC相比,MPC获得了更高的病理完全缓解率。并且,新辅助化疗后的病理学完全缓解已被证明是生存的独立预测因素。有研究表明,肿瘤直径>5cm、淋巴结转移和高级别基质与较差的预后相关 ,低级别基质所占比例越多的肿瘤有更好的预后。
综上所述,MPC是一种罕见的MBC亚型,其浸润性癌成分直接转化为黏液软骨样基质,无介于中间的梭形细胞肉瘤样化生成分过渡,常呈三阴性免疫表型,Vimentin及S-100弥漫阳性,基底样标志CK5/6、CK14及EGFR部分或者局灶阳性。治疗一般是手术联合放化疗,也可行新辅助化疗。
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
[1] 何春燕,支文雪,王志强,等. 乳腺产生基质的癌[J]. 诊断病理学杂志,2023,30(3):287-289. DOI:10.3969/j.issn.1007-8096.2023.03.022.
[2] 刘珊,胡红芳,程波,等. 乳腺分泌基质的癌临床病理特点和文献复习[J]. 诊断病理学杂志,2022,29(11):1015-1018. DOI:10.3969/j.issn.1007-8096.2022.11.007. [3] 杨家佳,丁志燕,刘爽,等. 乳腺产生基质的化生性癌2例并文献复习[J]. 肿瘤研究与临床,2022,34(3):221-223. DOI:10.3760/cma.j.cn115355-20211013-00466. [4] 陆保成,陈智敏,潘思琼,等. 22例乳腺化生性癌临床病理特征分析[J]. 诊断病理学杂志,2023,30(5):433-436,441. DOI:10.3969/j.issn.1007-8096.2023.05.005.
[5]苑著,屈翔,张忠涛,等. 伴有骨及软骨分化的乳腺梭形细胞化生性癌诊治探讨[J]. 临床和实验医学杂志,2019,18(13):1427-1429. DOI:10.3969/j.issn.1671-4695.2019.13.024.
[6]Kusafuka K, Muramatsu K, Kasami M, Kuriki K, Hirobe K, Hayashi I, Watanabe H, Hiraki Y, Shukunami C, Mochizuki T, Kameya T. Cartilaginous features in matrix-producing carcinoma of the breast: four cases report with histochemical and immunohistochemical analysis of matrix molecules. Mod Pathol. 2008 Oct;21(10):1282-92. doi: 10.1038/modpathol.2008.120.
[7]Downs-Kelly E, Nayeemuddin KM, Albarracin C, Wu Y, Hunt KK, Gilcrease MZ. Matrix-producing carcinoma of the breast: an aggressive subtype of metaplastic carcinoma. Am J Surg Pathol. 2009 Apr;33(4):534-41. doi: 10.1097/PAS.0b013e31818ab26e.
[8]刘彤华,《刘彤华诊断病理学》第4版.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)