首页 > 医疗资讯/ 正文
代谢功能障碍相关脂肪性肝病(MASLD)是全球范围内最为常见的慢性肝脏疾病,其患病率高达约30%,疾病谱系从单纯的肝脏脂肪变性逐步进展为代谢功能障碍相关脂肪性肝炎(MASH),并可能进一步发展为肝纤维化、肝硬化乃至肝细胞癌,这一过程给全球公共卫生系统带来了沉重的负担。MASLD的发病机制极为复杂,涉及慢性营养过剩、遗传易感性因素以及多种致病后果,其中肝脏炎症被认为是驱动单纯脂肪变性向脂肪性肝炎转变的关键事件。尽管近年来在MASLD的代谢异常机制研究方面取得了显著进展,但直接针对炎症过程的有效药物治疗仍然有限,因此深入探索其免疫病理机制并开发相应的免疫调节疗法显得尤为重要。

本综述系统梳理并整合了当前关于MASLD免疫学机制的多方面研究数据,重点采用了高通量技术如单细胞RNA测序、单核RNA测序、空间转录组学以及空间蛋白质基因组学等方法,这些技术手段极大地增强了对肝脏内免疫细胞异质性及其动态变化的理解。此外,文章还综合分析了临床前模型实验数据、人类肝脏组织样本研究以及多项临床试验结果,以评估不同免疫细胞亚群在MASLD发生发展中的具体作用及其潜在靶向治疗价值。通过这种多角度、多层次的研究方法,旨在构建一个关于MASLD免疫病理机制的全面框架,并为开发新型免疫干预策略提供理论依据。
在MASLD的免疫机制中,肝脏巨噬细胞扮演了核心角色,其群体构成和功能状态在疾病进程中发生显著变化。健康肝脏中绝大多数为胚胎来源的Kupffer细胞(EmKCs),但在MASLD发展过程中,这些驻留巨噬细胞数量减少,逐渐被骨髓来源的单核细胞衍生的巨噬细胞(MdMs)所替代。单细胞转录组分析揭示了MdMs在MASH肝脏中可进一步分为多个功能亚群,包括具有促炎和促纤维化特性的Ly6C高表达招募巨噬细胞、占据Kupffer细胞生态位的单核来源Kupffer样细胞(MoKCs)以及脂质相关巨噬细胞(LAMs)。LAMs特征性表达TREM2、SPP1、CD9等分子,它们在清除凋亡细胞、调节脂质代谢以及促进组织修复方面发挥重要作用,尤其是在疾病回归过程中,TREM2+ LAMs被证实是驱动纤维化消退的关键细胞群体。TREM2的功能研究显示,其在巨噬细胞介导的胞葬作用中至关重要,而MASLD状态下TREM2的脱落会导致胞葬功能受损,从而加剧慢性炎症。此外,循环中可溶性TREM2(sTrem2)水平与MASLD疾病活动度相关,显示出作为无创生物标志物的潜力。除了TREM2+巨噬细胞,其他如Basp1+髓系细胞和MS4A7+巨噬细胞也被发现通过调节炎症小体激活等机制参与MASLD的发病。
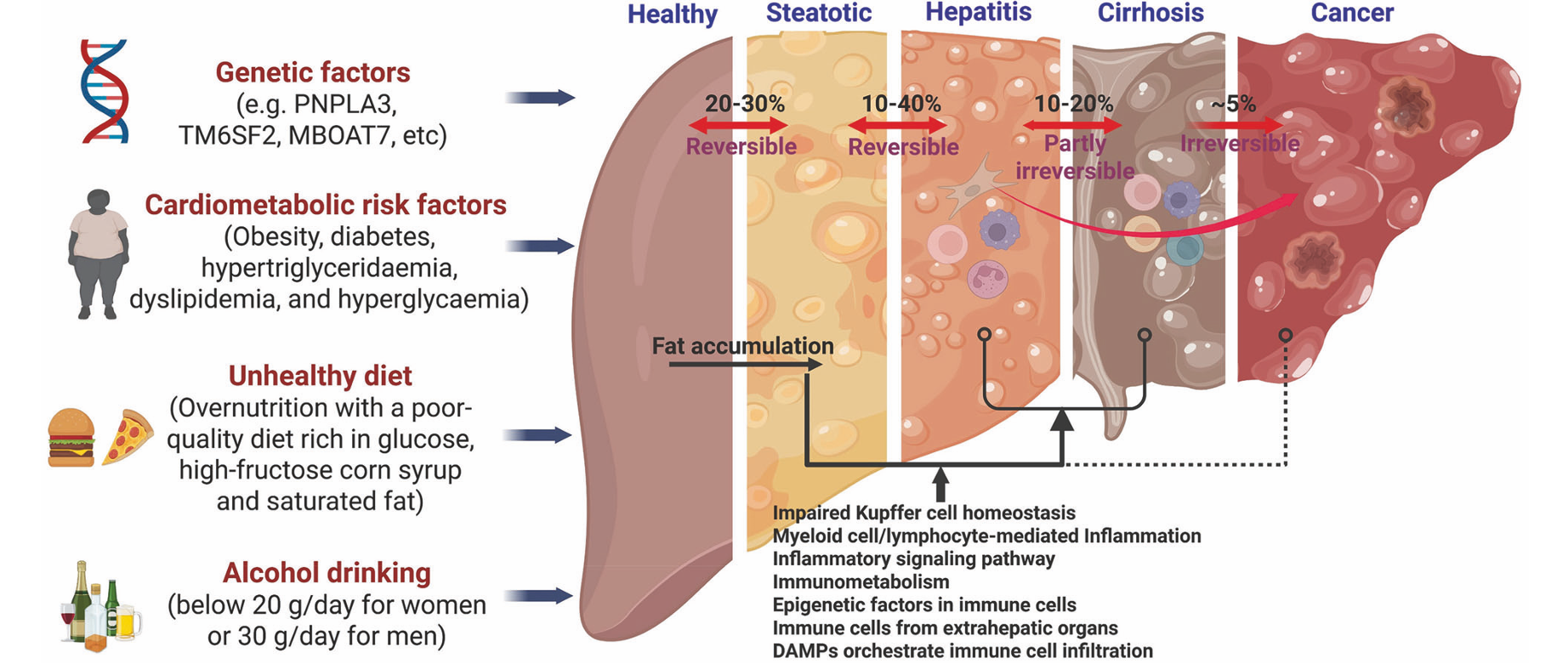
图1 MASLD的疾病谱系
中性粒细胞作为循环中最丰富的白细胞,在MASLD的 sterile 炎症过程中也发挥了重要作用。脂毒性肝细胞释放的CXCL1和IL-8等趋化因子可招募中性粒细胞至肝脏,中性粒细胞通过形成中性粒细胞胞外诱捕网(NETs)加剧MASH相关的肝纤维化。NETs能够诱导肝星状细胞(HSCs)的代谢重编程,促进其活化、增殖和迁移,这一过程部分通过Toll样受体3/环氧化酶-2通路实现。此外,中性粒细胞弹性蛋白酶(NE)在MASH的发病机制中也扮演了关键角色,其缺失在小鼠模型中显示出对西方饮食诱导的MASH的保护作用,血清NE水平或其与α-1-抗胰蛋白酶(AAT)的比值被认为是评估MASLD严重程度的潜在生物标志物。
淋巴细胞群体,包括T细胞、B细胞以及固有淋巴细胞(ILCs),在MASLD中表现出复杂且多样化的功能。CD4+ T细胞中的Th17亚群在MASH相关纤维化患者肝脏中显著富集,其产生的IL-17A、IFNγ和TNFα等细胞因子加剧了疾病进程。调节性T细胞(Tregs)在MASLD中的作用则存在争议,不同研究显示其在疾病不同阶段可能发挥促进或抑制炎症的双重作用,例如Tregs产生的双调蛋白(Areg)可通过激活表皮生长因子受体信号促进肝星状细胞的促纤维化转录程序。CD8+ T细胞,特别是肝脏驻留的CXCR6+CD8+ T细胞,在MASH环境中易受代谢刺激而诱发自身攻击行为。B细胞在MASLD中同样表现出双重角色,一方面B细胞缺失可缓解MASH进展,另一方面某些调节性B细胞亚群(如CD19+B220+CD5+CD1d+ B细胞)则通过表达PD-L1和IL-10等分子发挥免疫抑制效应。固有淋巴细胞(如NK细胞)和非常规T细胞(如NKT细胞、MAIT细胞)在肝脏炎症和纤维化调控中也占据重要地位,但其具体作用机制仍在深入探索中。
免疫代谢重编程是连接代谢异常与免疫应答的重要桥梁,在MASLD发病机制中占据核心位置。巨噬细胞的代谢状态,包括糖酵解、脂肪酸氧化、氧化磷酸化等途径的平衡,直接影响其炎症极化和功能输出。例如,Kupffer细胞中G蛋白偶联受体3(GPR3)的激活可通过β-抑制蛋白2与关键糖酵解酶形成复合物来促进糖酵解,从而抑制炎症并改善MASLD。β-抑制蛋白2在髓系细胞中的上调会通过影响免疫应答基因1(IRG1)的泛素化,导致衣康酸产生减少和琥珀酸脱氢酶活性增加,进而促进线粒体活性氧释放和炎症极化,加剧MASH。激活转录因子3(ATF3)作为应激诱导的转录因子,在肝巨噬细胞中表达下调与MASH评分负相关,其过表达可通过抑制FoxO1介导的糖异生和诱导CD36介导的游离脂肪酸摄取,促进脂肪酸氧化,从而改善糖脂代谢并保护 against MASH发展。此外,E2F2在巨噬细胞中的下调可通过增强SLC7A5表达,以亮氨酸-mTORC1依赖性方式促进糖酵解并损害线粒体功能,从而加剧肝脏炎症和脂质积累。
表观遗传调控机制,包括组蛋白修饰、非编码RNA和染色质可及性改变,在塑造免疫细胞功能和MASLD进展中发挥着重要作用。组蛋白H3 lysine 27乙酰化(H3K27ac)作为活跃增强子和启动子的标记,在MASLD肝脏中发生显著改变,特别是在Kupffer细胞的增强子景观重编程中至关重要。中性粒细胞胞外诱捕网(NETs)的形成涉及组蛋白H3瓜氨酸化,这一过程在MASLD发展中上调,并可通过诱导HSCs代谢重编程和Tregs分化促进纤维化和癌变。微RNA(miRNAs)作为细胞间通讯的关键媒介,在MASLD中具有重要调控功能,例如巨噬细胞来源的miR-223通过靶向肝细胞中的炎症基因和癌基因发挥保护作用,而miR-690则由Kupffer细胞产生,其补充可抑制肝脏脂肪变性、纤维化和炎症。巨噬细胞释放的富含miR-106b-5p的外泌体在TREM2缺失情况下会加剧肝细胞线粒体功能障碍,促进MASLD进展。染色质可及性分析(如ATAC-seq)揭示了MASLD中免疫细胞,特别是肝内Th17细胞和髓系细胞,其染色质开放区域的动态变化与免疫激活和代谢通路基因的调控密切相关。
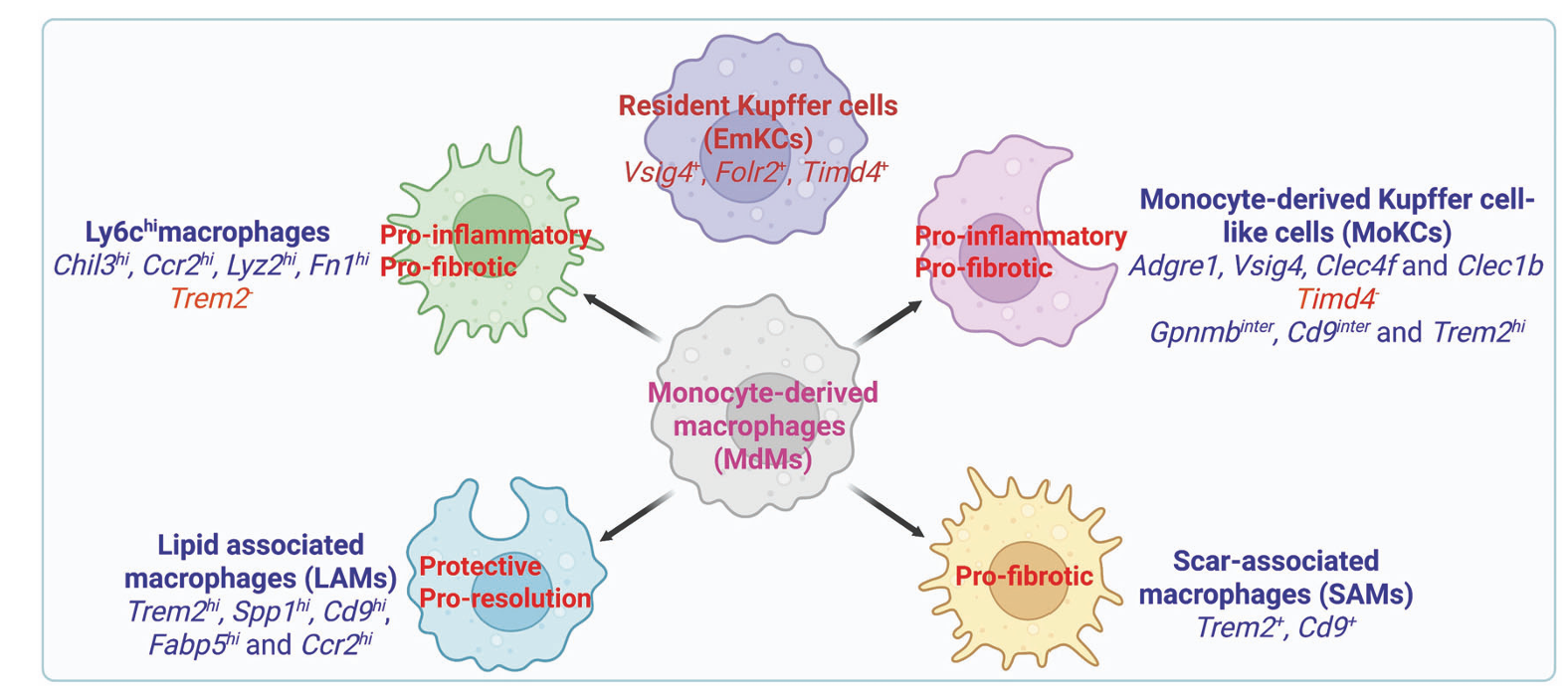
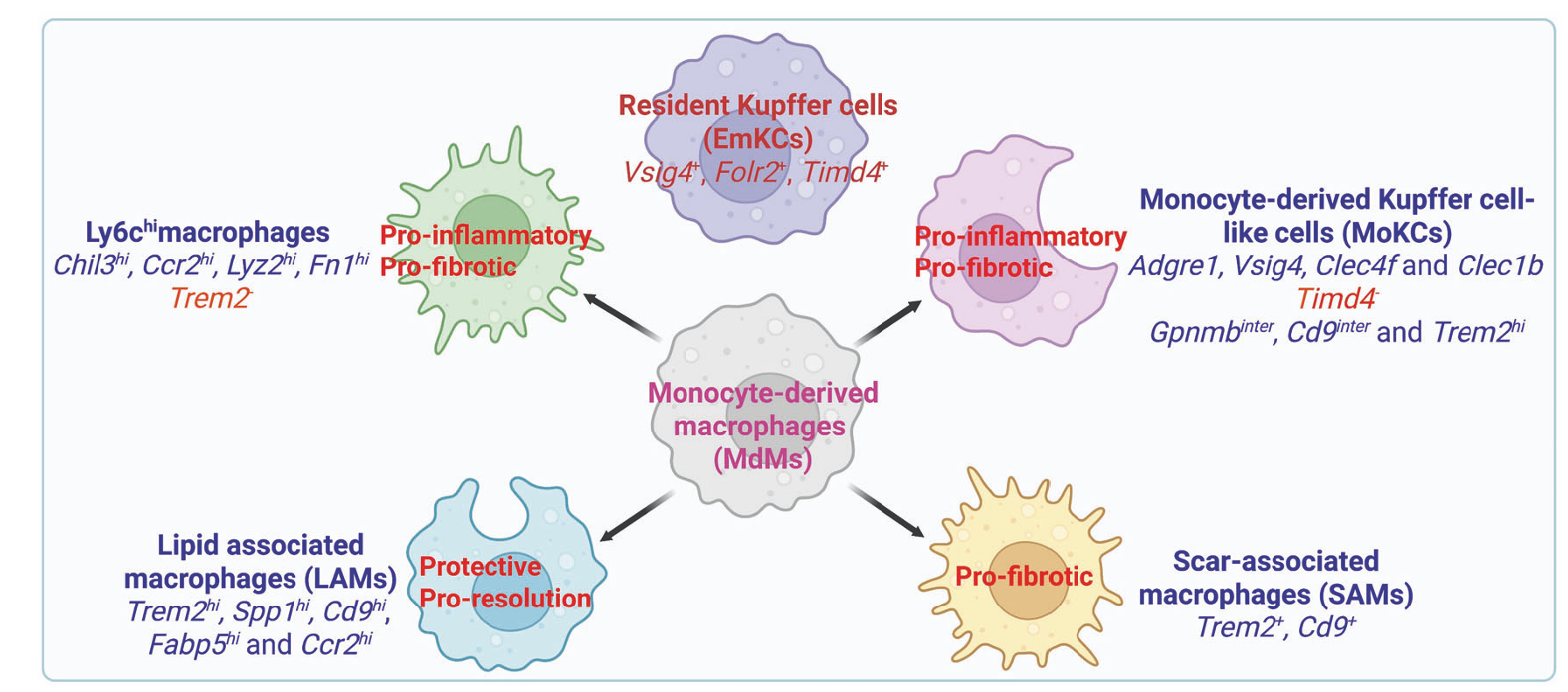
图2 基于转录组特征的肝脏巨噬细胞主要亚型在MASLD中的作用
多种炎症信号通路参与了MASLD中免疫细胞的调控。Notch信号通路通过RBPJ等分子调控单核来源巨噬细胞的分化,影响其炎症状态和脂质摄取能力,巨噬细胞中Notch1的激活可通过外泌体miR-142a-3p抑制TGFβR1表达,进而阻碍Treg分化,加剧肝脂肪变性。cGAS-STING通路作为感知胞质DNA的关键炎症信号轴,在MASLD中被肝细胞释放的线粒体DNA(mtDNA)激活,触发Kupffer细胞产生TNF-α和IL-6等促炎因子,髓系细胞特异性STING敲除可减轻肝脏脂肪变性、炎症和纤维化。CD47-SIRPα轴作为“别吃我”信号,在MASH肝脏中上调,其阻断可增强巨噬细胞对坏死性肝细胞的清除,减轻肝脏炎症和纤维化。
肝细胞在MASLD进程中不仅是代谢应激的靶点,也是主动调节免疫反应的重要参与者。肝细胞损伤后释放的损伤相关分子模式(DAMPs)、细胞外囊泡(EVs)以及多种趋化因子和细胞因子,共同协调了免疫细胞的肝脏浸润。例如,肝细胞来源的富含神经酰胺的EVs可通过整合素β1促进单核细胞粘附,IRE1A激活诱发的EVs释放可招募单核来源巨噬细胞并加剧炎症。肝细胞中腺苷激酶(ADK)过表达导致脂肪堆积和mtDNA释放,通过STING通路激活巨噬细胞。肝细胞在代谢压力下分泌NKG2D配体,激活γδ T细胞产生IL-17A,进而诱导肝细胞产生趋化因子,招募促炎髓系细胞。此外,肝细胞分泌的IL-33可驱动ILC2s积聚,而免疫细胞产生的乙酰胆碱可通过激活肝细胞CHRNA4受体,诱发钙内流和NF-κB/MAPK信号激活,促进TNF-α、CCL2和CCL5等因子的分泌,进一步放大免疫细胞浸润和肝脏炎症。
肝外器官,特别是脂肪组织和肠道,通过复杂的免疫互动参与MASLD的发病。脂肪组织巨噬细胞(ATMs)在肥胖相关胰岛素抵抗和肝脏炎症中起核心作用,其表型向促炎性CD11c+CD206-亚型的转变与代谢功能障碍密切相关。单细胞测序研究揭示了脂肪组织中独特的血管相关巨噬细胞亚群,如驻留血管相关巨噬细胞(ResVAMs)和代谢活跃巨噬细胞(MMacs),它们在维持血管完整性和免疫调节中发挥关键作用,而在MASH进展中这些保护性功能的丧失与代谢恶化和肝病加重相关。生长分化因子15(GDF15)在肥胖早期主要由脂肪组织巨噬细胞表达,而在MASH阶段则转为以肝细胞为主要来源,其调控机制复杂,可能成为治疗靶点。肠道作为“肠-肝轴”的重要组成部分,其菌群失调、细菌易位以及肠道免疫反应均深刻影响MASLD进展。肠道IL-33可促进菌群衍生的氧化三甲胺(TMAO)合成,加速MASLD,而肠道B细胞的活化可通过IgA-FcRγ信号轴独立于菌群驱动肝脏T细胞炎症和纤维化。针对肠-肝轴的干预,如燕麦β-葡聚糖、柚皮素纳米颗粒或限时喂养(TRF),显示出通过调节菌群和减少细菌易位缓解肝脏炎症和纤维化的潜力。
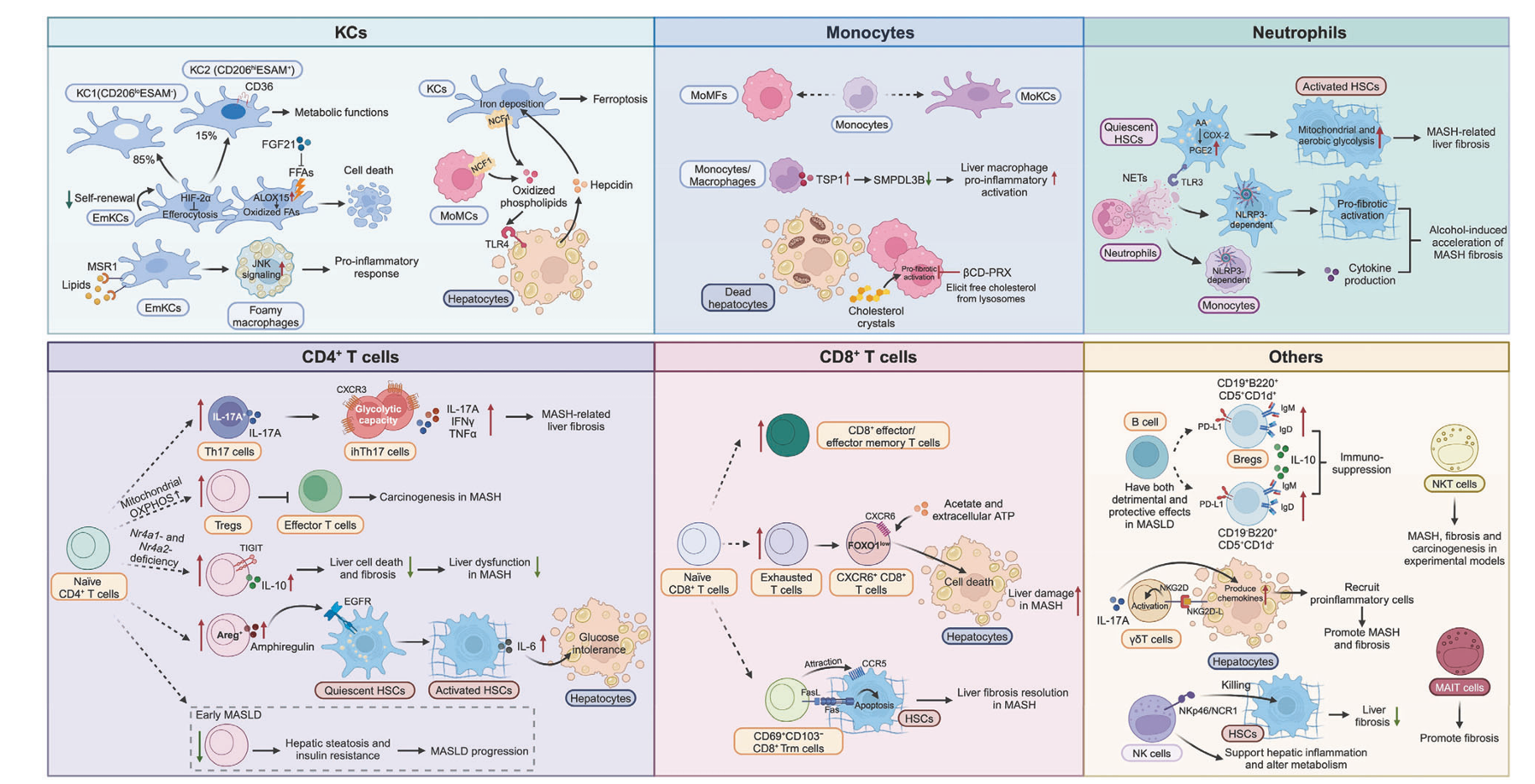
图3 不同免疫细胞在MASLD中的多样作用
在免疫调节治疗方面,尽管目前多数研发药物主要靶向代谢异常,但它们也间接影响免疫反应。GLP-1受体激动剂(如司美格鲁肽)及其与胰高血糖素或GIP的双/三重激动剂(如培维肽、苏伏鲁肽)在临床试验中显示出减轻肝脏脂肪含量、促进MASH缓解和纤维化改善的效果,其机制部分归因于全身代谢改善和抗炎作用。FXR激动剂(如奥贝胆酸)通过调节胆汁酸代谢和先天免疫细胞功能发挥治疗作用,但其临床应用受限于副作用。PPAR激动剂(如拉尼菲溴)作为泛PPAR激动剂,可同时靶向代谢、炎症和纤维化通路,在临床试验中显著改善MASH组织学活动度和胰岛素抵抗。FFAR1/FFAR4激动剂(如伊科沙布酯)通过促进胰岛素分泌和GLP-1释放,并发挥直接抗炎作用,在MASH患者中显示出纤维化改善趋势。低剂量阿司匹林通过抑制环氧合酶-2和血小板衍生生长因子信号,在随机试验中减少肝脏脂肪含量,展现出老药新用的潜力。白介素-22(IL-22)作为组织保护性细胞因子,可通过激活STAT3信号在肝细胞和肠上皮细胞中发挥抗炎和代谢调节作用,在临床前模型中有效缓解MASLD。
综上,MASLD是一种高度异质性的动态疾病,其炎症和纤维化活动受到遗传、表观遗传和环境因素的共同调控。尽管首个靶向药物Resmetirom(甲状腺激素受体β激动剂)已获批用于MASH治疗,但其疗效有限,未来治疗策略必将转向针对不同病理生理驱动因素的联合疗法。随着单细胞多组学技术、空间基因组学和人工智能等新方法的广泛应用,我们对MASLD免疫机制的理解将更加深入,为实现个体化精准治疗奠定基础。未来的研究需要进一步阐明中性粒细胞等相对被忽视的免疫细胞亚群在疾病中的作用,并关注新定义的MetALD(代谢和酒精相关肝病)亚组的独特免疫特征,以开发更有效的诊断工具和治疗方案。
原始出处:
He, Y., Chen, Y., Qian, S. et al. Immunopathogenic mechanisms and immunoregulatory therapies in MASLD. Cell Mol Immunol 22, 1159–1177 (2025). https://doi.org/10.1038/s41423-025-01307-5
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)