首页 > 医疗资讯/ 正文
【论著】
本研究挖掘分析自测单细胞核转录组测序(snRNA‑seq)数据,探讨N‑乙酰基转移酶10(Nat10)在丘脑出血后卒中后中枢痛(CPSP)中可能的机制,为CPSP治疗靶点提供科学依据。
1 材料与方法
1.1 第一部分:snRNA‑seq生物信息学分析
1.1.1 单细胞分析
数据来源为自测snRNA‑seq数据(GSE227033)。选择清洁级雄性C57BL/6小鼠4只,采用随机数字表法将小鼠分为对照组(C组)和CPSP模型组(M组),每组2只。M组小鼠通过立体定位仪,向右侧丘脑腹后内侧核和腹后外侧核内注射10 nl Ⅳ型胶原酶(Coll Ⅳ)(0.01 U/nl);C组小鼠注射等量生理盐水。造模后7 d提取右侧丘脑周围组织进行snRNA‑seq。Seurat包读取表达谱,并删除低表达基因,依次对数据进行标准化、均一化、主成分分析和统一流形逼近与投影(UMAP)分析处理。最后,ElbowPlot绘制最佳主成分数,celldex包对UMAP处理得出的细胞群进行注释。
1.1.2 Nat10与免疫因子之间相关性分析
使用CIBERSORT算法和TISIDB数据库(http://cis.hku.hk/TISIDB/)分析样本数据,验证Nat10与不同免疫因子之间的相关性。
1.1.3 基因集富集分析(GSEA)
根据关键基因的表达量,将其分为高低表达组,通过GSEA进一步分析两组之间的信号通路差异情况。亚型通路的背景基因集从MsigDB数据库下载。随后进行不同分组之间通路的差异表达分析,并根据一致性得分对显著富集的基因集进行排序。
1.2 第二部分:构建小鼠丘脑出血后CPSP模型,验证Nat10的表达及分布
1.2.1 实验动物及分组
清洁级雄性C57BL/6小鼠78只,小鼠编号后饲养于清洁级环境适应1周,采用随机数字表法将小鼠分为6组:对照组(Control组,23只)、CPSP组(23只)、生理盐水+空载体组(Saline+Vehicle组,8只)、生理盐水+抑制剂组(Saline+Remodelin组,8只)、胶原酶+空载体组(Coll Ⅳ+Vehicle组,8只)和胶原酶+抑制剂组(Coll Ⅳ+Remodelin组,8只)。
1.2.2 CPSP造模及Nat10特异性抑制剂(Remodelin)干预
CPSP组小鼠参照文献制备丘脑出血后CPSP模型。2%异氟烷麻醉诱导后,通过立体定位仪将Coll Ⅳ10 nl(0.01 U/nl)和(或)Remodelin10 mg/kg注射至小鼠右侧丘脑腹后内侧核和腹后外侧核。注射完毕后固定注射器25 min避免回流,随后碘伏清创并缝合头皮。Control组注射等量生理盐水。
1.2.3 行为学检测
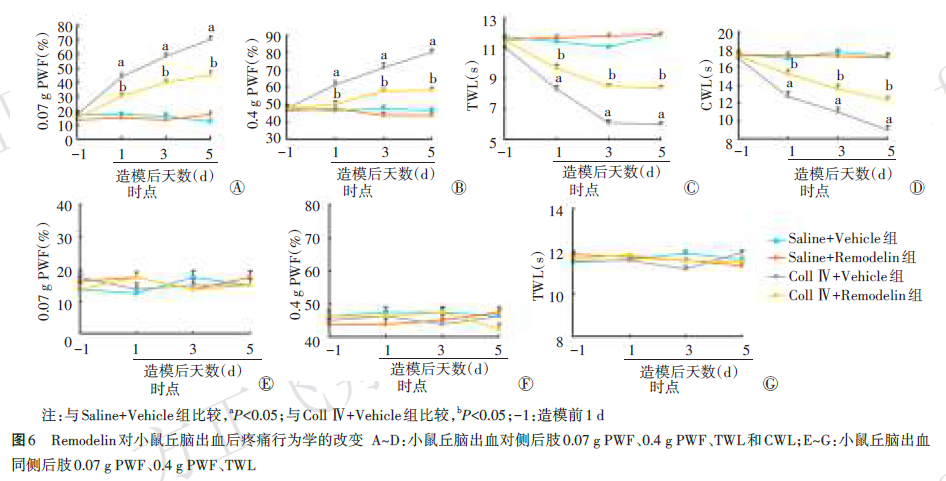
为了进一步验证Nat10在CPSP中的作用,本研究通过立体定位注射Coll Ⅳ建立了小鼠CPSP模型,于造模前1 d和造模后1、3、7、14 d分别测定Control组和CPSP组各8只小鼠后肢机械缩足频率(PWF)、热缩足潜伏期(TWL)和冷缩足潜伏期(CWL)。为了验证Nat10对CPSP的关键作用,本研究通过立体定位注射Remodelin,于造模前1 d和造模后1、3、5 d分别测定Saline+Vehicle组、Saline+Remodelin组、Coll Ⅳ+Vehicle组和Coll Ⅳ+Remodelin组各8只小鼠后肢PWF、TWL和CWL。所有测定均于上午在安静环境中进行。通过金属网箱和不同规格von‑Frey纤毛刺激小鼠足底,记录PWF;热辐射测痛仪照射小鼠足底,记录TWL,重复5次取平均值;低温铝板上测定CWL,重复3次取平均值。具体测定方法参考本课题组前期研究。
1.2.4 Nat10表达水平检测
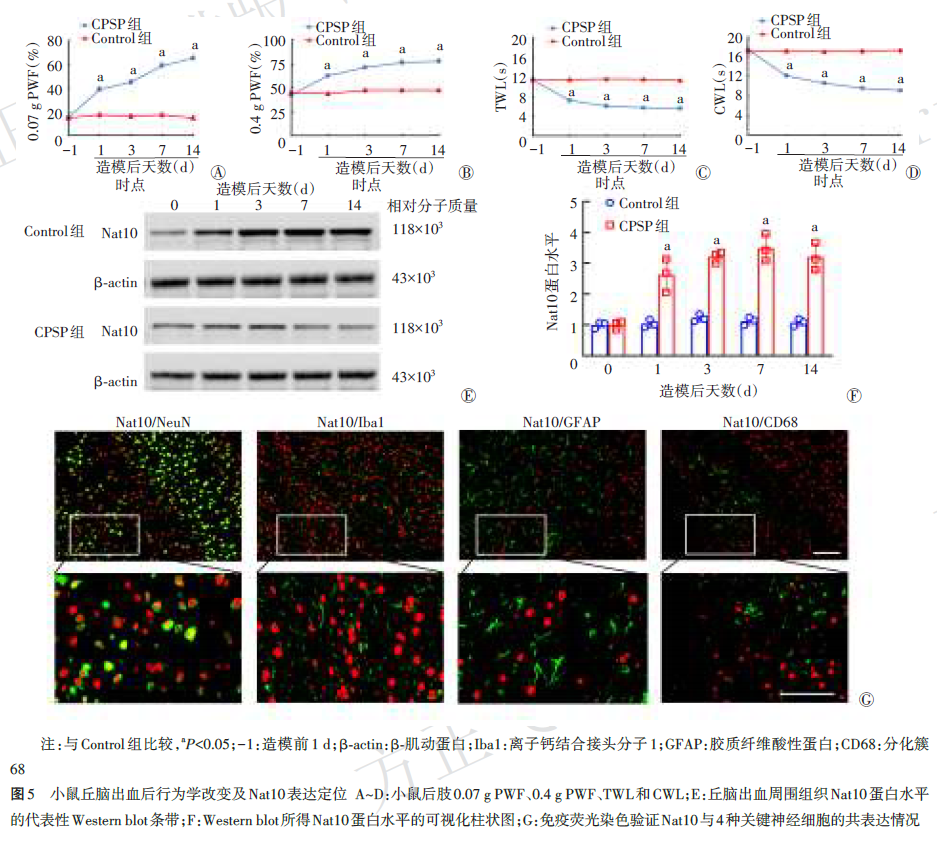
采用免疫印迹法(Western blot)检测出血丘脑组织Nat10表达。第0,1、3、7、14天,分别处死Control组和CPSP组各3只小鼠,取丘脑损伤部位周围组织匀浆后离心,上清液测定蛋白浓度并变性,经十二烷基硫酸钠‑聚丙烯酰胺凝胶电泳分离,转膜后兔源Nat10及β‑肌动蛋白一抗孵育过夜,辣根过氧化物酶标记的二抗孵育,电化学发光法显色并拍照,Image J分析蛋白相对表达量,以目的蛋白与内参的比值表示目的蛋白水平。
1.2.5 免疫荧光染色
造模后3 d,Control组和CPSP组各3只小鼠经灌注后取脑,并依次行石蜡包埋、脱蜡、封闭和一抗孵育:鼠源Nat10抗体分别和兔源神经元核抗原(NeuN)抗体、兔源胶质纤维酸性蛋白抗体、兔源离子钙结合接头分子1抗体和兔源分化簇68抗体混合后4 ℃孵育过夜。次日进行花青素3和Alexa Fluor® 488耦联的驴源二抗孵育,4′,6‑二脒基‑2‑苯基吲哚复染后荧光显微镜观察。具体方法参考本课题组前期研究。
2 结 果
2.1 第一部分
2.1.1 snRNA‑seq细胞分群
根据snRNA‑seq数据分析Nat10在丘脑出血后CPSP模型中的表达情况,结果表明,与C组比较,M组小鼠Nat10表达较高(P<0.05);对细胞分群注释获得少突胶质细胞、神经元、星形胶质细胞及小胶质细胞4种细胞亚型,而Nat10主要表达于神经元细胞。见图1。
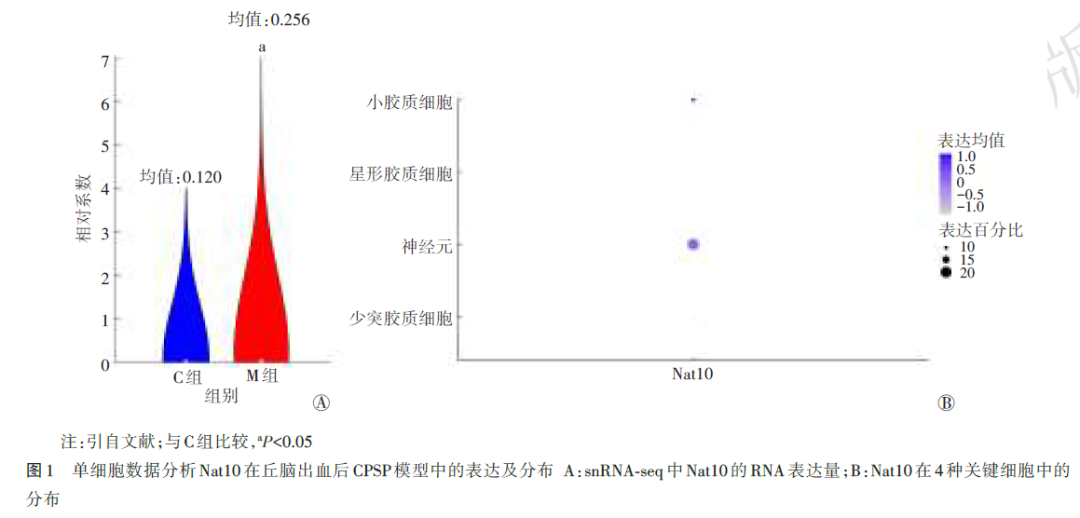
2.1.2 Nat10参与免疫浸润
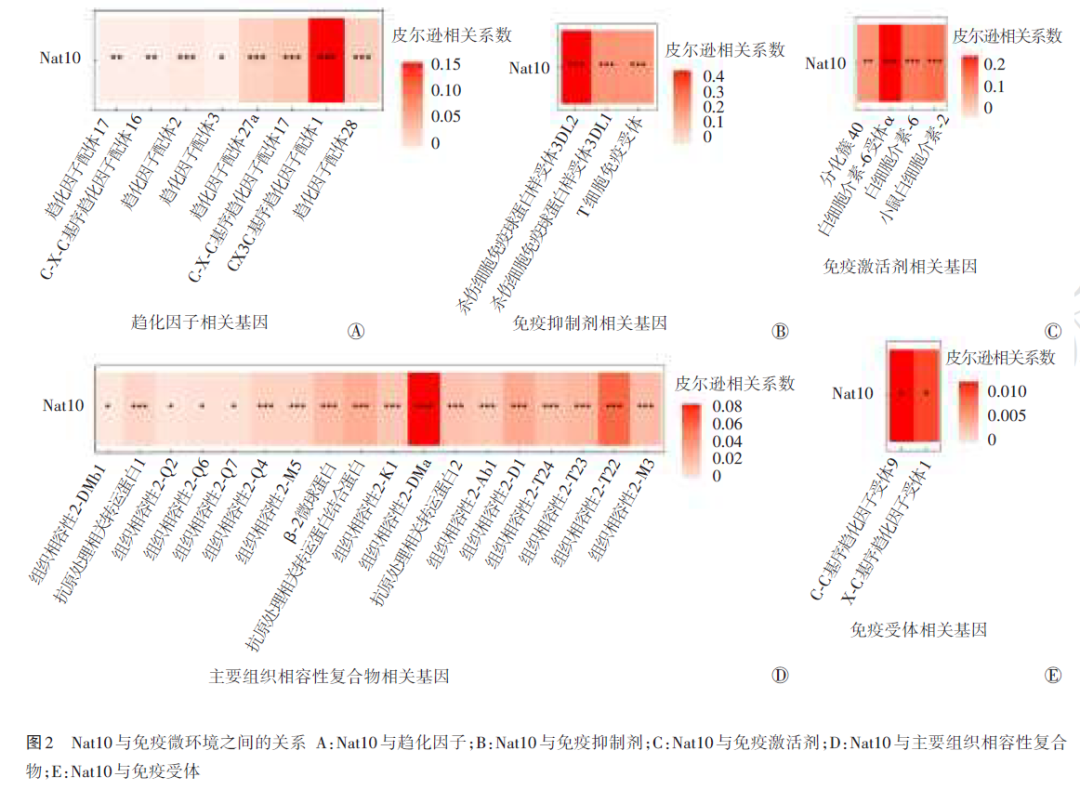
Nat10与不同免疫因子之间存在丰富的关联。细胞因子中最相关的是C‑C基序趋化因子配体28、C‑X3‑C基序趋化因子配体1和C‑X‑C基序趋化因子配体17,免疫抑制因子中最相关的是具有免疫球蛋白和免疫受体酪氨酸抑制基序结构域的T细胞免疫受体、杀伤细胞免疫球蛋白样受体3DL1和杀伤细胞免疫球蛋白样受体3DL2,最相关免疫刺激因子是白细胞介素‑6受体α、白细胞介素‑6和白细胞介素‑2,最相关趋化因子是主要组织相容性复合体Ⅱ类DMα链和组织相容性2,受体中最相关的则是C‑C基序趋化因子受体9和X‑C基序趋化因子受体1。见图2。
2.1.3 Nat10相关信号通路
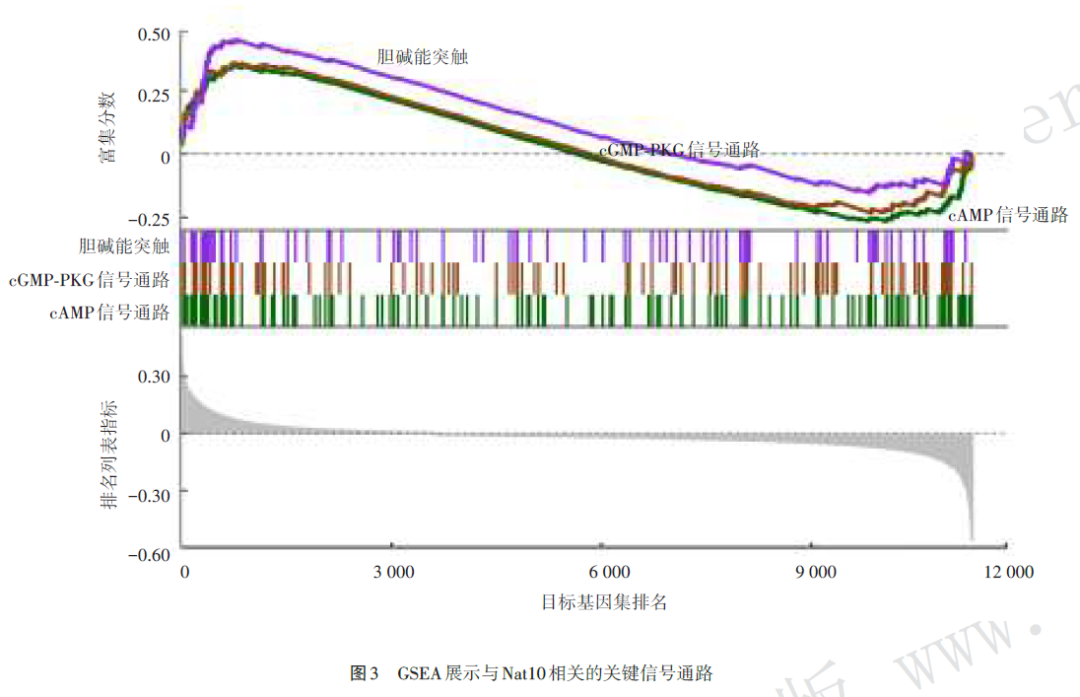
Nat10富集到环磷酸腺苷(cAMP)、环磷酸鸟苷‑蛋白激酶G(cGMP‑PKG)和胆碱能突触信号通路(图3)。
2.1.4 Nat10与Ⅳ型胶原蛋白α1链(COL4A1)的共表达
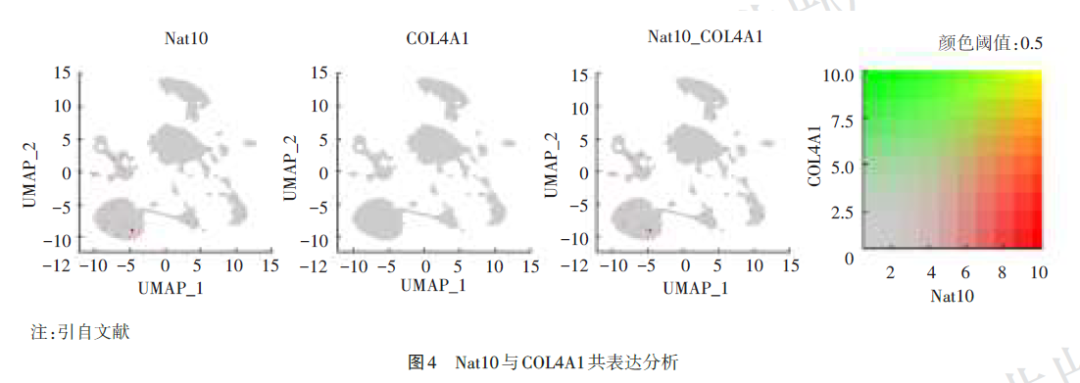
Nat10与疾病进展基因COL4A1主要在神经元中共表达(图4)。
2.2 第二部分
2.2.1 CPSP小鼠行为学及Nat10表达变化
与Control组比较,CPSP组小鼠造模后1、3、7、14 d丘脑出血对侧后肢PWF较高(均P<0.05),TWL和CWL较短(均P<0.05);出血侧丘脑组织Nat10表达水平在造模后1、3、7、14 d较高(均P<0.05)。免疫荧光染色显示出血侧丘脑组织中Nat10主要与NeuN共标。见图5。
2.2.2 Nat10抑制剂预防CPSP
与Saline+Vehicle组比较,Coll Ⅳ+Vehicle组小鼠造模后1、3、5 d丘脑出血对侧后肢PWF较高(均P<0.05),TWL和CWL较短(均P<0.05);与Coll Ⅳ+Vehicle组比较,Coll Ⅳ+Remodelin组小鼠造模后1、3、5 d丘脑出血对侧后肢PWF较低(均P<0.05),TWL和CWL较长(均P<0.05);4组小鼠各时点同侧后肢PWF和TWL差异无统计学意义(均P>0.05)。见图6。
3 讨 论
3.1 第一部分
本研究借助snRNA‑seq分析发现,Nat10在丘脑出血小鼠的脑组织中表达显著升高,并主要表达于神经元中,提示神经元可能是Nat10主要发挥作用的靶细胞。
免疫微环境稳态平衡在脑出血进程和转归中起着至关重要的作用,本研究发现,CPSP疾病进展过程中Nat10可能介导了免疫微环境紊乱,多种细胞因子和免疫细胞均和Nat10表达有关。
GSEA提示Nat10通过多条信号通路参与CPSP。同时,cAMP信号通路是否介导CPSP发生、发展,以及在CPSP发生、发展过程中Nat10与cAMP信号通路及其他信号通路之间的调控关系仍需更深入的研究。
3.2 第二部分
snRNA‑seq的分析结果也在Western blot和免疫荧光染色实验中得到佐证。
一些研究提示CPSP中发挥重要作用的Nat10可能更容易影响丘脑皮质投射神经元的功能。本研究中通过在造模前向丘脑注射Remodelin成功预防了CPSP诱导的痛觉超敏,但如果能通过静脉或者口服给予Remodelin则可以进一步推进其临床应用。
本研究还存在一些局限,没有通过进一步的实验去验证Nat10参与CPSP的下游通路,同时药理学实验缺乏浓度梯度实验去探索Remodelin治疗CPSP的最佳剂量。
国际麻醉学与复苏杂志,2025,46(09):899-900 .
DOI:10.3760/cma.j.cn321761-20250307‑01333
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)