首页 > 医疗资讯/ 正文
晶状体是透明的双凸结构,负责将光线聚焦到视网膜上。白内障,也称为晶状体混浊,是一种常见的与年龄相关的眼病,其特征是晶状体出现混浊和透明度下降,由晶状体蛋白聚集引起的白内障是全球视力损伤和失明的主要原因。据估计,全球有超过9500万人患有白内障,衰老和氧化应激、基因突变、创伤、辐射、长期使用皮质类固醇和代谢异常等因素可破坏晶状体稳态,最终导致白内障形成。迄今为止,针对白内障尚无治疗药物,恢复视力的唯一方法是白内障手术。手术治疗能快速恢复患者视力,但由于禁忌症限制以及欠发达地区专业知识储备不足等原因,全球只有不到五分之一的白内障患者接受了手术干预。因此,开发可逆转白内障的非手术药物治疗方法具有广阔的应用前景。
2025年09月26日,南方科技大学第一附属医院李斌教授团队在《Nature Communications》杂志在线发表了题为“Ocular delivery of lipid nanoparticles-formulated mRNA encoding lanosterol synthase ameliorates cataract in rats”的工作。该研究本研究开发了一种新型芳香化脂质纳米粒(LNPs),该LNPs通过前房给药后,其mRNA递送效率是SM-102 LNPs(临床批准使用的mRNA疫苗递送载体)的七倍以上,且不会引起明显的眼部损伤。利用该LNPs将编码人羊毛甾醇合酶的mRNA(hLSS mRNA)递送至两种大鼠白内障模型的晶状体中,可显著提升晶状体内hLSS蛋白和羊毛甾醇水平,从而抑制晶状体蛋白的聚集和晶状体细胞的凋亡,最终通过增加晶状体透明度改善了白内障症状,为白内障的治疗提供了一种潜在的非手术药物干预策略(图1)。

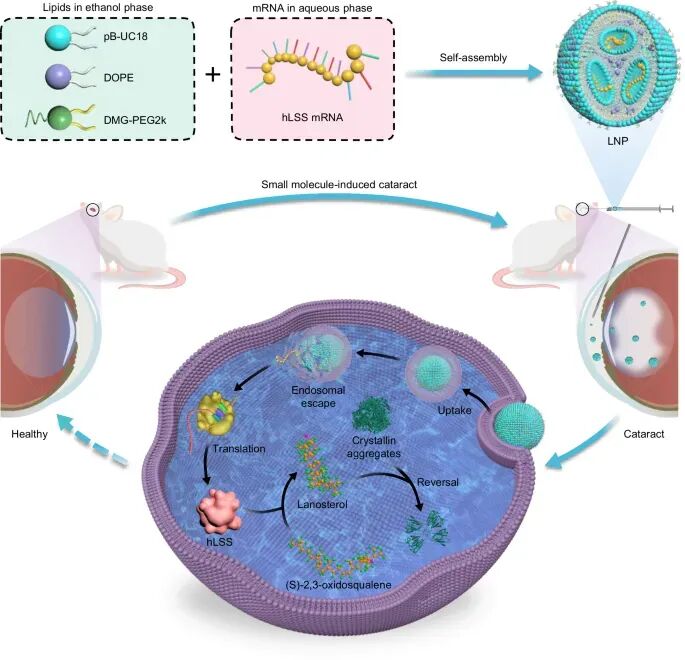
图1. 负载hLSS mRNA的脂质纳米制剂用于白内障的治疗
晶状体蛋白是透明的、水溶性的折射蛋白,维持晶状体的透明度和高折射率。晶状体蛋白聚集是驱动白内障发展的关键致病机制。因此,抑制晶状体蛋白聚集代表了开发抗白内障药物的潜在策略。羊毛甾醇合酶(LSS,也称为2,3-氧化角鲨烯-羊毛甾醇环化酶)是一种环化酶,催化(S)-2,3-氧化角鲨烯环化为羊毛甾醇,并在调节晶状体蛋白聚集和增强晶状体透明度中起关键作用。LSS基因突变可在动物和人类中诱导白内障形成。此外,使用LSS抑制剂已被证明可在动物模型中诱导晶状体混浊。近年来,有报道称天然存在的三萜类羊毛甾醇及其合成类似物可通过减少晶状体蛋白的异常聚集来缓解白内障形成。然而,此类化合物的溶解度有限且半衰期较短,严重限制了其应用转化。
mRNA代表了一类新兴的核酸药物,在疫苗之外的蛋白替代疗法、再生医学、癌症免疫治疗和基因编辑等方面具有巨大潜力。基于mRNA的治疗允许外源mRNA直接在细胞质中翻译,避免了转基因整合引起的插入突变风险。然而,mRNA属于带负电的生物大分子,其固有的不稳定性和细胞膜不通透性,导致mRNA疗法的发展严重依赖于mRNA递送系统的进步。李斌教授团队多年来致力于开发安全高效的mRNA递送系统,目前已开发出静脉给药后特异性靶向脾脏的双组分tB-UC18 LNPs(Advanced Materials2021, 33, 2101707; Materials Horizons 2023, 10, 466)、静脉给药后特异性靶向肺部的双组分qtB-UC18 LNPs(Theranostics 2024, 14, 830)、肌肉给药后特异性靶向淋巴的四组分CF3-2N6-UC18 LNPs(Nature Communnications 2025, 16, 4241)、负载于水凝胶后在伤口原位释放mRNA的pB-C12 LNPs(Journal of Controlled Release 2025, 387C, 114258)等LNPs。在本研究中,研究人员发现同时含有芳香骨架、两个仲胺和两个单不饱和C18尾的新型脂质材料tB-UC18,可作为可电离组分将mRNA高效递送至眼部。优化后的tB-UC18 LNPs显示良好的稳定性和内体逃逸潜力以及较低的溶血活性,并且可通过多种途径(网格蛋白介导途径、小窝蛋白介导途径、巨胞饮途径)内化进入细胞中(图2)。
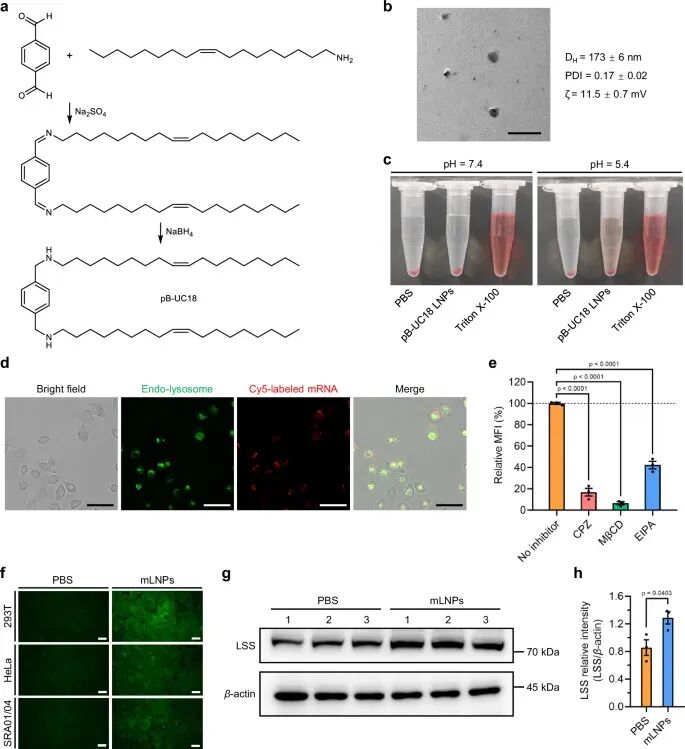
图2. mRNA脂质纳米制剂的理化性质及生物活性
为了探索眼部递送途径对体内mRNA递送效率的影响,研究人员将负载萤火虫荧光素酶报告mRNA的tB-UC18 LNPs通过玻璃体内(IVT)、结膜下(SCJ)、前房内(IC)或视网膜下(SR)注射至Wistar大鼠的眼部。研究发现,所有途径在4小时时均可使mRNA在眼部进行表达,但IVT、SCJ和SR组的信号下降(图3)。相比之下,IC注射后眼中的生物发光信号在26小时达到峰值,并在48小时维持升高水平(图1),离体生物发光成像证实信号主要来自晶状体(图3)。因此,选择IC注射用于后续的体内研究。值得注意的是,tB-UC18 LNPs经IC注射后,其递送效率是临床使用的mRNA疫苗载体SM-102 LNPs的7倍以上(图3)。此外,与SCJ和IC注射相比,IVT和SR注射导致更高的肝脏信号,表明该两种眼部给药途径存在脱靶表达。
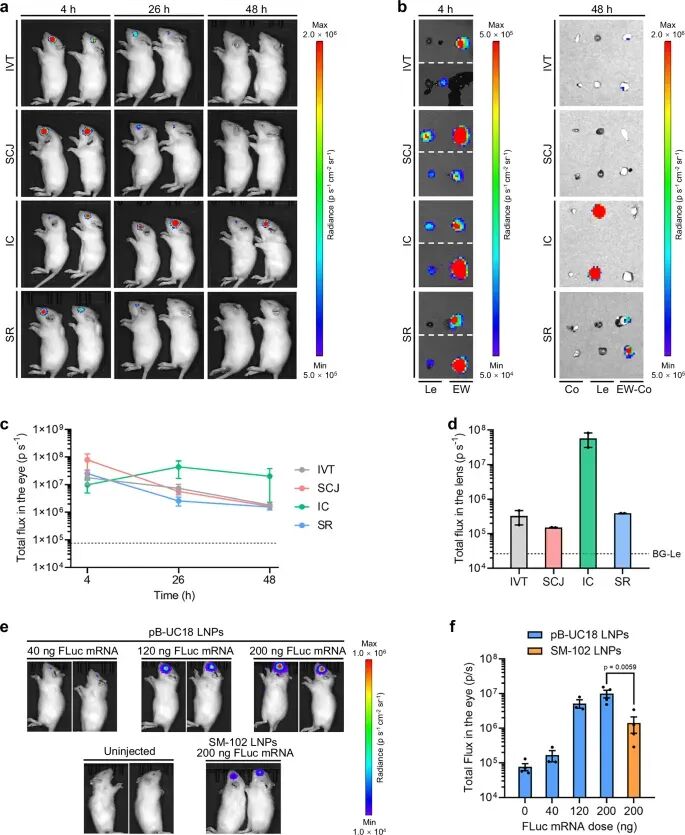
图3. mRNA纳米制剂经不同眼部给药途径后的递送活性
接下来,研究人员根据hLSS蛋白序列设计了hLSS mRNA,并将其负载于tB-UC18 LNPs后通过IC注射至大鼠眼中,以验证hLSS mRNA是否可以在体内成功翻译成hLSS蛋白。免疫荧光分析表明,与未处理组相比,处理过的晶状体表现出更高的hLSS表达(图4)。高表达的hLSS蛋白主要定位在眼球壁(如角膜基质、角膜内皮和脉络膜)、晶状体上皮和晶状体皮质,而不是在晶状体核区(图4)。皮质和核区的差异表达可能归因于特殊的晶状体结构,因为晶状体纤维细胞在分化过程中逐渐失去细胞器和细胞核以达到一定的透明度。此外,液相色谱-质谱定量分析表明,IC注射tB-UC18 LNPs显著提高了不同年龄Wistar大鼠晶状体中的羊毛甾醇水平(图4)。由于眼睛是最精密的器官之一,研究人员在IC注射后对tB-UC18 LNPs进行了全面的安全性评估。在IC注射后24小时,首先使用裂隙灯显微镜评估角膜和晶状体。与未注射组相比,假手术组和LNPs组除角膜穿刺痕迹外,未表现出显著的眼部病变(包括眼睑刺激和发红、角膜混浊和水肿等)(图4)。对苏木精和伊红染色的组织学样本的进一步分析显示,IC注射的mRNA制剂未引起眼睛(图4)和其他主要器官(包括心脏、肝脏、脾脏、肺和肾脏)的明显组织学改变,同时也并未引起眼部组织的结构变化(图4)以及常规血液参数和肝肾功能方面的改变。
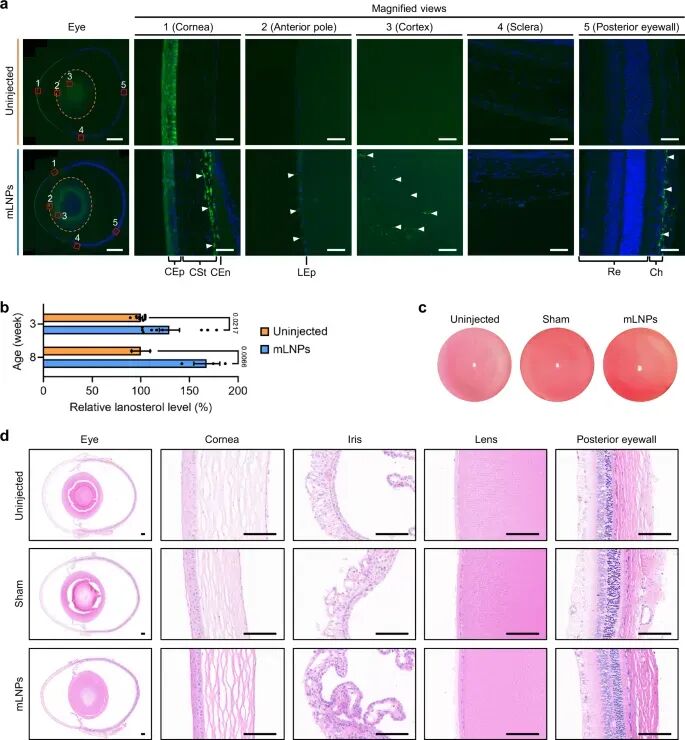
图4. hLSS-LNPs对晶状体羊毛甾醇合酶和羊毛甾醇的调控及生物安全性评价
为了评估mRNA制剂治疗白内障的效果,研究人员建立了两种大鼠白内障模型:通过皮下注射亚硒酸钠诱导的核性白内障模型和通过腹腔注射D-半乳糖诱导的半乳糖白内障模型。对于核性白内障模型,裂隙灯检查和离体视觉检查晶状体显示,与未治疗组以及空白LNPs制剂组相比,LNPs组的晶状体混浊度有显著改善(图5),且晶状体皮质内无明显的不规则排列细胞和大量空泡(图5)。
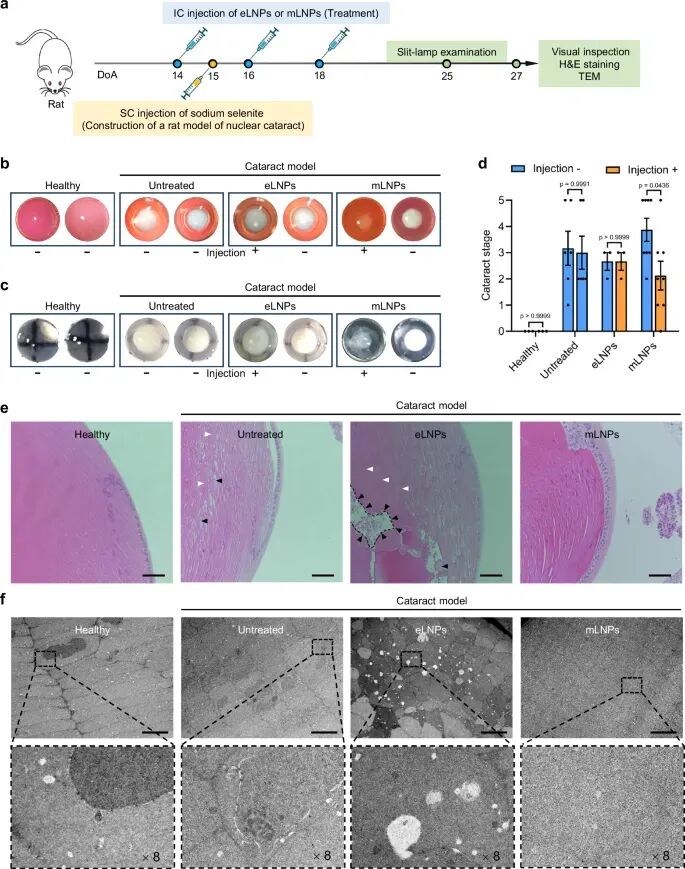
图5. hLSS-LNPs对核性白内障(模拟年龄相关性白内障)的疗效评价
对于半乳糖白内障模型,大鼠经IC注射tB-UC18 LNPs后,晶状体中包括环状赤道样囊泡和放射状混浊在内的相对混浊面积随时间推移而减小(图6)。病理分析进一步证实了晶状体纤维肿胀的明显缓解(图6)。末端脱氧核苷酸转移酶dUTP缺口末端标记染色显示,晶状体上皮和皮质中的凋亡细胞死亡显著减少(图6),这表明通过调节LSS介导的途径可保护晶状体细胞免于凋亡,从而有助于逆转白内障中的蛋白聚集。
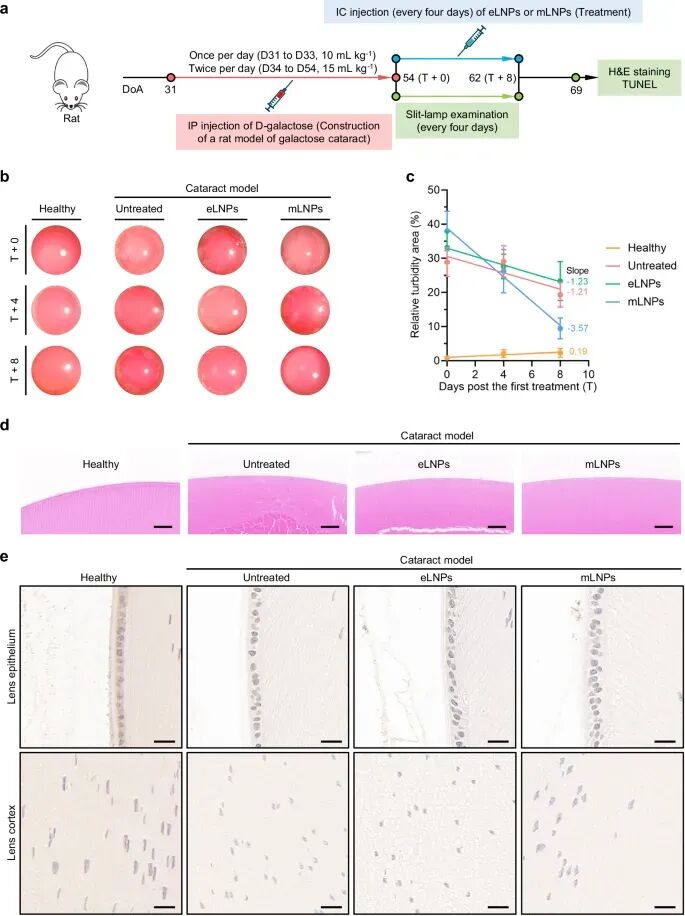
图6. hLSS-LNPs对糖性白内障(模拟糖尿病性白内障)的疗效评价
【结论与展望】
总之,mRNA疗法作为一种新的治疗范式,在疾病预防和治疗方面受到越来越多的关注。近年来,mRNA递送系统的快速发展使得mRNA药物的应用范围扩展到了眼部疾病,如角膜炎症和增殖性玻璃体视网膜病变。本研究报道了使用负载hLSS mRNA的pB-UC18 LNPs作为抗白内障mRNA制剂用于白内障的治疗。通过芳香化LNPs经由IC给药递送至晶状体的hLSS mRNA能够翻译成功能性hLSS蛋白,并以可溶和持久的形式间接提高晶状体内源性羊毛甾醇的水平。在模拟年龄相关性和糖尿病性白内障的两种大鼠白内障模型中,经前房给药的mRNA制剂可有效减轻白内障严重程度,且没有明显的副作用。总之,该研究从mRNA编码羊毛甾醇合酶的角度,通过提高LSS蛋白和羊毛甾醇含量,同时抑制晶状体细胞的凋亡,最终实现逆转晶状体混浊的目的。
原文链接:
https://www.nature.com/articles/s41467-025-63553-5
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)