首页 > 医疗资讯/ 正文
心血管疾病(CVD)是威胁人类生命健康的“头号杀手”,以急性心肌梗死为首的动脉粥样硬化心血管疾病(ASCVD)是导致全球CVD高致死率的主要原因。据最新数据显示,全球ASCVD死亡人数已高达1790万,占全球总死亡人数的30%。动脉粥样硬化(AS)作为ASCVD的主要病理基础,不稳定AS斑块破裂引发的急性冠脉狭窄或闭塞是导致CVD高致死性的主要原因。
蛋白质磷酸酶1调节亚基3B (PPP1R3B)作为糖脂代谢重编程的核心调控因子,近年来被视为连接代谢失衡与免疫紊乱的重要枢纽。在动脉粥样硬化斑块中,PPP1R3B不仅调控巨噬细胞(MΦ)极化过程,还深度参与葡萄糖与脂质代谢稳态,凸显其在ASCVD病理与防治中的双重意义。既往研究表明,PPP1R3B过表达可通过促进糖脂代谢重编程、增强糖原合成及降低低密度脂蛋白胆固醇水平来改善心血管代谢风险,展现潜在的干预价值。然而,其如何通过精确调控糖原代谢重编程来塑造巨噬细胞极化表型并重塑斑块免疫代谢微环境的机制仍未明晰。这一关键科学问题的空缺,不仅限制了AS代谢-免疫互作网络本质的理解,也制约了基于代谢靶点的创新防治策略的发展。
2025年9月23日,温州医科大学纪建松教授、吕玲春教授联合新加坡国立大学陈小元院士(欧洲科学院院士、新加坡国家科学院院士)、邹建华教授团队在Advanced Science发表最新研究成果,题为“PPP1R3B Suppresses Atherosclerosis by Promoting the M2 Polarization of Macrophages Through Glycogen Metabolic Reprogramming”。该研究首次系统阐明了PPP1R3B在动脉粥样硬化进展中的“双重作用”:一方面通过驱动巨噬细胞向抗炎性M2型MΦ极化,有效抑制炎症反应;另一方面通过保障斑块微环境能量代谢动态平衡,延缓AS病灶恶化。进一步机制研究发现,PPP1R3B依赖于磷酸化STAT3 (p-STAT3)构建代谢-免疫协同的双通路网络:在细胞核内,主要通过PPAR-γ/PGC-1α/CD206轴激活抗炎转录程序;在线粒体内,主要通过p-GSK-3β/p-PYGL/p-GYS2轴促进糖原分解与能量代谢,从而在斑块微环境中实现巨噬细胞免疫调控与能量代谢重编程的精准协同。该研究不仅揭示了PPP1R3B在动脉粥样硬化斑块免疫-代谢互作中的重要作用,也为阐明ASCVD发生发展的分子机制提供了全新视角。

本研究首先基于基因表达综合数据库(GEO)系统解析了人类动脉粥样硬化斑块的免疫微环境调控基因特征。对GSE57614数据集中36例人类斑块组织的RNA-seq数据进行差异分析,共鉴定到4283个差异表达基因,其中1959个显著上调,2324个下调。功能富集结果显示,这些基因主要富集于免疫识别与炎症相关信号通路,包括NOD样受体、TNF信号通路等,提示炎症信号在M1型MΦ中呈显著激活,而在M2型MΦ中受到抑制,揭示了巨噬细胞极化状态与斑块炎症反应之间的分子联系。进一步的STRING、Metascape及Cytoscape网络分析表明,PPP1R3B与多种糖原代谢相关蛋白(如PP1家族成员、GYS1)存在紧密相互作用,功能富集结果显示其涉及蛋白磷酸化、糖原代谢调控及胰岛素抵抗等关键生物学过程。功能验证实验进一步确认,PPP1R3B在M2型MΦ中的表达水平显著高于M0和M1型MΦ,并与M2型MΦ标志物CD206高度共定位;而在动脉粥样硬化斑块组织中,PPP1R3B表达显著下调,伴随M1型MΦ标志物CD86的上调,提示其在病理条件下存在功能失衡。综合结果表明,PPP1R3B是调控巨噬细胞极化和糖原代谢的关键差异基因,其下调可能加速AS斑块恶化。
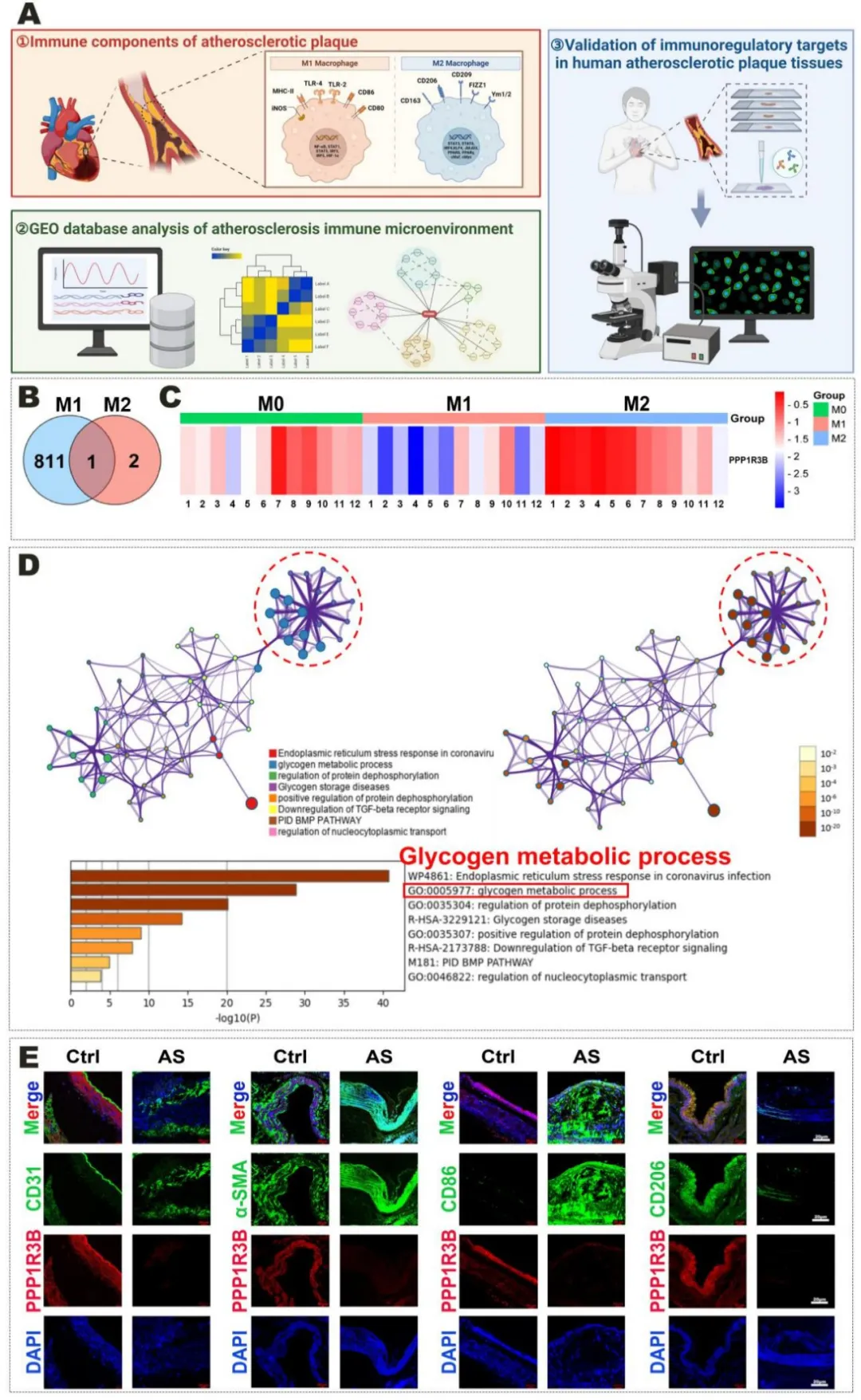
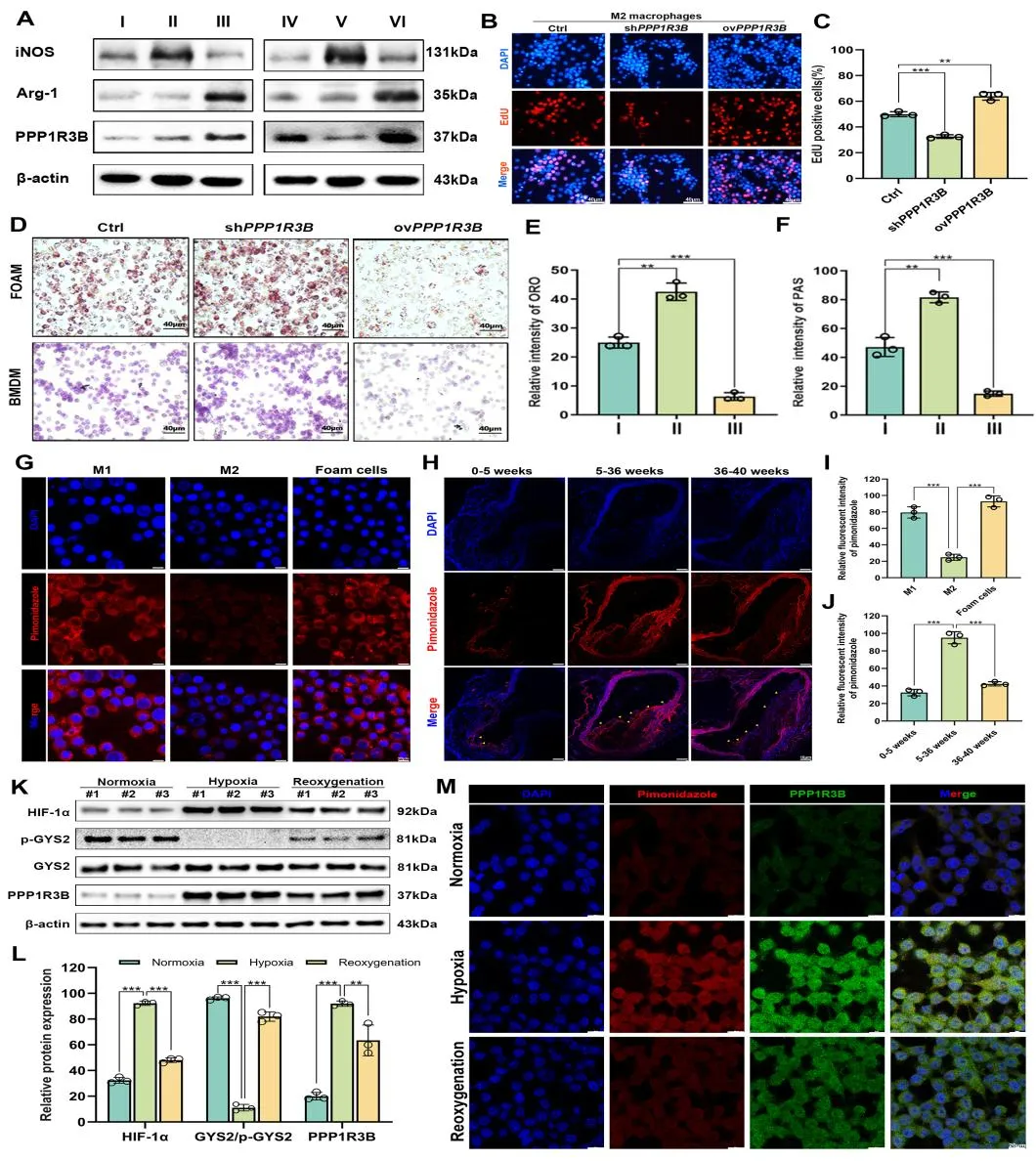
为系统解析PPP1R3B在AS相关MΦ极化与代谢重编程中的作用机制,本研究分别构建了其过表达(ovPPP1R3B)与敲低(shPPP1R3B)的体内外模型。功能实验显示,ovPPP1R3B可显著上调M2型MΦ标志物ARG1的表达,并促进M2型MΦ的增殖与细胞周期进程;相反,shPPP1R3B则增强M1型MΦ标志物iNOS的表达,并抑制M2型MΦ极化。代谢分析进一步揭示,ovPPP1R3B能增强巨噬细胞来源泡沫细胞的胆固醇外排并降低糖原沉积,而shPPP1R3B导致脂质蓄积及糖原累积,提示PPP1R3B在脂质稳态与糖原代谢调控中发挥双重作用。免疫荧光结果亦显示,PPP1R3B在M2型MΦ中呈高表达,而在AS斑块中则显著下调,提示其功能缺失可能与斑块炎症反应增强密切相关。在缺氧状态下,PPP1R3B与HIF-1α协同上调,抑制氧化磷酸化并通过激活p-GYS2介导的糖原分解维持能量稳态,而复氧后该代谢适应性改变可逆转。动物实验进一步证实,晚期AS斑块区域呈现持续缺氧状态,而PPP1R3B在此过程中显著上调,并对M2型MΦ极化与代谢重编程发挥关键调控作用。
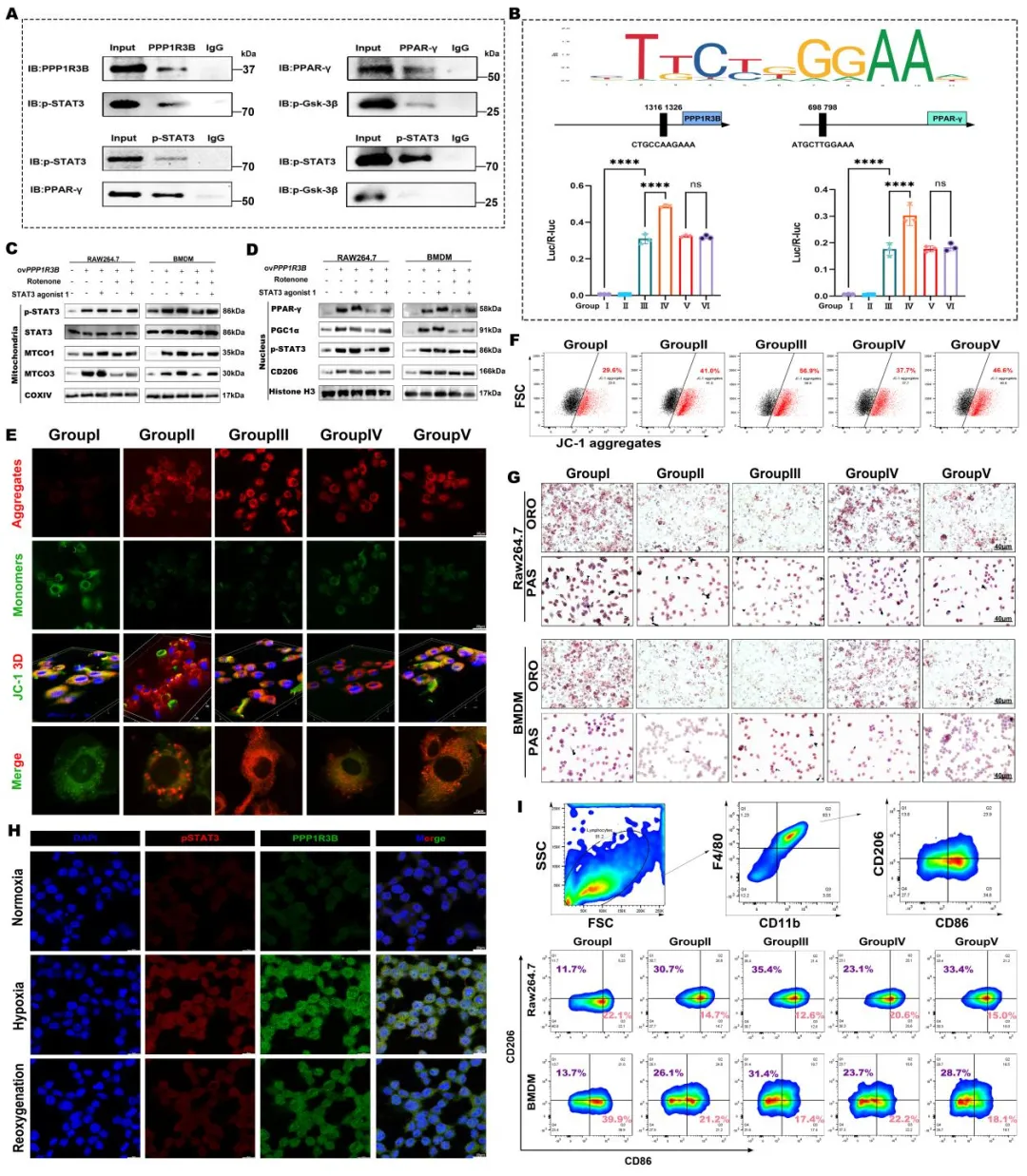
基于高通量测序与蛋白质组学分析,研究发现PPP1R3B与STAT3存在潜在互作关系,因此进一步构建相关体内外模型以阐释其在巨噬细胞免疫代谢中的作用机制。结果显示,ovPPP1R3B与STAT3结合可显著增强PPP1R3B表达与p-STAT3磷酸化水平,并上调线粒体功能相关蛋白(MT-CO1、MT-CO3)及PPAR-γ、PGC-1α和CD206的表达,从而驱动M2型MΦ极化,而STAT3抑制剂Stattic可逆转上述效应。代谢检测进一步表明,PPP1R3B与STAT3协同作用可显著提升线粒体膜电位,促进糖原降解与胆固醇外排。在缺氧条件下,p-STAT3激活先于PPP1R3B上调,二者在细胞质及细胞核区域共定位,提示p-STAT3作为上游信号驱动PPP1R3B转录及亚细胞定位,形成氧敏感信号模块以支持M2型MΦ适应缺氧微环境。进一步蛋白互作分析显示,PPP1R3B与p-STAT3存在特异性结合,而STAT3信号阻断呈剂量依赖性抑制糖原代谢与M2型MΦ极化。因此,PPP1R3B通过与STAT3相互作用并增强其磷酸化,协同驱动线粒体能量代谢与糖脂分解,同时促进M2型MΦ极化,确立其在缺氧炎症环境中作为免疫代谢重编程核心枢纽的全新功能。
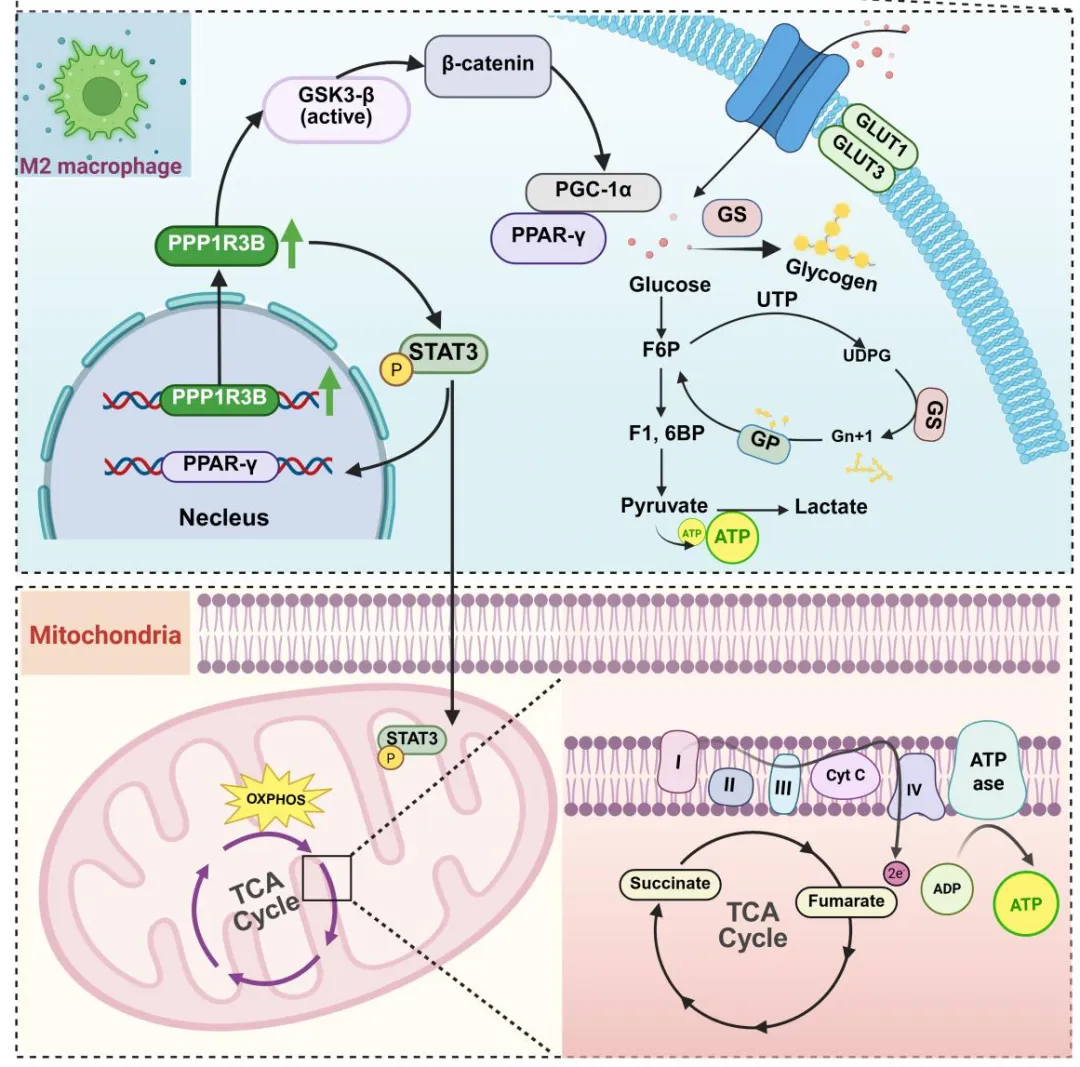
综上,本研究系统揭示了PPP1R3B在动脉粥样硬化斑块缺氧微环境中的关键作用,并阐明其通过调控STAT3及下游信号通路驱动M2型MΦ极化和糖原代谢重编程的分子机制。PPP1R3B上调可激活STAT3、PPAR-γ、PGC-1α与GSK3β信号轴,促进抗炎基因表达与代谢重编程,同时通过GLUT1/GLUT3介导的葡萄糖摄取及糖原合酶/糖原磷酸化酶的动态调控,维持糖原合成与分解平衡。在线粒体水平,PPP1R3B/STAT3轴的激活促进糖原降解、驱动三羧酸循环和氧化磷酸化代谢,从而增加ATP生成速率以维持M2型MΦ能量供给。由此,PPP1R3B将免疫表型转化与能量代谢适应紧密耦联,在缓解局部炎症的同时促进动脉粥样硬化斑块稳定,揭示其在斑块免疫代谢互作中的核心作用,并为阐释ASCVD发生发展的分子机制提供全新视角。
本研究由温州医科大学纪建松教授、吕玲春教授与新加坡国立大学陈小元院士、邹建华教授联合完成,温州医科大学附属第五医院沈霖博士后、虞俊超博士及陈为谦博士后为本研究的共同第一作者。该工作得到了国家重点研发计划、国家自然科学基金、中国博士后科学基金以及浙江省自然科学基金等项目的资助。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202506345
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)