首页 > 医疗资讯/ 正文
骨髓原始细胞百分比的评估对于急性白血病的反应标准至关重要。在更新的实验室实践框架内,需要减少临床实验室用于报告原始细胞值的方法的不一致性,并澄清报告的各个方面。
来自国际专业工作组的代表,包括欧洲血液学协会(EHA)血液病诊断专业工作组和欧洲白血病网络(ELN),制定了统一的原始细胞评估共识指南,以定义急性白血病患者的反应类别,近日发文于《Haematologica》。该指南涉及采样的最佳实践、生成最准确原始细胞计数的关键考虑因素,以及在急性淋巴细胞白血病(ALL)、急性髓系白血病(AML)和急性系列不明白血病中各方法的局限性,为ALL和AML提供了推导原始细胞百分比的综合报告方案,结合了适当的可测量残留病(MRD)检测结果与形态学交叉核对。本文提出的实用指南和方法应有助于在临床试验和更广泛的临床实践中促进统一的报告标准。

引言
急性白血病治疗反应的评估需要记录骨髓原始细胞百分比。根据国际工作组(IWG 2003)标准,该百分比基于形态学原始细胞计数确定。尽管这种方法多年来已广泛用于临床实践,但由于其主观性、区分非肿瘤性与白血病性原始细胞的能力有限,以及操作者间(即使是专家之间)存在显著差异,它其并不完美。
在过去的二十年中,随着综合报告、临床流式细胞术和可测量残留病(MRD)检测技术的进步,临床实验室实践也在不断发展。强有力的证据支持MRD检测在测量急性白血病治疗反应中的应用,此类检测旨在直接识别残留白血病,而形态学原始细胞是其替代指标。然而,在定义反应类别的原始细胞方面仍然存在不确定性,业界担忧原始细胞百分比的推导方法缺乏标准化。治疗后骨髓(BM)中原始细胞百分比的报告具有重要影响,涉及临床试验终点、复发/难治性研究的入组资格、真实世界结果的比较以及血液肿瘤诊断的国际培训。
继2024年FDA小型研讨会(“用于反应评估的急性白血病原始细胞定量方法”)强调了临床实验室用于报告原始细胞百分比的方法存在不一致性和实际挑战之后,召集了一个急性白血病诊断专家小组。该小组包括来自欧洲白血病网络(ELN)、欧洲血液学协会(EHA)血液病诊断专业工作组以及其他涉及成人和儿童急性白血病治疗的大型国际中心的代表。本文提出了专家组关于急性白血病治疗后BM原始细胞计数的共识指南,该指南结合了适当的辅助检测,并与更新的临床实验室实践保持一致。这些建议提供了协调各机构间报告的标准,促进数据的可比性,并增强急性白血病反应评估的可靠性。
采样
为了最佳解释,需要关于治疗后的时间和外周血(PB)计数的信息,这对于在计数恢复前进行的BM检查尤为重要。尽管在某些中心,早期(第14-21天)BM检查仍然是指导第二次诱导治疗的常见做法,但用于分类缓解状态的BM检查应在计数恢复时或预期计数恢复时进行(“强化化疗后第28-35天”)。
对于治疗后BM检查,实践因不同的治疗方案、患者群体、机构和地理区域而异。一些中心仅进行BM穿刺抽吸,伴或不伴用于组织学的血凝块制备,而其他中心除了BM抽吸物外,还常规包括环钻活检和压印片。
操作者应避免为细胞形态学分配过多的BM抽吸物体积,因为这会损害MRD样本的“首次抽取”质量。用于BM涂片的BM抽吸物不应超过0.5 mL。同一单次(“首次抽取”)抽吸的剩余体积,最多4mL,应保留用于最合适的MRD检测,根据需要平均分配给分子和流式样本。当外周血计数接近正常时,每次MRD评估通常需要2 mL BM。BM抽吸超过最初2-4 mL后会发生血液稀释,可能导致MRD显著低估。EDTA抗凝剂通常优选用于分子MRD检测,也可用于细胞形态学和流式细胞术。
最佳实践是在患者床旁制备BM抽吸物涂片,不仅是为了保存细胞形态学,也是为了检查是否存在BM颗粒,如果质量不足,可以立即重复BM抽吸。
表1提供了充分抽吸样本的评估标准。

专家组承认,在缓解评估时进行BM环钻活检并非许多国家的常规做法。然而,当抽吸材料不足时,或当先前的BM抽吸物因质量不足(如坏死、纤维化、细胞减少或斑片状原始细胞浸润)而不适合进行分类计数时,应进行BM环钻活检。在这些情况下,应制作环钻活检的压印片(理想情况下2-3张),因为它们可以在这些情况下提供改良的细胞形态学评估。
形态学
通过压片(挤压)或推片方法制备的充分BM涂片应包含多个小粒(spicules)和具有代表性的造血细胞混合物,包括巨核细胞、有核红细胞、粒细胞及其前体细胞。组织细胞、浆细胞和肥大细胞的存在进一步证实了骨髓的代表性(表1)。涂片应良好铺展成薄单层,使用高质量的Wright-Giemsa或May-Grünwald-Giemsa均匀染色,且无人工假象。细胞应保存良好,显示清晰的核和胞质细节。
当骨髓颗粒缺失或稀少(由于过度血液稀释[干抽]所致),或存在小粒但无细胞、坏死或退行性变时,BM涂片被认为不充分(表1)。不充分也可能源于不适当的空气干燥、固定问题、细胞保存不良或染色质量欠佳。术语“次优”指的是质量介于“充分”和“不充分”之间的涂片,其中骨髓细胞存在且可计数,但存在血液稀释或细胞数量少。在这种情况下,应提供免责声明以评论样本质量。
形态学计数应在BM小粒附近进行,那里造血细胞最集中。应评估多个涂片,特别是在原始细胞分布不均的情况下。BM原始细胞计数基于500个细胞的计数。专家组认识到原始细胞计数容易受到观察者间变异的影响。区分白血病性原始细胞与“原始细胞模拟细胞”,如再生的髓系前体细胞、反应性单核细胞或造血前体细胞(hematogones,正常前体B细胞)或浆细胞样树突状细胞,可能具有挑战性,并且在许多情况下是不可能的。此外,发育不良的髓细胞、早幼粒细胞和幼红细胞可能被误分类为原始细胞。由于不寻常的细胞形态学,原始细胞也可能被低估。例如,小原始细胞可能被误认为淋巴细胞,具有嗜碱性胞质的原始细胞可能被误认为早幼红细胞、非典型淋巴细胞或单核细胞,或有颗粒的原始细胞可能与早幼粒细胞混淆。
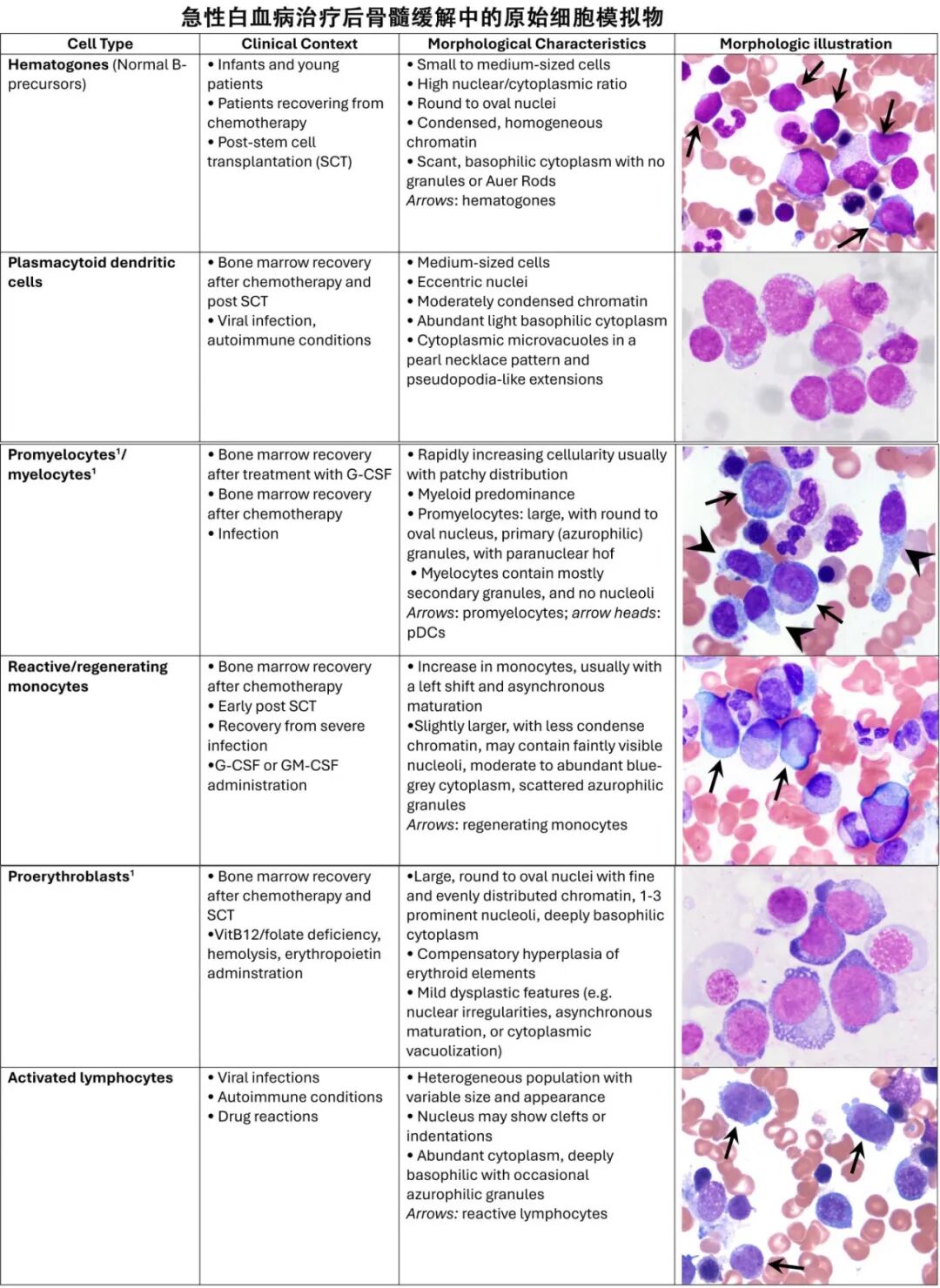
综合缓解报告
急性淋巴细胞白血病(ALL)
在急性淋巴细胞白血病(ALL)中,建议采用经过适当验证的MRD检测取代形态学作为评估BM缓解的金标准。形态学原始细胞计数≥5%并不能定义持续性疾病或复发,除非通过适当的MRD检测(如流式细胞术、定量(q)PCR和二代测序(NGS))或通过诊断性遗传学检测(荧光原位杂交(FISH)或核型分析)确认为白血病性。相反,如果MRD检测呈阳性,形态学原始细胞计数<5%不再定义为缓解。反应原始细胞百分比的主要报告应由具有最低验证灵敏度为0.01%的MRD检测完成,例如流式细胞术、等位基因特异性qPCR或扩增子NGS来定量克隆性免疫球蛋白(IG)和/或T细胞受体(TR)基因重排。
需要注意的是,BM样本质量和血液稀释无法通过分子MRD检测评估。这一局限性也适用于流式细胞术ALL MRD检测,除非纳入适当的髓系标记来通过粒细胞或肥大细胞的百分比评估血液稀释。
如果涂片的细胞形态学评估和MRD样本源自同一(首次抽取)BM抽吸源,则前者可作为MRD样本充分性的指标。推荐使用细胞形态学用于此目的,并识别原始细胞计数与MRD结果之间的任何重大差异。后者对于识别潜在的MRD靶点丢失尤为重要,例如谱系转换,特别是在伴有KMT2Ar(流式细胞术或IG/TR白血病标记丢失)、DUX4r、ZNF384r-或PAX5-P80R- ALL或免疫治疗后(流式细胞术白血病设门标记如CD19和CD22丢失)的情况下。此外,细胞形态学还可以识别由于MRD样本质量问题(如运输延迟或有核红细胞(RBCs)过度裂解)导致的MRD检测对抽吸物白血病原始细胞百分比的任何显著低估或高估。
图1显示了在综合反应评估中报告原始细胞百分比及适当样本限定条件的建议。重要的是,一致认为 MRD 阳性 BM 样本的原始细胞百分比应仅通过细胞形态学计数报告,前提是细胞形态学和 MRD 检测之间的原始细胞类别存在重大差异,并且,如果由于 MRD 靶标丢失或非代表性 MRD 样本,细胞形态学更准确的概率较高。

下面总结了在缓解评估期间生成最准确的ALL原始细胞计数的关键考虑因素及推荐的原始细胞检测方法。
流式细胞术
在已发表的临床验证研究中,用于计算流式细胞术ALL MRD百分比的细胞分母存在差异(总有核细胞、非红细胞或单个核细胞),这种差异延伸至当前不同国际试验网络使用的检测方法。总有核细胞作为分母与细胞形态学原始细胞计数和许多分子方法一致。加入核染料可提高准确性,特别是在红细胞裂解不理想的情况下。通过使用含裂解试剂的固定剂保存有核红细胞、在洗涤步骤中优化细胞回收率以及使用低前向散射采集阈值/鉴别器对于准确计数非常重要。如果有核红细胞的保存可能不理想,则需要与细胞形态学进行综合报告,以识别伴有红系增生的病例。在MRD阳性样本中,当存在显著红系增生时,使用非红细胞作为分母报告的MRD百分比值可能显著高于源自总有核细胞的MRD值。不建议使用单个核细胞作为分母来评估BM缓解。
在靶向治疗后,例如B-ALL中的抗CD19治疗,应采用替代的主要设门策略进行白血病细胞识别。
分子方法
IG/TR MRD评估,无论是使用qPCR还是NGS,都是定量ALL MRD的分子金标准。在KMT2A重排ALL中,IG/TR重排可能缺失或在疾病过程中显示克隆演变,从而影响MRD监测。相比之下,KMT2A重排是一个高度稳定的标志物,因此是该分子亚组中推荐的MRD标志物,可通过qPCR测量。在费城染色体(Ph)+ ALL中,BCR::ABL1的逆转录酶qPCR(RT-qPCR)常用于监测MRD。RT-qPCR在cDNA水平量化基因表达,转录本水平相对于守门员基因(通常是ABL或GUS)进行标准化。因此,通过RT-qPCR获得的MRD值不能与通过IG/TR或流式细胞术测量的MRD直接比较。此外,在大约40%的Ph+ ALL中,BCR::ABL1易位并不局限于ALL区室,导致相当一部分患者中通过RT-qPCR检测的BCR::ABL1与通过IG/TR或流式细胞术检测的MRD之间存在显著差异。BCR::ABL1转录本可以在不同谱系中发现,包括成熟的髓系细胞。因此,不应从阳性的BCR::ABL1 MRD值报告白血病原始细胞百分比。然而,监测BCR::ABL1对于指导Ph+ ALL的TKI治疗仍然很重要。
在其他B-ALL亚型中,当源自白血病克隆的小单核细胞亚群在治疗后持续存在(例如Ph样B-ALL)或发生单核细胞转分化(例如DUX4重排ALL)时,分子MRD与流式细胞术或细胞形态学之间也可能存在不一致。在T-ALL中,分子MRD与细胞形态学或流式细胞术值之间的差异可能源于治疗后白血病向更成熟免疫表型(类似于成熟T细胞)的分化。
细胞形态学
应考虑原始细胞模拟细胞和抽吸物充分性。基于BM环钻活检评估原始细胞将解决对BM再生障碍、坏死或纤维化的担忧,但达不到流式细胞术和IG/TR NGS用于MRD的准确性和灵敏度水平。
急性髓系白血病(AML)
图2显示了在AML综合反应评估中报告原始细胞百分比及适当样本限定条件的建议。

在AML中,强烈建议根据ELN建议,使用具有最低验证阈值为0.1%的适当检测方法(流式细胞术、qPCR或NGS)进行MRD分析。该建议确保对所有AML患者进行统一的反应报告。如果满足MRD样本充分且MRD靶点丢失概率低的标准,则通过适当的残留病检测获得的MRD阴性结果应视为原始细胞水平<0.1%(或<检测限)的缓解。如果适当的MRD检测或AML和高危MDS的其他遗传异常诊断检测结果为阴性,则形态学原始细胞计数≥5%并不定义为持续性疾病或复发。
在充分、有代表性的BM抽吸物中,通过流式细胞术测量髓系原始细胞进行反应评估比形态学更准确和可重复,这是由于细胞形态学固有的主观性以及区分髓系原始细胞与再生的髓系前体细胞和其他髓系原始细胞模拟细胞的挑战。但也存在例外情况,特别是在某些AML亚型中,例如急性巨核细胞白血病(AMKL)、红系(急性红系白血病,AEL/纯红系白血病,PEL)和急性单核细胞AML。AMKL通常伴有显著的BM纤维化,导致干抽,并且经常需要环钻活检和免疫组织化学研究来进行残留AML评估。流式细胞术可能会低估残留的AEL/PEL,取决于样本制备过程中使用的红细胞裂解程序或用于定义白血病性早幼红细胞的标记组合有限。急性单核细胞白血病可能显示出与成熟单核细胞相似的免疫表型,这限制了准确识别白血病性单核细胞的能力。由于这些原因,如果BM细胞形态学显示25%的原始细胞且MRD结果阳性,则这些AML亚型的原始细胞百分比应继续通过细胞形态学计数报告。否则的话,建议对于MRD阳性抽吸物中的原始细胞百分比,主要报告应通过流式细胞术进行,除非流式细胞术样本质量无代表性且形态学上存在重大差异性的过多原始细胞。
下面按原始细胞检测方法、AML亚型和样本质量,总结了在缓解评估期间生成更准确的AML原始细胞计数的关键考虑因素。
流式细胞术
对于AMLs反应评估中原始细胞的计数,建议使用流式细胞术MRD检测。以下指南也适用于标准的流式原始细胞计数,例如当患有CBF或NPM1突变AML的患者通过ELN PCR MRD检测进行监测而没有并行流式MRD检测时。
根据ELN MRD建议,原始细胞百分比的分母是表达CD45的细胞(排除CD45阴性RBCs、血小板团块和碎片)。定义总髓系原始细胞区室需要CD34、CD117(未成熟性)以及HLA-DR(粒细胞系列的未成熟性)、CD33、CD13(髓系系列)、CD45和光散射参数(图3)。总髓系原始细胞最一致地量化为CD45/SSC“原始细胞区域”(CD45和SSC中/低)内排除技术假象、CD34+造血前体细胞和CD117+非原始细胞后的CD34+和/或CD117+细胞。后者包括未成熟红系前体细胞、未成熟NK细胞(通常CD117弱伴有较高的CD45表达,CD7+, CD56+)、早幼粒细胞、嗜碱性粒细胞亚群、肿瘤性浆细胞(CD38高)和肥大细胞(CD117高)。AML原始细胞很少为CD45阴性,但应考虑这种可能性,并相应调整CD45设门。在仅表达低水平CD34和/或CD117的AML原始细胞中,HLA-DR有时可作为未成熟性的主要标志物。这种方法提供了一个原始细胞百分比,但通常对于MRD检测特异性不足,除非主要的免疫表型异常允许对白血病祖细胞进行离散设门。
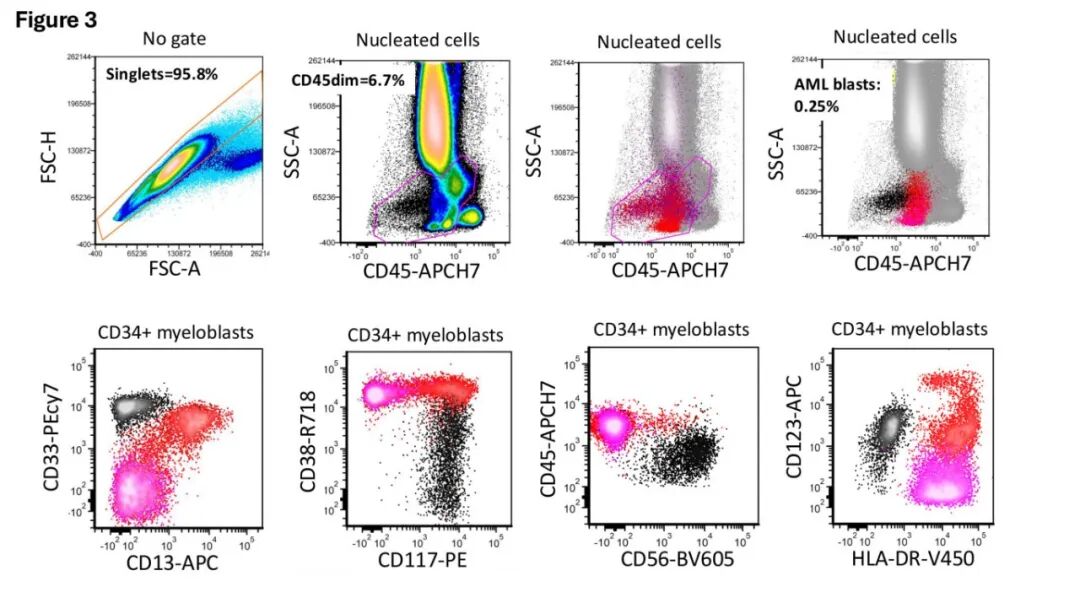
急性单核细胞白血病的残留原始细胞/前单核细胞可能由于较高的CD45表达和/或侧向散射特征(单核细胞区域)而落在此CD45/SSC原始细胞门外,并且通常缺乏CD34和/或CD117的表达。异步单核细胞标记的异常表达{例如,CD14, CD11b, HLA-DR, CD35, CD300e}有助于区分白血病性单核细胞原始细胞与正常单核细胞,但关于未成熟性的确定性较低,并且与CD34+和/或CD117+ AML原始细胞的MRD检测相比特异性较低。
显示未成熟性标记(如CD117)但具有较高SSC且落在CD45/SSC原始细胞区域外的髓系细胞,如果基于偏离正常髓系前体细胞的免疫表型谱判断为异常,则应量化为AML原始细胞。
患者的白血病祖细胞可能由几个具有不同CD34和CD117表达以及异质性异常的亚群组成,让人联想到紊乱的正常成熟模式。偶尔可见,白血病细胞的异常性不足以与正常祖细胞区分开来。在MRD阳性抽吸物中,流式细胞术检测的总髓系原始细胞百分比与MRD百分比之间存在差异性的过高,可能是由于白血病亚群中的这种情况——此时总髓系原始细胞百分比是潜在受累上限的估计——或者,是由于短暂性的正常造血反弹/再生。如果怀疑是后者,例如在儿科患者中,应在综合报告中注明,但不应误解为残留白血病。
分子方法
大多数AML定义的遗传异常涉及需要基于RNA检测的融合或重排。需要注意的是,在AML MRD阳性BM抽吸物中,无法从测量AML定义基因融合或NPM1突变的RT-qPCR MRD检测中推导出原始细胞百分比,因为每个白血病细胞的RNA转录本数量、分化细胞和非分裂细胞中的RNA转录本存在变异性。目前, NPM1突变是唯一适合在MRD阳性样本中通过基于DNA的VAF频率量化原始细胞百分比的AML定义遗传异常。其他用于基于DNA的MRD检测的靶基因突变要么可能是亚克隆且不稳定的(FLT3突变),要么可能是白血病前期的(例如IDH2, SRSF2),要么验证不足(CEBPA)。
在分化治疗(如FLT3抑制剂、IDH抑制剂和新兴的menin抑制剂)的背景下,非原始细胞在成熟过程中可能保留AML遗传异常。这与急性早幼粒细胞白血病(APML)在ATRA和砷剂诱导后观察到的情况相似。这些细胞的延迟清除可能导致分子MRD频率与通过细胞形态学和流式细胞术进行的常规原始细胞计数之间的差异。因此,原始细胞报告应仅限于通过细胞形态学和流式细胞术定义为原始细胞的细胞,排除分化中的细胞。在APML中,BM反应评估最重要的时间点是巩固治疗结束时而非诱导后,并且必须包括用于分子缓解的RT-qPCR MRD检测。
细胞形态学
类似于ALL的细胞形态学评估,也应考虑原始细胞模拟细胞和抽吸物充分性。对于被视为原始细胞等价物的前单核细胞,其模拟细胞包括反应性/再生性单核细胞和发育不良的早幼粒细胞。使用分化治疗时,不完全的白血病原始细胞分化可能导致保留原始细胞样特征,例如Auer小体的持续存在。这在ATRA和砷剂诱导后的APML BM中很常见。
评估BM环钻活检将解决对BM再生障碍、坏死或纤维化的担忧。BM纤维化常见于AMKL、从骨髓增殖性肿瘤(MPN)或伴有纤维化的MDS进展而来的AML,以及某些急性白血病亚型,如伴有_MECOM_重排的AML。适当时,可在纤维化BM上进行CD34和/或CD117免疫组织化学以估计原始细胞百分比。AMKL通常需要对环钻活检进行免疫组织化学研究(例如,CD31, CD41, CD42b和CD61)以进行原始细胞计数。E-钙粘蛋白免疫组织化学可能对PEL的诊断有价值。
在具有显著BM纤维化的患者中,即使没有过多的BM原始细胞,也可能存在循环原始细胞,这在综合报告时应予以考虑。
系别模糊急性白血病(ALAL)
ALAL包括急性未分化白血病(AUL)和混合表型急性白血病(MPAL)。虽然AUL缺乏系列定义标记,但MPAL中的原始细胞表达多于一个系列的系列特异性标记。MPAL可能呈现为表达髓系和淋巴系定义标记的单一原始细胞群(双表型或混合表型),或呈现为独立的髓系和淋巴系原始细胞群(双系或混合系列)。然而,在MPAL中,相当常见的是在给定病例中观察到混合系列和混合表型原始细胞的组合,其中一些标记由所有原始细胞共享,而其他标志物的表达则存在差异。
在ALAL反应评估期间报告原始细胞百分比需要一个包含所有受累系列基本标记的流式细胞术 panel。准确计数可能具有挑战性,特别是在MPAL中,核心原始细胞标记如CD34可能在原始细胞亚群中显示异质性表达,并且单一的系列MRD panel可能无法完全捕获异常的差异性。
在选择适当的panel时,重点放在白血病相关免疫表型(LAIP)上;然而,这些白血病特别容易发生表型改变和谱系转换,因为初始治疗通常选择靶向一个系列,因此通常需要一个评估所有相关系列的更全面的panel。对于AUL或具有一个原始细胞群的MPAL,只要panel中包含必要的标记,AML MRD或ALL MRD panel可能就足够了。在双系MPAL中,通常需要同时通过AML MRD和ALL MRD panel进行评估。最后,流式细胞术评估ALAL和MPAL中的MRD提出了独特的挑战,因为某些对于系列分配至关重要的标记(即髓过氧化物酶、胞浆CD3)可能不属于推荐和/或验证的AML MRD panel。
由于遗传重排在MPAL中很常见,MRD阴性可能通过适当的基于RNA或DNA的PCR检测(BCR::ABL1,涉及KMT2A的重排)来定义,但针对更罕见重排(ZNF384等)的检测需要进一步验证。
总结与展望
建立报告原始细胞百分比的标准化标准对于确保急性白血病统一反应和复发评估至关重要,此类标准应反映与国家研究组和国际联盟相关的实验室网络在急性白血病管理中的常见实践和经验。此次召集的国际专家小组就此处提出的所有建议方面达成了共识。实施国际统一的原始细胞百分比报告程序有望提高试验和中心间数据录入的一致性和质量。尽管在某些中心和國家,获得适当的MRD技术可能受到限制,但这些检测是准确和敏感定量原始细胞的基础。MRD检测旨在直接识别残留白血病,而形态学原始细胞是非肿瘤性和白血病性祖细胞的混合物。因此,形态学原始细胞计数与白血病治疗反应之间的联系本质上是不完美的。尽管如此,形态学在治疗反应的全面评估中继续发挥着关键作用。在我们建议的框架内,形态学应用于提供定性评估,该评估包含所有BM样本的反应类别,并在流式细胞术或NGS原始细胞计数存在公认局限性时(正如我们专家小组建议中概述的那样)用于定量报告。形态学与其他方法之间的差异通常与治疗背景相关,从而强调了确保在申请时包含适当临床信息(白血病亚型、治疗/时间点/PB计数和G-CSF使用)的重要性。将人工智能应用于数字化形态学涂片和流式细胞术数据可能会进一步增强形态学的作用,并在未来改进标准化的原始细胞计数。此外,MRD检测的国际外部质量保证计划应在跨实验室(特别是那些参与临床试验报告的实验室)交叉验证原始细胞百分比结果方面发挥关键作用。最后,较长的检测周转时间可能会妨碍及时的综合反应报告,从而影响快速治疗决策。这对于分子MRD尤其相关,部分原因是这些测试需要批量进行。因此,强烈鼓励区域努力通过改进这些检测的周转时间来减少差异。
参考文献
Sa A. Wang, Leonor Arenillas, Francesco Buccisano, Monika Bruggemann, Wolfgang Kern, Manuel Menes, Adriana Plesa, Louisa Stone, Dominique Wellnitz, David A. Westerman, Brent L. Wood and Sylvie D. Freeman. Reporting blast percentage for response assessment in acute leukemias: recommendations from an EHA/ELN expert panel. Haematologica. 2025 Sept 4. doi: 10.3324/haematol.2025.288228
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)